Casi todos hemos calentado un recipiente con agua con la tapa en su lugar y poco después escuchamos el ruido de la tapa traqueteando y el agua caliente derramándose sobre la estufa. Cuando se calienta un líquido, sus moléculas obtienen suficiente energía cinética para superar las fuerzas que lo mantienen en el líquido y escapan a la fase gaseosa. Al hacerlo, generan una población de moléculas en la fase de vapor por encima del líquido que produce una presión: la presión de vapor del líquido. En la situación que describimos, se generó suficiente presión para mover la tapa, lo que permitió que el vapor escapara. Sin embargo, si el vapor está contenido en un recipiente sellado, como un matraz sin ventilación, y la presión de vapor es demasiado alta, el matraz explotará (como desafortunadamente muchos estudiantes han descubierto). En esta sección, describimos la presión de vapor con más detalle y explicamos cómo determinar cuantitativamente la presión de vapor de un líquido.
Evaporación y condensación
Debido a que las moléculas de un líquido están en constante movimiento, podemos graficar la fracción de moléculas con una energía cinética dada ( KE ) contra su energía cinética para obtener la distribución de energía cinética de las moléculas en el líquido (Figura ( PageIndex {1} )), tal como lo hicimos con un gas. En cuanto a los gases, el aumento de la temperatura aumenta tanto la energía cinética promedio de las partículas en un líquido como el rango de energía cinética de las moléculas individuales. Si suponemos que se necesita una cantidad mínima de energía ( (E_0 )) para superar las fuerzas de atracción intermoleculares que mantienen unido un líquido, entonces alguna fracción de las moléculas en el líquido siempre tiene una energía cinética mayor que (E_0 ) . La fracción de moléculas con una energía cinética mayor que este valor mínimo aumenta al aumentar la temperatura. Cualquier molécula con una energía cinética mayor que (E_0 ) tiene suficiente energía para superar las fuerzas que la sostienen en el líquido y escapar a la fase de vapor. Sin embargo, antes de que pueda hacerlo, una molécula también debe estar en la superficie del líquido, donde es físicamente posible que salga de la superficie del líquido; es decir, solo las moléculas en la superficie pueden sufrir evaporación (o vaporización) , donde las moléculas obtienen suficiente energía para entrar en un estado gaseoso por encima de la superficie de un líquido, creando así una presión de vapor.
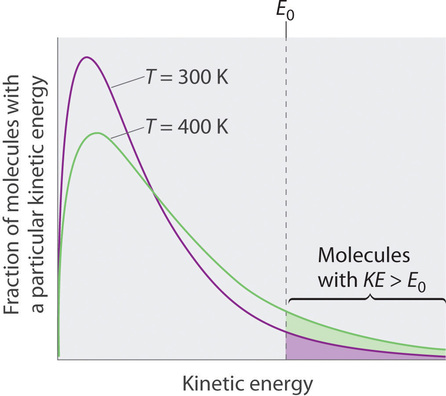
Para comprender las causas de la presión de vapor, considere el aparato que se muestra en la Figura ( PageIndex {2} ). Cuando se introduce un líquido en una cámara evacuada (parte (a) en la Figura ( PageIndex {2} )), la presión inicial sobre el líquido es aproximadamente cero porque todavía no hay moléculas en la fase de vapor. Sin embargo, algunas moléculas en la superficie tendrán suficiente energía cinética para escapar del líquido y formar un vapor, aumentando así la presión dentro del recipiente. Mientras la temperatura del líquido se mantenga constante, la fracción de moléculas con (KE> E_0 ) no cambiará, y la velocidad a la que las moléculas escapan del líquido a la fase de vapor dependerá solo del área superficial de La fase líquida.
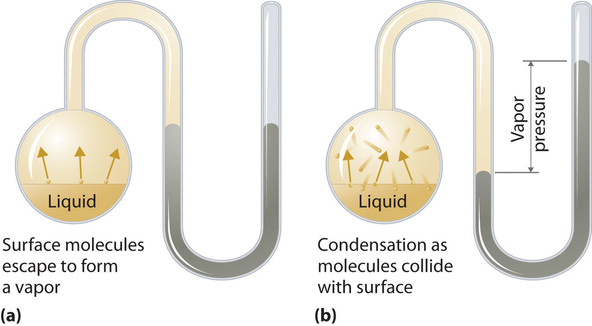
Tan pronto como se haya formado algo de vapor, una fracción de las moléculas en la fase de vapor colisionará con la superficie del líquido y volverá a entrar en la fase líquida en un proceso conocido como condensación (parte (b) en la Figura ( PageIndex {2} )). A medida que aumenta el número de moléculas en la fase de vapor, también aumentará el número de colisiones entre las moléculas de fase de vapor y la superficie. Eventualmente, se alcanzará un estado estable en el que exactamente tantas moléculas por unidad de tiempo salen de la superficie del líquido (se vaporizan) como chocan con él (se condensan). En este punto, la presión sobre el líquido deja de aumentar y permanece constante a un valor particular que es característico del líquido a una temperatura dada. Las tasas de evaporación y condensación a lo largo del tiempo para un sistema como este se muestran gráficamente en la Figura ( PageIndex {3} ).

Presión de vapor de equilibrio
Dos procesos opuestos (como la evaporación y la condensación) que ocurren a la misma velocidad y, por lo tanto, no producen cambios netos en un sistema, constituyen un equilibrio dinámico . En el caso de un líquido encerrado en una cámara, las moléculas se evaporan y condensan continuamente, pero las cantidades de líquido y vapor no cambian con el tiempo. La presión ejercida por un vapor en equilibrio dinámico con un líquido es la presión de vapor de equilibrio del líquido.
Si un líquido está en un contenedor abierto , sin embargo, la mayoría de las moléculas que escapan a la fase de vapor no chocarán con la superficie del líquido y regresarán al líquido fase. En cambio, se difundirán a través de la fase gaseosa lejos del contenedor, y nunca se establecerá un equilibrio. En estas condiciones, el líquido continuará evaporándose hasta que haya “desaparecido”. La velocidad con la que esto ocurre depende de la presión de vapor del líquido y la temperatura. Los líquidos volátiles tienen presiones de vapor relativamente altas y tienden a evaporarse fácilmente; los líquidos no volátiles tienen bajas presiones de vapor y se evaporan más lentamente. Aunque la línea divisoria entre líquidos volátiles y no volátiles no está bien definida, como guía general, podemos decir que las sustancias con presiones de vapor mayores que la del agua (Figura ( PageIndex {4} )) son relativamente volátiles, mientras que aquellos con presiones de vapor menores que la del agua son relativamente no volátiles. Por lo tanto, el éter dietílico (éter etílico), la acetona y la gasolina son volátiles, pero el mercurio, el etilenglicol y el aceite de motor no son volátiles.
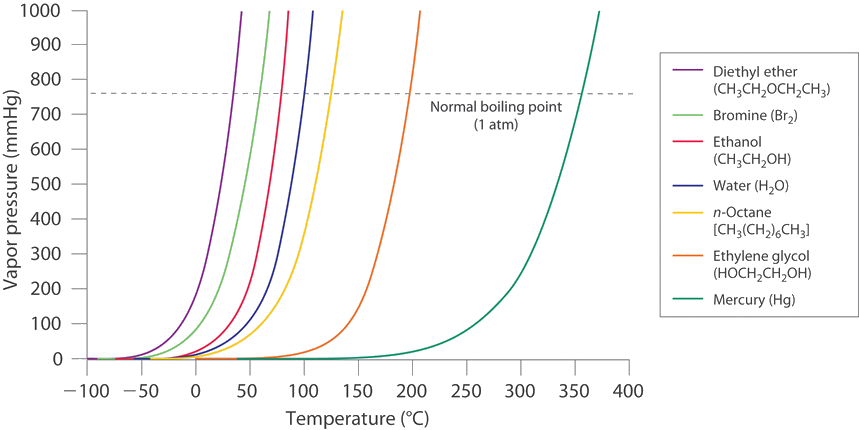
La presión de vapor de equilibrio de una sustancia a una temperatura particular es una característica del material, como su masa molecular, punto de fusión y punto de ebullición (Tabla 11.4). Depende no de la cantidad de líquido siempre que al menos una pequeña cantidad de líquido esté presente en equilibrio con el vapor. Sin embargo, la presión de vapor de equilibrio depende en gran medida de la temperatura y las fuerzas intermoleculares presentes, como se muestra para varias sustancias en la Figura ( PageIndex {4} ). Las moléculas que pueden formar enlaces de hidrógeno, como el etilenglicol, tienen una presión de vapor de equilibrio mucho más baja que las que no pueden, como el octano. El aumento no lineal de la presión de vapor con el aumento de temperatura es mucho más pronunciado que el aumento de presión esperado para un gas ideal en el rango de temperatura correspondiente. La dependencia de la temperatura es muy fuerte porque la presión de vapor depende de la fracción de moléculas que tienen una energía cinética mayor que la necesaria para escapar del líquido, y esta fracción aumenta exponencialmente con la temperatura. Como resultado, los contenedores sellados de líquidos volátiles son bombas potenciales si se someten a grandes aumentos de temperatura. Los tanques de gasolina en los automóviles tienen ventilación, por ejemplo, para que un automóvil no explote cuando está estacionado al sol. Del mismo modo, la ley exige que las latas pequeñas (1–5 galones) utilizadas para transportar gasolina tengan una liberación de presión.
Las sustancias volátiles tienen puntos de ebullición bajos e interacciones intermoleculares relativamente débiles; Las sustancias no volátiles tienen altos puntos de ebullición e interacciones intermoleculares relativamente fuertes.
El aumento exponencial de la presión de vapor con el aumento de la temperatura en la Figura ( PageIndex {4} ) nos permite usar logaritmos naturales para expresar la relación no lineal como lineal.
[ boxed { ln P = dfrac {- Delta H_ {vap}} {R} left ( dfrac {1} {T} right) + C} label {Eq1} ]
donde
- ( ln P ) es el logaritmo natural de la presión de vapor,
- (ΔH_ {vap} ) es la entalpía de vaporización ,
- (R ) es la constante de gas universal [8.314 J / (mol • K)],
- (T ) es la temperatura en grados Kelvin, y
- (C ) es la intersección en y, que es una constante para cualquier línea dada.
El trazado ( ln P ) versus el inverso de la temperatura absoluta ( (1 / T )) es una línea recta con una pendiente de −Δ H vap [19459024 ] / R . La ecuación ( ref {Eq1} ), llamada Ecuación de Clausius-Clapeyron , puede usarse para calcular el (ΔH_ {vap} ) de un líquido a partir de su medida presión de vapor a dos o más temperaturas. La forma más sencilla de determinar (ΔH_ {vap} ) es medir la presión de vapor de un líquido a dos temperaturas e insertar los valores de (P ) y (T ) para estos puntos en la ecuación ( ref {Eq2} ), que se deriva de la ecuación de Clausius-Clapeyron:
[ ln left ( dfrac {P_ {1}} {P_ {2}} right) = dfrac {- Delta H_ {vap}} {R} left ( dfrac {1} {T_ {1}} – dfrac {1} {T_ {2}} right) label {Eq2} ]
Por el contrario, si conocemos Δ H vap y la presión de vapor (P_1 ) a cualquier temperatura (T_1 ), podemos usar la ecuación ( ref { Eq2} ) para calcular la presión de vapor (P_2 ) a cualquier otra temperatura (T_2 ), como se muestra en el Ejemplo ( PageIndex {1} ).
Puntos de ebullición
A medida que aumenta la temperatura de un líquido, la presión de vapor del líquido aumenta hasta que es igual a la presión externa, o la presión atmosférica en el caso de un recipiente abierto. Las burbujas de vapor comienzan a formarse en todo el líquido, y el líquido comienza a hervir. La temperatura a la cual un líquido hierve a una presión de exactamente 1 atm es el punto de ebullición normal del líquido. Para el agua, el punto de ebullición normal es exactamente 100 ° C. Los puntos de ebullición normales de los otros líquidos en la Figura ( PageIndex {4} ) están representados por los puntos en los que las curvas de presión de vapor cruzan la línea correspondiente a una presión de 1 atm. Aunque generalmente citamos el punto de ebullición normal de un líquido, el punto de ebullición real depende de la presión. A una presión superior a 1 atm, el agua hierve a una temperatura superior a 100 ° C porque el aumento de la presión obliga a las moléculas de vapor sobre la superficie a condensarse. Por lo tanto, las moléculas deben tener una mayor energía cinética para escapar de la superficie. Por el contrario, a presiones inferiores a 1 atm, el agua hierve por debajo de 100 ° C.
| Lugar | Altitud sobre el nivel del mar (pies) | Presión atmosférica (mmHg) | Punto de ebullición del agua (° C) |
|---|---|---|---|
| El monte. Everest, Nepal / Tibet | 29,028 | 240 | 70 |
| Bogotá, Colombia | 11,490 | 495 | 88 |
| Denver, Colorado | 5280 | 633 | 95 |
| Washington, DC | 25 | 759 | 100 |
| Mar Muerto, Israel / Jordania | −1312 | 799 | 101,4 |
Las variaciones típicas en la presión atmosférica al nivel del mar son relativamente pequeñas, causando solo cambios menores en el punto de ebullición del agua. Por ejemplo, la presión atmosférica más alta registrada a nivel del mar es de 813 mmHg, registrada durante un invierno siberiano; La presión de nivel del mar más baja jamás medida fue de 658 mmHg en un tifón del Pacífico. A estas presiones, el punto de ebullición del agua cambia mínimamente, a 102 ° C y 96 ° C, respectivamente. A grandes altitudes, por otro lado, la dependencia del punto de ebullición del agua de la presión se vuelve significativa. La Tabla ( PageIndex {1} ) enumera los puntos de ebullición del agua en varios lugares con diferentes altitudes. A una altura de solo 5000 pies, por ejemplo, el punto de ebullición del agua ya es más bajo que el más bajo jamás registrado a nivel del mar. El punto de ebullición más bajo del agua tiene consecuencias importantes para cocinar todo, desde huevos pasados por agua (un “huevo de tres minutos” puede tardar cuatro o más minutos en las Montañas Rocosas e incluso más en el Himalaya) hasta los pasteles (a menudo se venden mezclas para pasteles). con instrucciones separadas de gran altitud). Por el contrario, las ollas a presión, que tienen un sello que permite que la presión dentro de ellas supere 1 atm, se usan para cocinar los alimentos más rápidamente elevando el punto de ebullición del agua y, por lo tanto, la temperatura a la que se cocinan los alimentos.
A medida que aumenta la presión, aumenta el punto de ebullición de un líquido y viceversa.
Resumen
Debido a que las moléculas de un líquido están en constante movimiento y poseen una amplia gama de energías cinéticas, en cualquier momento alguna fracción de ellas tiene suficiente energía para escapar de la superficie del líquido para entrar en la fase gaseosa o de vapor. Este proceso, llamado vaporización o evaporación , genera una presión de vapor por encima del líquido. Las moléculas en la fase gaseosa pueden chocar con la superficie del líquido y volver a entrar en el líquido a través de la condensación . Finalmente, se alcanza un estado estable en el que el número de moléculas que se evaporan y se condensan por unidad de tiempo es el mismo, y el sistema está en un estado de equilibrio dinámico . En estas condiciones, un líquido exhibe una presión de vapor de equilibrio característica que depende solo de la temperatura. Podemos expresar la relación no lineal entre la presión de vapor y la temperatura como una relación lineal usando la ecuación Clausius-Clapeyron . Esta ecuación puede usarse para calcular la entalpía de vaporización de un líquido a partir de su presión de vapor medida a dos o más temperaturas. Los líquidos volátiles son líquidos con altas presiones de vapor, que tienden a evaporarse fácilmente de un recipiente abierto; los líquidos no volátiles tienen bajas presiones de vapor. Cuando la presión de vapor es igual a la presión externa, se forman burbujas de vapor dentro del líquido y hierve. La temperatura a la cual una sustancia hierve a una presión de 1 atm es su punto de ebullición normal .
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )