En el último capítulo , discutimos los principios de la cinética química, que se ocupan de la tasa de cambio , o qué tan rápido ocurre una reacción química dada. Ahora dirigimos nuestra atención a la medida en la que ocurre una reacción y cómo las condiciones de reacción afectan las concentraciones finales de reactivos y productos. Para la mayoría de las reacciones que hemos discutido hasta ahora, es posible que haya asumido que una vez que los reactivos se convierten en productos, es probable que sigan así. De hecho, sin embargo, prácticamente todas las reacciones químicas son reversibles hasta cierto punto. Es decir, se produce una reacción opuesta en la que los productos reaccionan, en mayor o menor grado, para volver a formar los reactivos. Finalmente, las velocidades de reacción directa e inversa se vuelven iguales, y el sistema alcanza el equilibrio químico , el punto en el que la composición del sistema ya no cambia con el tiempo.

El equilibrio químico es un proceso dinámico que consiste en una reacción directa, en la que los reactivos se convierten en productos, y una reacción inversa, en la que los productos se convierten en reactivos. En el equilibrio, las reacciones directas e inversas proceden a velocidades iguales. Considere, por ejemplo, un sistema simple que contiene solo un reactivo y un producto, la disociación reversible de tetróxido de dinitrógeno ( ( ce {N_2O_4} )) a dióxido de nitrógeno ( ( ce {NO_2} )). Puede recordar que ( ce {NO_2} ) es responsable del color marrón que asociamos con el smog. Cuando un tubo sellado que contiene sólido ( ce {N_2O_4} ) (mp = −9.3 ° C; pb = 21.2 ° C) se calienta de −78.4 ° C a 25 ° C, el color rojo-marrón de ( Aparece ce {NO_2} ) (Figura ( PageIndex {1} )). La reacción puede seguirse visualmente porque el producto ( ( ce {NO_2} )) está coloreado, mientras que el reactivo ( ( ce {N_2O_4} )) es incoloro:
[ underset {incoloro} { ce {N2O4 (g)}} ce {<=> [k_f] [k_r]} underset {rojo-marrón} { ce {2NO2 (g)}} label {Eq1} ]
La flecha doble indica que tanto la reacción hacia adelante
[ ce {N2O4 (g) -> [k_f] 2NO2 (g)} label {eq1B} ]
y reacción inversa
[ ce {2NO2 (g) -> [k_r] N2O4 (g)} label {eq1C} ]
ocurriendo simultáneamente (es decir, la reacción es reversible). Sin embargo, esto no significa necesariamente que el sistema esté en equilibrio como lo demuestra el siguiente capítulo.
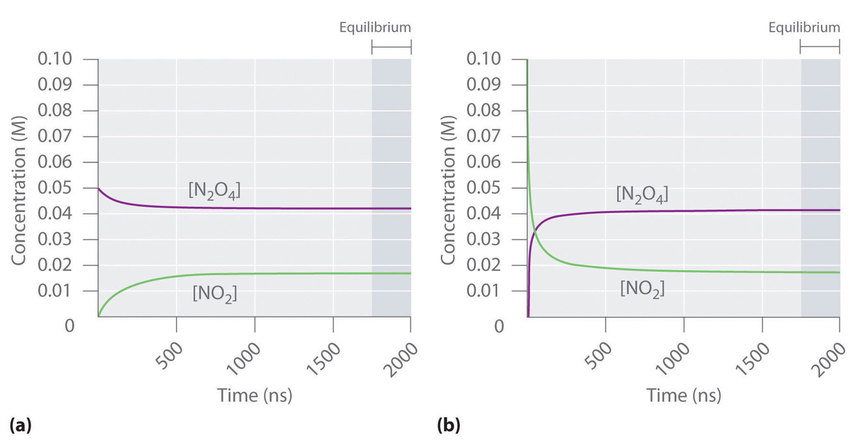
La Figura ( PageIndex {2} ) muestra cómo la composición de este sistema variaría en función del tiempo a una temperatura constante. Si la concentración inicial de ( ce {NO_2} ) fuera cero, entonces aumenta a medida que disminuye la concentración de ( ce {N_2O_4} ). Finalmente, la composición del sistema deja de cambiar con el tiempo y se logra el equilibrio químico. Por el contrario, si comenzamos con una muestra que no contiene ( ce {N_2O_4} ) pero una concentración inicial de ( ce {NO_2} ) dos veces la concentración inicial de ( ce {N_2O_4} ) (Figura ( PageIndex {2a} )), de acuerdo con la estequiometría de la reacción, alcanzamos exactamente la misma composición de equilibrio (Figura ( PageIndex {2b} )). Por lo tanto, se puede alcanzar el equilibrio desde cualquier dirección en una reacción química.
La figura ( PageIndex {3} ) muestra las velocidades de reacción directa e inversa para una muestra que inicialmente contiene ( ce {NO_2} ) puro. Debido a que la concentración inicial de ( ce {N_2O_4} ) es cero, la velocidad de reacción directa (disociación de ( ce {N_2O_4} )) también es inicialmente cero. En contraste, la velocidad de reacción inversa (dimerización de ( ce {NO_2} )) es inicialmente muy alta ( (2.0 times 10 ^ 6 , M / s )), pero disminuye rápidamente a medida que la concentración de ( ce {NO_2} ) disminuye. A medida que aumenta la concentración de ( ce {N_2O_4} ), aumenta la tasa de disociación de ( ce {N_2O_4} ), pero más lentamente que la dimerización de ( ce {NO_2} ), porque la reacción es solo de primer orden en ( ce {N_2O_4} ) (velocidad = (k_f [N_2O_4] ), donde (k_f ) es la velocidad constante para la reacción directa en las ecuaciones ( ref {Eq1} ) y ( ref {eq1B} )). Finalmente, las velocidades de reacción directa e inversa se vuelven idénticas, (k_f = k_r ), y el sistema ha alcanzado el equilibrio químico. Si las reacciones directas e inversas ocurren a velocidades diferentes, entonces el sistema no está en equilibrio.
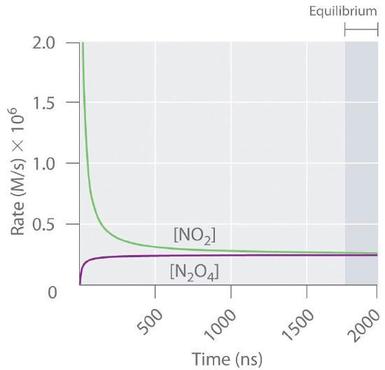
La velocidad de dimerización de ( ce {NO_2} ) (reacción inversa) disminuye rápidamente con el tiempo, como se esperaba para una reacción de segundo orden. Como la concentración inicial de ( ce {N_2O_4} ) es cero, la velocidad de la reacción de disociación (reacción directa) en (t = 0 ) también es cero. A medida que avanza la reacción de dimerización, la concentración de ( ce {N_2O_4} ) aumenta, y su tasa de disociación también aumenta. Finalmente, las tasas de las dos reacciones son iguales: se ha alcanzado el equilibrio químico y las concentraciones de ( ce {N_2O_4} ) y ( ce {NO_2} ) ya no cambian.
En equilibrio, la velocidad de reacción directa es igual a la velocidad de reacción inversa.
Resumen
En el equilibrio, las reacciones directas e inversas de un sistema proceden a velocidades iguales. El equilibrio químico es un proceso dinámico que consiste en reacciones directas e inversas que se producen a velocidades iguales. En el equilibrio, la composición del sistema ya no cambia con el tiempo. La composición de una mezcla de equilibrio es independiente de la dirección desde la que se aborda el equilibrio.