La composición de mezclas relativamente complejas de iones metálicos puede determinarse utilizando análisis cualitativo , un procedimiento para descubrir la identidad de los iones metálicos presentes en la mezcla (en lugar de información cuantitativa sobre sus cantidades). El procedimiento utilizado para separar e identificar más de 20 cationes metálicos comunes de una sola solución consiste en precipitar selectivamente solo unos pocos tipos de iones metálicos a la vez en determinadas condiciones. Los pasos de precipitación consecutivos se vuelven progresivamente menos selectivos hasta que se precipitan casi todos los iones metálicos, como se ilustra en Figura ( PageIndex {1} ).
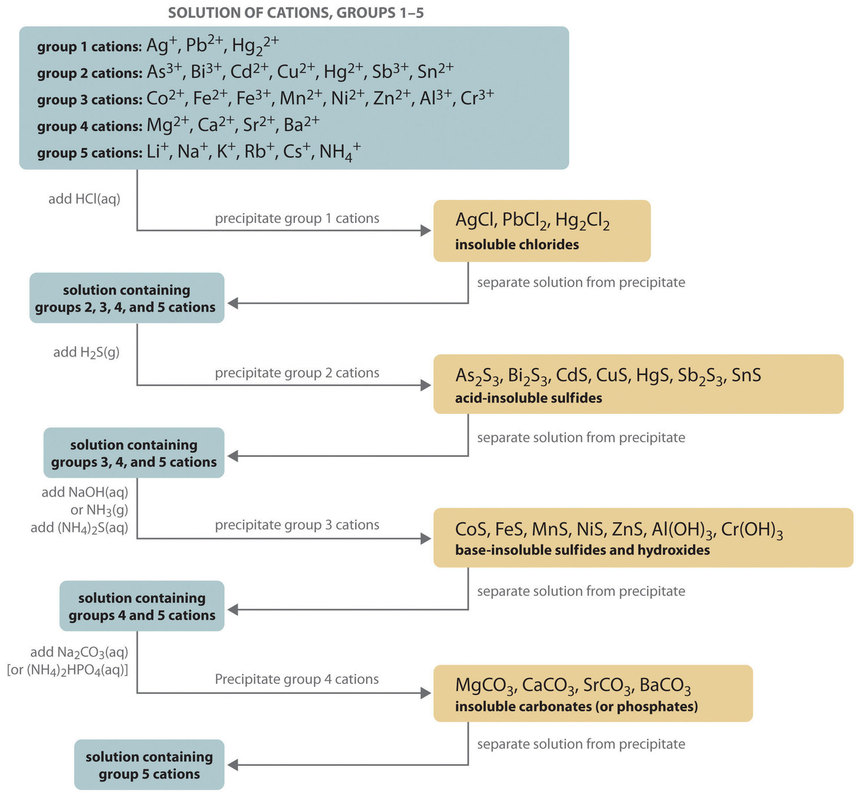
Grupo 1: Cloruros insolubles
La mayoría de las sales de cloruro de metal son solubles en agua; solo Ag + , Pb 2 + , y Hg 2 2 + forma cloruros que precipitan del agua. Por lo tanto, el primer paso en un análisis cualitativo es agregar aproximadamente 6 M de HCl, lo que hace que AgCl, PbCl 2 y / o Hg 2 Cl 2 precipiten . Si no se forma precipitado, estos cationes no están presentes en cantidades significativas. El precipitado se puede recoger por filtración o centrifugación.
Grupo 2: Sulfuros insolubles en ácido
A continuación, la solución ácida está saturada con H 2 S gas. Solo aquellos iones metálicos que forman sulfuros muy insolubles, como As 3 + , Bi 3 + , Cd 2 [ 19459025] + , Cu 2 + , Hg 2 + , Sb 3 + , y Sn 2 + , precipitan como sus sales de sulfuro en estas condiciones ácidas. Todos los demás, como Fe 2 + y Zn 2 + , permanecen en solución. Una vez más, los precipitados se recogen por filtración o centrifugación.
Grupo 3: Sulfuros insolubles en base (e hidróxidos)
Ahora se agrega amoníaco o NaOH a la solución hasta que sea básico, y luego (NH 4 ) 2 S se agrega. Este tratamiento elimina los cationes restantes que forman hidróxidos o sulfuros insolubles. Los iones metálicos divalentes Co 2 + , Fe 2 + , Mn 2 + [19459025 ], Ni 2 + , y Zn 2 + precipitan como sus sulfuros, y los iones metálicos trivalentes Al 3 [ 19459025] + y Cr 3 + precipitan como sus hidróxidos: Al (OH) 3 y Cr (OH) 3 . Si la mezcla contiene Fe 3 + , el sulfuro reduce el catión a Fe 2 + , que precipita como FeS.
Grupo 4: carbonatos o fosfatos insolubles
Los siguientes iones metálicos que se eliminarán de la solución son aquellos que forman carbonatos y fosfatos insolubles. Cuando se agrega Na 2 CO 3 a la solución básica que queda después de que se eliminan los iones metálicos precipitados, los carbonatos insolubles precipitan y se recogen. Alternativamente, agregar (NH 4 ) 2 HPO 4 hace que los mismos iones metálicos precipiten como fosfatos insolubles.
Grupo 5: Metales alcalinos
En este punto, hemos eliminado todos los iones metálicos que forman cloruros, sulfuros, carbonatos o fosfatos insolubles en agua. Los únicos iones comunes que pueden quedar son los metales alcalinos (Li + , Na + , K + , Rb + y Cs + ) y amonio (NH 4 + ). Ahora tomamos una segunda muestra de la solución original y agregamos una pequeña cantidad de NaOH para neutralizar el ion amonio y producir NH 3 . (No podemos usar la misma muestra que usamos para los primeros cuatro grupos porque agregamos amonio a esa muestra en los pasos anteriores). Cualquier amoníaco producido puede detectarse por su olor o por una prueba de papel tornasol. Se utiliza una prueba de llama en otra muestra original para detectar sodio, que produce un color amarillo brillante característico. Los otros iones de metales alcalinos también dan colores característicos en las pruebas de llama, lo que les permite ser identificados si solo hay uno presente.
Los iones metálicos que precipitan juntos se separan mediante varias técnicas adicionales, como la formación de iones complejos, el cambio del pH de la solución o el aumento de la temperatura para redisolver algunos de los sólidos. Por ejemplo, los cloruros metálicos precipitados de los cationes del grupo 1, que contienen Ag + , Pb 2 + y Hg 2 2 + , son bastante insolubles en agua. Debido a que PbCl 2 es mucho más soluble en agua caliente que las otras dos sales de cloruro, sin embargo, agregar agua al precipitado y calentar la suspensión resultante disolverá cualquier PbCl 2 presente. Aislar la solución y agregar una pequeña cantidad de solución de Na 2 CrO 4 producirá un precipitado amarillo brillante de PbCrO 4 si Pb 2 [ 19459025] + estaban en la muestra original ( Figura ( PageIndex {2} )).
Como otro ejemplo, el tratamiento de los precipitados de los cationes del grupo 1 con amoniaco acuoso disolverá cualquier AgCl porque Ag + forma un complejo estable con amoníaco: [Ag (NH 3 ) [ 19459026] 2 ] + . Además, ( ce {Hg2Cl2} ) se desproporciona en amoníaco
[ ce {2Hg2 ^ {2+} rightarrow Hg + Hg ^ {2 +}} ]
para formar un sólido negro que es una mezcla de mercurio metálico finamente dividido y un compuesto insoluble de mercurio (II), que se separa de la solución:
[ ce {Hg2Cl2 (s) + 2NH3 (aq) rightarrow Hg (l) + Hg (NH_2) Cl (s) + NH ^ {+} 4 (aq) + Cl ^ {-} (aq )} label {17.7.1} ]
Cualquier ion de plata en la solución se detecta luego agregando HCl, que revierte la reacción y da un precipitado de AgCl blanco que se oscurece lentamente cuando se expone a la luz:
[ ce {[Ag (NH3) 2] ^ {+} (aq) + 2H ^ {+} (aq) + Cl ^ {-} (aq) Agighrowrow AgCl (s) + 2NH ^ { +} 4 (aq)} label {17.7.2} ]
También se usan reacciones similares pero ligeramente más complejas para separar e identificar los componentes individuales de los otros grupos.
Resumen
En el análisis cualitativo, se determina la identidad, no la cantidad, de iones metálicos presentes en una mezcla. La técnica consiste en precipitar selectivamente solo unos pocos tipos de iones metálicos a la vez en determinadas condiciones. Los pasos de precipitación consecutivos se vuelven progresivamente menos selectivos hasta que se precipitan casi todos los iones metálicos. Se necesitan otros pasos adicionales para separar los iones metálicos que precipitan juntos.