La naturaleza física precisa de los átomos finalmente surgió de una serie de elegantes experimentos llevados a cabo entre 1895 y 1915. El más notable de estos logros fue el famoso experimento de dispersión de rayos alfa de 1911 de Ernest Rutherford, que estableció que
- Casi toda la masa de un átomo está contenida dentro de un núcleo pequeño (y por lo tanto extremadamente denso) que lleva una carga eléctrica positiva cuyo valor identifica cada elemento y se conoce como el número atómico del elemento.
- Casi todo el volumen de un átomo consiste en un espacio vacío en el que residen los electrones, los portadores fundamentales de la carga eléctrica negativa. La masa extremadamente pequeña del electrón (1/1840 la masa del núcleo de hidrógeno) hace que se comporte como una partícula cuántica, lo que significa que su ubicación en cualquier momento no puede especificarse; Lo mejor que podemos hacer es describir su comportamiento en términos de la probabilidad de que se manifieste en cualquier punto del espacio. Es común (pero algo engañoso) describir el volumen de espacio en el que los electrones de un átomo tienen una probabilidad significativa de ser encontrados como la nube de electrones . Este último no tiene un límite externo definido, por lo que tampoco tiene el átomo. El radio de un átomo debe definirse arbitrariamente, como el límite en el que se puede encontrar el electrón con un 95% de probabilidad. Los radios atómicos son típicamente 30-300 pm.
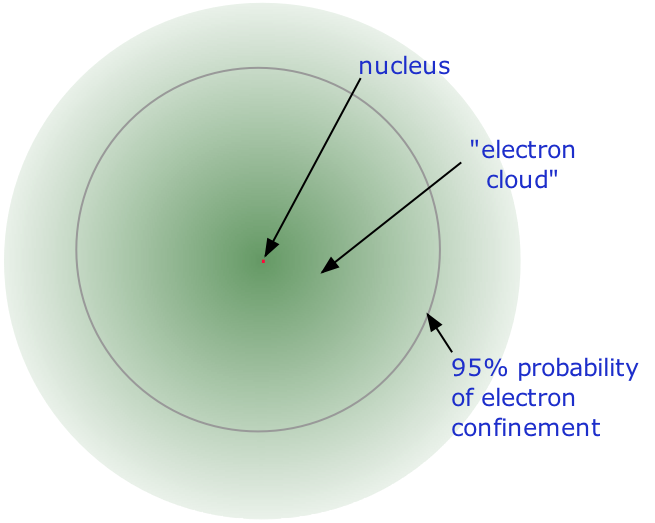
El núcleo está compuesto por dos tipos de partículas. Los protones son los portadores de carga eléctrica positiva en el núcleo; la carga de protones es exactamente la misma que la carga de electrones, pero de signo opuesto. Esto significa que en cualquier átomo [eléctricamente neutro], el número de protones en el núcleo (a menudo denominado carga nuclear ) está equilibrado por el mismo número de electrones fuera del núcleo . La otra partícula nuclear es el neutrón . Como su nombre lo indica, esta partícula no tiene carga eléctrica. Su masa es casi la misma que la del protón. La mayoría de los núcleos contienen números aproximadamente iguales de neutrones y protones, por lo que podemos decir que estas dos partículas juntas representan casi toda la masa del átomo.
Debido a que los electrones de un átomo están en contacto con el mundo exterior, es posible que se pierdan uno o más electrones o que se agreguen algunos nuevos. El átomo resultante cargado eléctricamente se llama ion.
Elementos
Hasta la fecha, se han descubierto unos 115 elementos diferentes; Por definición, cada uno es químicamente único. Para comprender por qué son únicos, debe comprender la estructura del átomo (la partícula individual fundamental de un elemento) y las características de sus componentes. Los átomos consisten en electrones, protones y neutrones. Aunque esta es una simplificación excesiva que ignora las otras partículas subatómicas que se han descubierto, es suficiente para discutir los principios químicos. Algunas propiedades de estas partículas subatómicas se resumen en la Tabla ( PageIndex {1} ), que ilustra tres puntos importantes:
- Los electrones y los protones tienen cargas eléctricas que son idénticas en magnitud pero opuestas en signo. Las cargas relativas de −1 y +1 se asignan al electrón y al protón, respectivamente.
- Los neutrones tienen aproximadamente la misma masa que los protones pero no tienen carga. Son eléctricamente neutros.
- La masa de un protón o un neutrón es aproximadamente 1836 veces mayor que la masa de un electrón. Los protones y los neutrones constituyen la mayor parte de la masa de los átomos.
El descubrimiento del electrón y el protón fue crucial para el desarrollo del modelo moderno del átomo y proporciona un excelente estudio de caso en la aplicación del método científico. De hecho, el esclarecimiento de la estructura del átomo es una de las mejores historias de detectives en la historia de la ciencia.
| Partícula | Masa (g) | Masa atómica (amu) | Carga eléctrica (culombios) | Carga relativa |
|---|---|---|---|---|
| electrón | (9.109 veces 10 ^ {- 28} ) | 0,0005486 | −1.602 × 10 −19 | −1 |
| protón | (1.673 veces 10 ^ {- 24} ) | 1.007276 | +1.602 × 10 −19 | +1 |
| neutrón | (1.675 veces 10 ^ {- 24} ) | 1.008665 | 0 | 0 |
En la mayoría de los casos, los símbolos de los elementos se derivan directamente del nombre de cada elemento, como C para carbono, U para uranio, Ca para calcio y Po para polonio. Los elementos también han sido nombrados por sus propiedades [como el radio (Ra) por su radioactividad], por el país natal de los científicos que los descubrieron [polonio (Po) para Polonia], por eminentes científicos [curio (Cm) para los Curies], para dioses y diosas [selenio (Se) para la diosa griega de la luna, Selene], y por otras razones poéticas o históricas. Algunos de los símbolos utilizados para elementos que se conocen desde la antigüedad se derivan de nombres históricos que ya no se usan; solo quedan los símbolos para indicar su origen. Ejemplos son Fe para hierro, del latín ferrum ; Na para sodio, del latín natrio ; y W para tungsteno, del alemán wolfram . Los ejemplos están en Tabla ( PageIndex {2} ).
| Elemento | Símbolo | Derivación | Significado |
|---|---|---|---|
| antimonio | Sb | estibio | Latín para “marca” |
| cobre | Cu | cuprum | de Cyprium, nombre en latín para la isla de Chipre, la principal fuente de mineral de cobre en el Imperio Romano |
| oro | Au | aurum | Latín para “oro” |
| hierro | Fe | ferrum | Latín para “hierro” |
| plomo | Pb | plumbum | Latín para “pesado” |
| mercurio | Hg | hidrargiro | Latín para “plata líquida” |
| potasio | K | kalium | del árabe al-qili, “álcali” |
| plata | Ag | argentum | Latín para “plata” |
| sodio | Na | natrio | Latín para “sodio” |
| estaño | Sn | stannum | Latín para “estaño” |
| tungsteno | W | wolfram | Alemán para “piedra de lobo” porque interfiere con la fundición del estaño y se pensaba que devoraba el estaño |
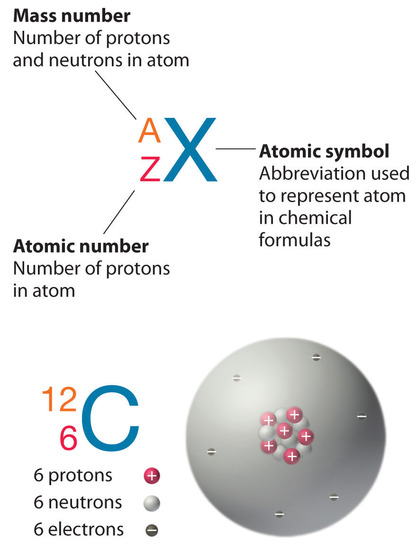
Recuerde que los núcleos de la mayoría de los átomos contienen neutrones y protones. A diferencia de los protones, el número de neutrones no es absolutamente fijo para la mayoría de los elementos. Los átomos que tienen el mismo número de protones y, por lo tanto, el mismo número atómico, pero diferentes números de neutrones se llaman isótopos. Todos los isótopos de un elemento tienen el mismo número de protones y electrones, lo que significa que exhiben la misma química. Los isótopos de un elemento difieren solo en su masa atómica, que está dada por el número de masa (A), la suma de los números de protones y neutrones.
El elemento carbono (C) tiene un número atómico de 6, lo que significa que todos los átomos de carbono neutros contienen 6 protones y 6 electrones. En una muestra típica de material que contiene carbono, el 98.89% de los átomos de carbono también contienen 6 neutrones, por lo que cada uno tiene un número de masa de 12. Un isótopo de cualquier elemento puede representarse únicamente como (^ A_Z X ), donde X Es el símbolo atómico del elemento. El isótopo de carbono que tiene 6 neutrones es, por lo tanto, (_ 6 ^ {12} C ). El subíndice que indica el número atómico es en realidad redundante porque el símbolo atómico ya especifica Z únicamente. En consecuencia, (_ 6 ^ {12} C ) se escribe más a menudo como 12 C, que se lee como “carbono -12 “. Sin embargo, el valor de Z se incluye comúnmente en la notación de las reacciones nucleares porque estas reacciones implican cambios en Z.
Además de (^ {12} C ), una muestra típica de carbono contiene 1.11% (_ 6 ^ {13} C ) ( 13 C), con 7 neutrones y 6 protones, y un rastro de (_ 6 ^ {14} C ) ( 14 C), con 8 neutrones y 6 protones. Sin embargo, el núcleo de 14 C no es estable, pero sufre una lenta desintegración radiactiva que es la base de la técnica de datación por carbono-14 utilizada en la arqueología. Muchos elementos distintos del carbono tienen más de un isótopo estable; El estaño, por ejemplo, tiene 10 isótopos. Las propiedades de algunos isótopos comunes se encuentran en Tabla ( PageIndex {3} ).
| Elemento | Símbolo | Masa atómica (amu) | Número de masa de isótopos | Masas de isótopos (amu) | Abundancias porcentuales (%) |
|---|---|---|---|---|---|
| hidrógeno | H | 1.0079 | 1 | 1.007825 | 99,9855 |
| 2 | 2.014102 | 0,0115 | |||
| boro | B | 10.81 | 10 | 10.012937 | 19,91 |
| 11 | 11.009305 | 80.09 | |||
| carbono | C | 12.011 | 12 | 12 (definido) | 99,89 |
| 13 | 13.003355 | 1.11 | |||
| oxígeno | O | 15.9994 | 16 | 15,994915 | 99,757 |
| 17 | 16.999132 | 0,0378 | |||
| 18 | 17.999161 | 0,205 | |||
| hierro | Fe | 55.845 | 54 | 53,939611 | 5,82 |
| 56 | 55,934938 | 91,66 | |||
| 57 | 56.935394 | 2,19 | |||
| 58 | 57,933276 | 0,33 | |||
| uranio | U | 238,03 | 234 | 234.040952 | 0,0054 |
| 235 | 235.043930 | 0.7204 | |||
| 238 | 238.050788 | 99,274 |
Fuentes de datos de isótopos: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; J. C. Kotz y K. F. Purcell, Química y reactividad química, 2ª ed., 1991.
Resumen
El átomo consiste en partículas discretas que gobiernan su comportamiento químico y físico. Cada átomo de un elemento contiene el mismo número de protones, que es el número atómico ( Z ). Los átomos neutros tienen el mismo número de electrones y protones. Los átomos de un elemento que contienen diferentes números de neutrones se denominan isótopos . Cada isótopo de un elemento dado tiene el mismo número atómico pero un número de masa ( A ) diferente, que es la suma de los números de protones y neutrones. Las masas relativas de átomos se informan utilizando la unidad de masa atómica ( amu ), que se define como una doceava parte de la masa de un átomo de carbono-12, con 6 protones, 6 neutrones y 6 electrones.