Los ligandos pueden caracterizarse además como monodentados, bidentados, tridentados, etc., donde se introduce el concepto de dientes (abolladura) . Los ligandos monodentados se unen a través de un solo átomo donante. Monodentado significa “un diente”. Los haluros, fosfinas, amoníaco y aminas vistos previamente son ligandos monodentados. Los ligandos bidentados se unen a través de dos sitios donantes. Bidentado significa “dos dientes”. Un ejemplo de un ligando bidentado es la etilendiamina. Se puede unir a un metal a través de dos átomos donantes a la vez.

La unión bidentada permite que un ligando se una más fuertemente. Los ligandos tridentados, que se unen a través de tres donantes, pueden unirse aún más fuertemente, y así sucesivamente. Este fenómeno generalmente se denomina “efecto quelato”. Este término proviene del griego chelos, que significa “cangrejo”. Un cangrejo no tiene dientes en absoluto, pero tiene dos garras para sujetar firmemente algo por un par de razones. Una analogía muy simple es que, si está sosteniendo algo con dos manos en lugar de una, no es probable que lo suelte.
Iones metálicos complejos que contienen ligandos más complicados
En los ejemplos descritos anteriormente, cada ligando solo forma un enlace con el ion metálico central para dar el ion complejo. Se dice que tal ligando es unidentado. ¡Eso significa literalmente que solo tiene un diente! Solo tiene un par de electrones que puede usar para unirse al metal; cualquier otro par solitario apunta en la dirección incorrecta. ¡Sin embargo, algunos ligandos tienen más dientes! Estos se conocen generalmente como ligandos multidentados o polidentados, pero se pueden dividir en varios tipos diferentes.
Ligandos bidentados
Los ligandos bidentados tienen dos pares solitarios, los cuales pueden unirse al ion metálico central. Los dos ejemplos comúnmente utilizados son 1,2-diaminoetano (antiguo nombre: etilendiamina, a menudo dada la abreviatura “en”), y el ion etanodioato (antiguo nombre: oxalato).
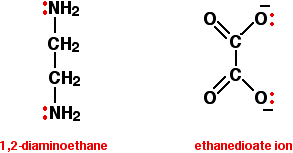
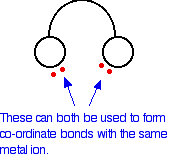
En el ion etanodioato, hay muchos más pares solitarios que los dos mostrados, pero estos son los únicos en los que estamos interesados. Puede pensar en estos ligandos bidentados como si fueran un par de auriculares, que llevaran pares solitarios en cada uno de los “auriculares”. Estos se ajustarán cómodamente alrededor de un ion metálico.
Un ligando quadridentado
Un ligando quadridentate tiene cuatro pares solitarios, todos los cuales pueden unirse al ion metálico central. Un ejemplo de esto ocurre en la hemoglobina (estadounidense: hemoglobina). La parte funcional de esto es un ion de hierro (II) rodeado por una molécula complicada llamada hemo. Esta es una especie de anillo hueco de átomos de carbono e hidrógeno, en el centro de los cuales hay 4 átomos de nitrógeno con pares solitarios en ellos. El hemo es uno de un grupo de compuestos similares llamados porfirinas. Todos tienen el mismo tipo de sistema de anillo, pero con diferentes grupos unidos al exterior del anillo. No necesitará saber la estructura exacta del haem en este nivel.
Podríamos simplificar el hemo con el ion de hierro atrapado como:
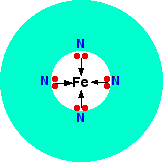
Cada uno de los pares solitarios en el nitrógeno puede formar un enlace coordinado con el ion hierro (II), manteniéndolo en el centro del complicado anillo de átomos. El hierro forma 4 enlaces coordinados con el hemo, pero aún tiene espacio para formar dos más, uno arriba y otro debajo del plano del anillo. La proteína globina se une a una de estas posiciones usando un par solitario en uno de los nitrógenos en uno de sus aminoácidos. Lo interesante es la otra posición.
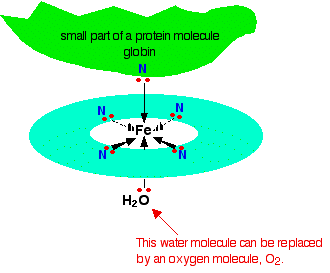
La molécula de agua que está unida a la posición inferior en el diagrama se reemplaza fácilmente por una molécula de oxígeno (de nuevo a través de un par solitario en uno de los oxígenos en (O_2 )), y así es como se transporta el oxígeno La sangre por la hemoglobina. Cuando el oxígeno llega a donde se necesita, se separa de la hemoglobina que regresa a los pulmones para obtener más.
Un ligando hexadentado
Un ligando hexadentado tiene 6 pares de electrones solitarios, todos los cuales pueden formar enlaces coordinados con el mismo ion metálico. El mejor ejemplo es EDTA . EDTA se usa como un ion negativo – EDTA4-. El diagrama muestra la estructura del ion con los átomos importantes y los pares solitarios seleccionados.
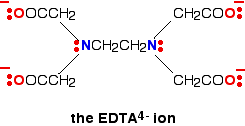
El ion EDTA envuelve completamente un ion metálico utilizando las 6 posiciones que hemos visto antes. El número de coordinación es nuevamente 6 debido a los 6 enlaces de coordenadas que están siendo formados por el ion metálico central. El siguiente diagrama muestra que esto sucede con un ion de cobre (II). Aquí hay una versión simplificada. Asegúrese de que puede ver cómo esto se relaciona con la estructura completa anterior.
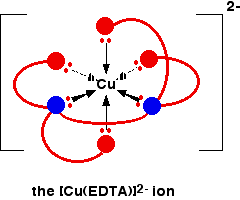
La carga general, por supuesto, proviene del 2+ en el ion de cobre original (II) y del 4 en el ion (EDTA ^ {4 -} ).