Para estudiar el flujo de energía durante una reacción química, necesitamos distinguir entre un sistema, la parte pequeña y bien definida del universo en la que estamos interesados (como una reacción química), y su entorno, el resto del universo, incluido el contenedor en el que se lleva a cabo la reacción (Figura ( PageIndex {1} )). En la discusión que sigue, la mezcla de sustancias químicas que experimenta una reacción es siempre el sistema, y el flujo de calor puede ser del sistema al entorno o viceversa.
Tres tipos de sistemas son importantes en química. Un sistema abierto puede intercambiar materia y energía con su entorno. Una olla de agua hirviendo es un sistema abierto porque un quemador suministra energía en forma de calor, y la materia en forma de vapor de agua se pierde a medida que el agua hierve. Un sistema cerrado puede intercambiar energía pero no importa con su entorno. La bolsa sellada de una cena preparada que se deja caer en una olla de agua hirviendo es un sistema cerrado porque la energía térmica se transfiere al sistema desde el agua hirviendo pero no se intercambia nada (a menos que la bolsa tenga fugas, en cuyo caso es ya no es un sistema cerrado). Un sistema aislado no intercambia energía ni materia con el entorno. La energía siempre se intercambia entre un sistema y sus alrededores, aunque este proceso puede tener lugar muy lentamente. Un sistema verdaderamente aislado no existe realmente. Un termo aislado que contiene café caliente se aproxima a un sistema aislado, pero finalmente el café se enfría a medida que el calor se transfiere a los alrededores. En todos los casos, la cantidad de calor perdido por un sistema es igual a la cantidad de calor ganado por su entorno y viceversa. Es decir, la energía total de un sistema más su entorno es constante , lo que debe ser cierto si se conserva energía .
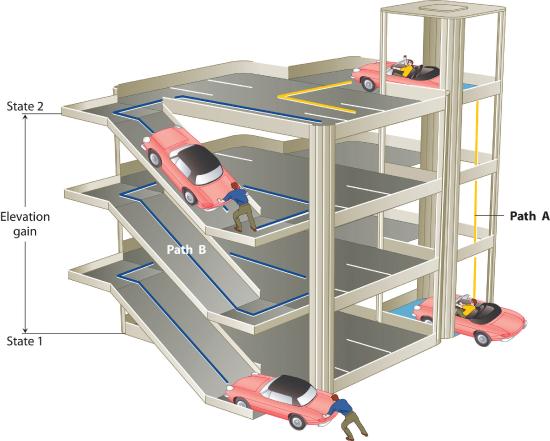
El estado de un sistema es una descripción completa de un sistema en un momento dado, que incluye su temperatura y presión, la cantidad de materia que contiene, su composición química y el estado físico de la materia . Una función de estado es una propiedad de un sistema cuya magnitud depende solo del estado actual del sistema, no de su historia previa. La temperatura, la presión, el volumen y la energía potencial son funciones de estado. La temperatura de un horno, por ejemplo, es independiente de la cantidad de pasos que haya tomado para alcanzar esa temperatura. De manera similar, la presión en un neumático es independiente de la frecuencia con la que se bombea aire al neumático para que alcance esa presión, al igual que el volumen final de aire en el neumático. El calor y el trabajo, por otro lado, no son funciones de estado porque dependen de la ruta . Por ejemplo, un automóvil que se encuentra en el nivel superior de un estacionamiento tiene la misma energía potencial, ya sea que fue levantado por una grúa, colocado allí por un helicóptero, conducido o empujado por un grupo de estudiantes (Figura ( PageIndex {2} )). Sin embargo, la cantidad de trabajo invertido para lograrlo puede diferir mucho según la ruta elegida. Si los estudiantes decidieran llevar el automóvil a la parte superior de la rampa, realizarían mucho más trabajo que si simplemente empujaran el automóvil por la rampa (a menos, por supuesto, que no hayan liberado el freno de estacionamiento, en cuyo caso ¡el trabajo gastado aumentaría sustancialmente!). Sin embargo, la energía potencial del automóvil es la misma, sin importar qué camino elijan.
Dirección del flujo de calor
La reacción del aluminio en polvo con óxido de hierro (III), conocida como reacción de termita, genera una enorme cantidad de calor, suficiente, de hecho, para fundir el acero (Figura ( PageIndex {3} )). La ecuación química equilibrada para la reacción es la siguiente:
[2Al (s) + Fe_2O_3 (s) rightarrow 2Fe (s) + Al_2O_3 (s) label {5.2.1} ]
También podemos escribir esta ecuación química como
[2Al (s) + Fe_2O_3 (s) rightarrow 2Fe (s) + Al_2O_3 (s) + text {heat} label {5.2.2} ]
para indicar que el calor es uno de los productos. Las ecuaciones químicas en las que el calor se muestra como reactivo o producto se denominan ecuaciones termoquímicas . En esta reacción, el sistema consiste en átomos de aluminio, hierro y oxígeno; todo lo demás, incluido el contenedor, conforma los alrededores. Durante la reacción, se produce tanto calor que el hierro se licua. Finalmente, el sistema se enfría; El hierro se solidifica a medida que el calor se transfiere a los alrededores. Un proceso en el cual el calor ( q ) se transfiere de un sistema a sus alrededores se describe como exotérmico . Por convención, (q <0 ) para una reacción exotérmica.
Cuando sostiene un cubito de hielo en la mano, el calor de los alrededores (incluida la mano) se transfiere al sistema (el hielo), lo que hace que el hielo se derrita y su mano se enfríe. Podemos describir este proceso mediante la siguiente ecuación termoquímica:
[calor + H_2O _ {(s)} rightarrow H_2O _ {(l)} label {5.2.3} ]
Cuando se transfiere calor a un sistema desde sus alrededores, el proceso es endotérmico . Por convención, (q> 0 ) para una reacción endotérmica.
La primera ley
La relación entre el cambio de energía de un sistema y el de su entorno está dada por la primera ley de la termodinámica , que establece que la energía del universo es constante. Podemos expresar esta ley matemáticamente de la siguiente manera:
[U_ {univ} = ΔU_ {sys} + ΔU_ {surr} = 0 label {5.2.4a} ]
[ Delta {U_ {sys}} = – ΔU_ {surr} label {5.2.4b} ]
donde los subíndices univ, sys y surr se refieren al universo, el sistema y los alrededores, respectivamente. Por lo tanto, el cambio en la energía de un sistema es idéntico en magnitud pero en signo opuesto al cambio en la energía de su entorno.
Un factor importante que determina el resultado de una reacción química es la tendencia de todos los sistemas, químicos o de otro tipo, a moverse hacia el estado de energía total más bajo posible. Cuando cae un ladrillo de un tejado, su energía potencial se convierte en energía cinética; cuando alcanza el nivel del suelo, ha alcanzado un estado de energía potencial más baja. Cualquiera que esté cerca notará que la energía se transfiere a los alrededores a medida que el ruido del impacto reverbera y el polvo se eleva cuando el ladrillo toca el suelo. Del mismo modo, si una chispa enciende una mezcla de isooctano y oxígeno en un motor de combustión interna, se forma espontáneamente dióxido de carbono y agua, mientras que la energía potencial (en forma de las posiciones relativas de los átomos en las moléculas) se libera a los alrededores como calor y calor. trabajo. El contenido de energía interna de la mezcla del producto (CO_2 / H_2O ) es menor que el de la mezcla de reactivos isooctano / (O_2 ). Sin embargo, los dos casos difieren en la forma en que la energía se libera a los alrededores. En el caso del ladrillo que cae, la energía se transfiere como el trabajo realizado en cualquier cosa que se encuentre en el camino del ladrillo; En el caso de quemar isooctano, la energía puede liberarse como calor únicamente (si la reacción se lleva a cabo en un recipiente abierto) o como una mezcla de calor y trabajo (si la reacción se lleva a cabo en el cilindro de un motor de combustión interna ) Debido a que el calor y el trabajo son las dos únicas formas en que se puede transferir energía entre un sistema y sus alrededores, cualquier cambio en la energía interna del sistema es la suma del calor transferido (q) y el trabajo realizado (w): [ 19459010]
[ΔU_ {sys} = q + w label {5.2.5} ]
Aunque (q ) y (w ) no son funciones de estado en sí mismas, su suma ( (ΔU_ {sys} )) es independiente de la ruta tomada y, por lo tanto, es una función de estado. Una tarea importante para los diseñadores de cualquier máquina que convierta energía en trabajo es maximizar la cantidad de trabajo obtenida y minimizar la cantidad de energía liberada al medio ambiente como calor. Un ejemplo es la combustión de carbón para producir electricidad. Aunque la cantidad máxima de energía disponible del proceso está fijada por el contenido de energía de los reactivos y los productos, la fracción de esa energía que puede usarse para realizar un trabajo útil no está fija.
Debido a que nos centramos casi exclusivamente en los cambios en la energía de un sistema, no utilizaremos “sys” como subíndice a menos que necesitemos distinguir explícitamente entre un sistema y sus alrededores.
Por lo tanto, debido a la primera ley, podemos determinar (ΔU ) para cualquier proceso si podemos medir tanto (q ) como (w ). El calor, (q ), puede calcularse midiendo un cambio en la temperatura de los alrededores. El trabajo, (w ), puede venir en diferentes formas, pero también se puede medir. Una forma importante de trabajo para la química es trabajo de presión-volumen realizado por un gas en expansión. A una presión externa constante (por ejemplo, presión atmosférica)
[w = −PΔV label {5.2.6} ]
El signo negativo asociado con el trabajo de (PV ) realizado indica que el sistema pierde energía cuando aumenta el volumen. Es decir, un gas en expansión funciona en su entorno, mientras que un gas comprimido se trabaja en él a su alrededor.
Resumen
En química, la pequeña parte del universo que estamos estudiando es el sistema , y el resto del universo es el entorno . Los sistemas abiertos pueden intercambiar materia y energía con su entorno, sistemas cerrados pueden intercambiar energía pero no materia con su entorno, y sistemas aislados no pueden intercambiar ni materia ni energía con su entorno. Una función de estado es una propiedad de un sistema que depende solo de su estado actual, no de su historia. Una reacción o proceso en el que el calor se transfiere de un sistema a su entorno es exotérmico . Una reacción o proceso en el que el calor se transfiere a un sistema desde su entorno es endotérmico . La primera ley de la termodinámica establece que la energía del universo es constante. El cambio en la energía interna de un sistema es la suma del calor transferido y el trabajo realizado. El flujo de calor es igual al cambio en la energía interna del sistema más el trabajo FV realizado. Cuando el volumen de un sistema es constante, los cambios en su energía interna se pueden calcular sustituyendo la ley de los gases ideales en la ecuación para ΔU.