A fines del siglo XIX, muchos físicos pensaban que su disciplina estaba en camino de explicar la mayoría de los fenómenos naturales. Podrían calcular los movimientos de los objetos materiales utilizando las leyes de Newton de la mecánica clásica, y podrían describir las propiedades de la energía radiante utilizando relaciones matemáticas conocidas como ecuaciones de Maxwell, desarrolladas en 1873 por James Clerk Maxwell, un físico escocés. El universo parecía ser un lugar simple y ordenado, que contenía materia, que consistía en partículas que tenían masa y cuya ubicación y movimiento podían describirse con precisión, y radiación electromagnética, que se consideraba que no tenía masa y cuya posición exacta en el espacio no podía ser arreglado Así, la materia y la energía se consideraron fenómenos distintos y no relacionados. Pronto, sin embargo, los científicos comenzaron a observar más de cerca algunos fenómenos inconvenientes que no podrían explicarse por las teorías disponibles en ese momento.
Radiación de cuerpo negro
Un fenómeno que parecía contradecir las teorías de la física clásica fue radiación de cuerpo negro , que es radiación electromagnética emitida por un objeto caliente. La longitud de onda (es decir, el color) de la energía radiante emitida por un cuerpo negro depende solo de su temperatura, no de su superficie o composición. Por lo tanto, un quemador de estufa eléctrico o el filamento de un calentador de espacio se ilumina de rojo o naranja cuando se calienta, mientras que el cable de tungsteno mucho más caliente en una bombilla incandescente emite una luz amarillenta.


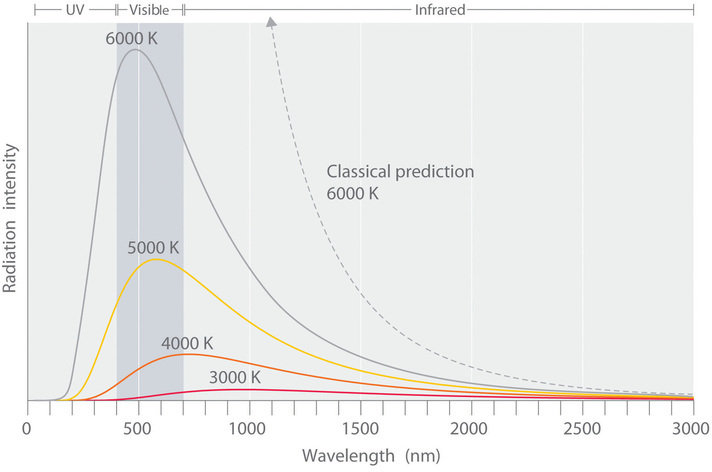
La intensidad de radiación es una medida de la energía emitida por unidad de área. En la Figura ( PageIndex {2} ) se muestra una gráfica de la intensidad de la radiación del cuerpo negro en función de la longitud de onda de un objeto a varias temperaturas. Una de las principales suposiciones de la física clásica era que la energía aumentaba o disminuía de manera suave y continua. Por ejemplo, la física clásica predijo que a medida que disminuye la longitud de onda, la intensidad de la radiación que emite un objeto debería aumentar en una curva suave sin límite a todas las temperaturas , como se muestra en la línea discontinua para 6000 K en la Figura ( PageIndex {2} ). Por lo tanto, la física clásica no pudo explicar la fuerte disminución en la intensidad de la radiación emitida a longitudes de onda más cortas (principalmente en la región ultravioleta del espectro), que se denominó la “catástrofe ultravioleta”. Sin embargo, en 1900, el físico alemán Max Planck (1858–1947) explicó la catástrofe ultravioleta al proponer (en lo que llamó “un acto de desesperación”) que la energía de las ondas electromagnéticas se cuantifica en lugar de ser continua. . Esto significa que para cada temperatura, hay una intensidad máxima de radiación que se emite en un objeto de cuerpo negro, correspondiente a los picos en la Figura ( PageIndex {2} ), por lo que la intensidad no sigue una curva suave como la temperatura aumenta, como predice la física clásica. Por lo tanto, la energía se puede ganar o perder solo en múltiplos integrales de alguna unidad más pequeña de energía, un cuántico .
Aunque la cuantización puede parecer un concepto desconocido, lo encontramos con frecuencia. Por ejemplo, el dinero estadounidense es múltiplos integrales de centavos. Del mismo modo, los instrumentos musicales como un piano o una trompeta solo pueden producir ciertas notas musicales, como C o F Sharp. Debido a que estos instrumentos no pueden producir un rango continuo de frecuencias, sus frecuencias están cuantizadas. Incluso la carga eléctrica se cuantifica: un ion puede tener una carga de −1 o −2 pero no −1.33 cargas de electrones.
Planck postuló que la energía de un cuanto particular de energía radiante podría describirse mediante la ecuación
[E = h
u label {6.2.1} ]
donde la constante de proporcionalidad h se llama constante de Planck, una de las constantes fundamentales más exactas conocidas en la ciencia. Para nuestros propósitos, su valor para cuatro cifras significativas es generalmente suficiente:
[h = 6.626 veces 10 ^ {- 34} , J • s , ( text {joule-segundos})
onumber ]
A medida que aumenta la frecuencia de la radiación electromagnética, aumenta la magnitud de la cantidad de energía radiante asociada. Al suponer que un objeto solo puede emitir energía en múltiplos integrales de h ν, Planck ideó una ecuación que se ajusta a los datos experimentales que se muestran en la Figura ( PageIndex {2} ). Podemos entender cualitativamente la explicación de Planck de la catástrofe ultravioleta de la siguiente manera: a bajas temperaturas, se emite radiación con frecuencias relativamente bajas, correspondiente a cuantos de baja energía. A medida que aumenta la temperatura de un objeto, hay una mayor probabilidad de emitir radiación con frecuencias más altas, correspondiente a cuantos de energía más alta. Sin embargo, a cualquier temperatura, es más probable que un objeto pierda energía al emitir una gran cantidad de cuantos de energía más baja que un solo cuántico de muy alta energía que corresponde a la radiación ultravioleta. El resultado es un máximo en la gráfica de la intensidad de la radiación emitida versus la longitud de onda, como se muestra en la Figura ( PageIndex {2} ), y un cambio en la posición de la longitud de onda máxima a menor (frecuencia más alta) con el aumento de la temperatura.
En el momento en que propuso su hipótesis radical, Planck no podía explicar por qué las energías debían cuantificarse. Inicialmente, su hipótesis explicaba solo un conjunto de datos experimentales: la radiación del cuerpo negro. Si se observara la cuantificación para un gran número de fenómenos diferentes, entonces la cuantización se convertiría en una ley. Con el tiempo, se podría desarrollar una teoría para explicar esa ley. Al final, la hipótesis de Planck fue la semilla de la cual surgió la física moderna.
El efecto fotoeléctrico
Solo cinco años después de que lo propuso, la hipótesis de cuantificación de Planck se utilizó para explicar un segundo fenómeno que entraba en conflicto con las leyes aceptadas de la física clásica. Cuando ciertos metales están expuestos a la luz, los electrones son expulsados de su superficie (Figura ( PageIndex {3} )). La física clásica predijo que el número de electrones emitidos y su energía cinética deberían depender solo de la intensidad de la luz, no de su frecuencia. De hecho, sin embargo, se descubrió que cada metal tenía una frecuencia umbral de luz característica; por debajo de esa frecuencia, no se emiten electrones independientemente de la intensidad de la luz. Por encima del umbral de frecuencia, se encontró que el número de electrones emitidos era proporcional a la intensidad de la luz, y su energía cinética era proporcional a la frecuencia. Este fenómeno se llamó efecto fotoeléctrico (un fenómeno en el cual los electrones son expulsados de la superficie de un metal que ha sido expuesto a la luz).
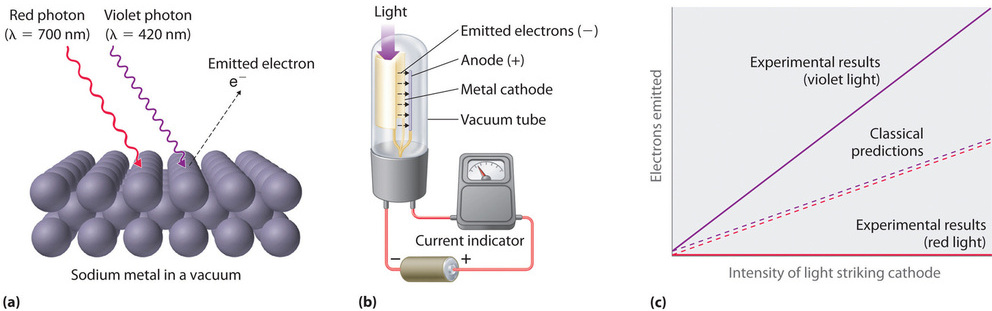
Albert Einstein (1879–1955; Premio Nobel de Física, 1921) se dio cuenta rápidamente de que la hipótesis de Planck sobre la cuantización de la energía radiante también podría explicar el efecto fotoeléctrico. La característica clave de la hipótesis de Einstein fue la suposición de que la energía radiante llega a la superficie del metal en partículas que ahora llamamos fotones (un cantidad de energía radiante, cada una de las cuales posee una energía particular energía (E ) dada por la ecuación ( ref {6.2.1} ) Einstein postuló que cada metal tiene una atracción electrostática particular para sus electrones que debe ser superada antes de que un electrón pueda ser emitido por su superficie ( (E_o =
u_o )). Si los fotones de luz con energía inferior a E o chocan contra una superficie metálica, ningún fotón tiene suficiente energía para expulsar un electrón, por lo que no se emiten electrones independientemente de la intensidad de la luz . Si un fotón con energía mayor que E o golpea el metal, entonces parte de su energía se usa para vencer las fuerzas que mantienen el electrón en la superficie del metal, y aparece el exceso de energía como la energía cinética del electrón expulsado:
[ begin {align} text {energía cinética del electrón expulsado} & = E-E_ {o}
onumber \ [4pt] & = h
u -h
u _ {o}
onumber \ [4pt] & = h left (
u –
u _ {o} right) label {6.2.2} end {align} ]
Cuando un metal es golpeado por la luz con energía por encima del umbral de energía E o , el número de electrones emitidos es proporcional a la intensidad del haz de luz, que corresponde al número de fotones por centímetro cuadrado, pero la energía cinética de los electrones emitidos es proporcional a la frecuencia de la luz. Así, Einstein demostró que la energía de los electrones emitidos dependía de la frecuencia de la luz, en contra de la predicción de la física clásica. Además, la idea de que la luz podría comportarse no solo como una onda sino como una partícula en forma de fotones sugiere que, después de todo, la materia y la energía podrían no ser fenómenos no relacionados.

El postulado de Planck y Einstein de que la energía se cuantifica es en muchos aspectos similar a la descripción de átomos de Dalton. Ambas teorías se basan en la existencia de bloques de construcción simples, átomos en un caso y cuantos de energía en el otro. El trabajo de Planck y Einstein sugirió una conexión entre la naturaleza cuantificada de la energía y las propiedades de los átomos individuales.
Resumen
Los componentes básicos de la energía son los cuantos y la materia son los átomos. Las propiedades de la radiación de cuerpo negro , la radiación emitida por los objetos calientes, no podrían explicarse con la física clásica. Max Planck postuló que la energía se cuantificó y podría emitirse o absorberse solo en múltiplos integrales de una pequeña unidad de energía, conocida como cuántica . La energía de un cuanto es proporcional a la frecuencia de la radiación; la constante de proporcionalidad (h ) es una constante fundamental (constante de Planck). Albert Einstein utilizó el concepto de Planck de la cuantización de la energía para explicar el efecto fotoeléctrico , la expulsión de electrones de ciertos metales cuando se exponen a la luz. Einstein postuló la existencia de lo que hoy llamamos fotones , partículas de luz con una energía particular, (E = h
u ). Tanto la energía como la materia tienen bloques de construcción fundamentales: cuantos y átomos, respectivamente.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )