
9.4: Enlace covalente y superposición orbital
- ID de página
- 21754
Aunque el modelo VSEPR es un método simple y útil para predecir cualitativamente las estructuras de una amplia gama de compuestos, no es infalible. Predice, por ejemplo, que H 2 S y PH 3 deben tener estructuras similares a las de ( ce {H2O} ) y ( ce {NH3} ), respectivamente. De hecho, los estudios estructurales han demostrado que los ángulos H – S – H y H – P – H son más de 12 ° más pequeños que los ángulos de enlace correspondientes en ( ce {H2O} ) y ( ce {NH3} ). Más inquietante, el modelo VSEPR predice que los haluros simples del grupo 2 (MX 2 ), que tienen cuatro electrones de valencia, deben tener geometrías lineales X – M – X. En cambio, muchas de estas especies, incluidas ( ce {SrF2} ) y ( ce {BaF2} ), están significativamente dobladas. Se necesita un tratamiento más sofisticado de la unión para sistemas como estos. En esta sección, presentamos una descripción mecánica cuántica de los enlaces, en la que los electrones de enlace se consideran localizados entre los núcleos de los átomos unidos. La superposición de los orbitales de enlace aumenta sustancialmente a través de un proceso llamado hibridación , que da como resultado la formación de enlaces más fuertes.
Introducción
Como hemos hablado sobre el uso de estructuras de Lewis para representar la unión en compuestos covalentes, hemos sido muy vagos en nuestro lenguaje sobre la naturaleza real de los enlaces químicos en sí. Sabemos que un enlace covalente implica el “intercambio” de un par de electrones entre dos átomos, pero ¿cómo sucede esto y cómo conduce a la formación de un enlace que mantenga los dos átomos juntos?
La teoría de enlace de valencia se introduce para describir el enlace en moléculas covalentes. En este modelo, se considera que los enlaces se forman a partir de la superposición de dos orbitales atómicos en diferentes átomos, cada orbital contiene un solo electrón. Al observar moléculas inorgánicas simples como H 2 o HF, bastará nuestra comprensión actual de los orbitales atómicos sy p. Sin embargo, para explicar la unión en las moléculas orgánicas, tendremos que introducir el concepto de orbitales híbridos .
Ejemplo: La molécula H 2
El caso más simple a considerar es la molécula de hidrógeno, H 2 . Cuando decimos que los dos electrones de cada uno de los átomos de hidrógeno se comparten para formar un enlace covalente entre los dos átomos, lo que queremos decir en términos de la teoría del enlace de valencia es que los dos orbitales esféricos 1 s se superponen, permitiendo los dos electrones para formar un par dentro de los dos orbitales superpuestos. En términos simples, podemos decir que ambos electrones ahora pasan más tiempo entre los dos núcleos y, por lo tanto, mantienen unidos a los átomos. Como veremos, la situación no es tan simple como eso, porque el par de electrones todavía debe obedecer a la mecánica cuántica, es decir, los dos electrones ahora deben ocupar un espacio orbital compartido . Este será el principio esencial de la teoría del enlace de valencia.

¿A qué distancia están los dos núcleos? Esa es una cuestión muy importante a tener en cuenta. Si están demasiado separados, sus respectivos orbitales 1 s no pueden solaparse y, por lo tanto, no se puede formar un enlace covalente; siguen siendo solo dos átomos de hidrógeno separados. A medida que se acercan cada vez más, comienza a producirse una superposición orbital y comienza a formarse un vínculo. Esto reduce la energía potencial del sistema, ya que las interacciones electrostáticas positivas-negativas nuevas atractivas se hacen posibles entre el núcleo de un átomo y el electrón del segundo. Sin embargo, algo más está sucediendo al mismo tiempo: a medida que los átomos se acercan, la interacción positiva-positiva repulsiva entre los dos núcleos también comienza a aumentar.

Al principio, esta repulsión está más que compensada por la atracción entre los núcleos y los electrones, pero en cierto punto, a medida que los núcleos se acercan aún más, las fuerzas repulsivas comienzan a superar las fuerzas atractivas y la energía potencial del sistema aumenta. con rapidez. Cuando los dos núcleos están “demasiado cerca”, tenemos una situación muy inestable y de alta energía. Existe una distancia óptima definida entre los núcleos en la que la energía potencial es mínima, lo que significa que las fuerzas de atracción y repulsión combinadas se suman a la mayor fuerza de atracción general. Esta distancia internuclear óptima es la longitud del enlace . Para la molécula H 2 , esta distancia es 74 x 10 -12 metros, o 0,74 Å (Å significa angstrom, o 10 -10 metros). Del mismo modo, la diferencia en energía potencial entre el estado más bajo (a la distancia internuclear óptima) y el estado donde los dos átomos están completamente separados se llama energía de enlace . Para la molécula de hidrógeno, esta energía es igual a aproximadamente 104 kcal / mol.
Cada enlace covalente en una molécula dada tiene una longitud y resistencia características. En general, los enlaces simples carbono-carbono tienen aproximadamente 1.5 Å de largo (Å significa angstrom, o 10 -10 metros) mientras que los enlaces dobles carbono-carbono son aproximadamente 1.3 Å, los enlaces dobles carbono-oxígeno son aproximadamente 1.2 Å , y los enlaces carbono-hidrógeno están en el rango de 1.0 – 1.1 Å. La mayoría de los enlaces covalentes en las moléculas orgánicas varían en fuerza desde poco menos de 100 kcal / mol (para un enlace carbono-hidrógeno en etano, por ejemplo) hasta casi 200 kcal / mol. Puede consultar las tablas en los libros de referencia, como el Manual de Química y Física del CRC para obtener listas extensas de longitudes de enlace, fuerzas y muchos otros datos para compuestos orgánicos específicos.
Teoría del enlace de valencia: un enfoque de enlace localizado
Aprendiste que cuando dos átomos de hidrógeno se acercan entre sí desde una distancia infinita, la energía del sistema alcanza un mínimo. Esta región de energía mínima en el diagrama de energía corresponde a la formación de un enlace covalente entre los dos átomos a una distancia H – H de 74 pm (Figura ( PageIndex {1} )). De acuerdo con la mecánica cuántica, los enlaces se forman entre los átomos porque sus orbitales atómicos se superponen, y cada región de superposición acomoda un máximo de dos electrones con espín opuesto , de acuerdo con el principio de Pauli. En este caso, se forma un enlace entre los dos átomos de hidrógeno cuando el orbital atómico 1 s s ocupado de un átomo de hidrógeno se solapa con el orbital atómico 1 s ocupado individualmente de un segundo átomo de hidrógeno . La densidad de electrones entre los núcleos aumenta debido a esta superposición orbital y da como resultado un enlace de par de electrones localizado (Figura ( PageIndex {1} )).
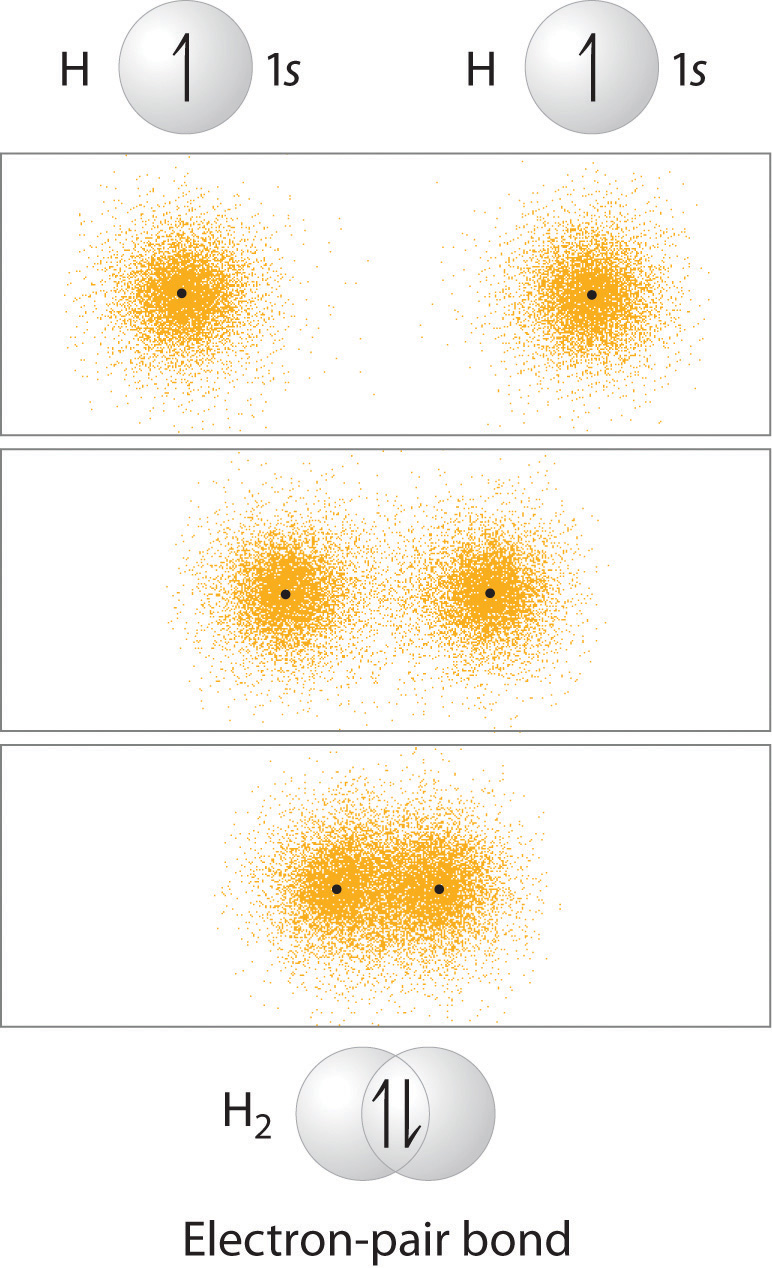
Aunque las estructuras de Lewis y VSEPR también contienen enlaces de pares de electrones localizados, ninguna descripción utiliza un enfoque orbital atómico para predecir la estabilidad del enlace. Hacerlo forma la base para una descripción del enlace químico conocido como teoría de enlace de valencia , que se basa en dos supuestos:
- La fuerza de un enlace covalente es proporcional a la cantidad de solapamiento entre los orbitales atómicos; es decir, cuanto mayor es la superposición, más estable es el enlace.
- Un átomo puede usar diferentes combinaciones de orbitales atómicos para maximizar la superposición de los orbitales utilizados por los átomos unidos.
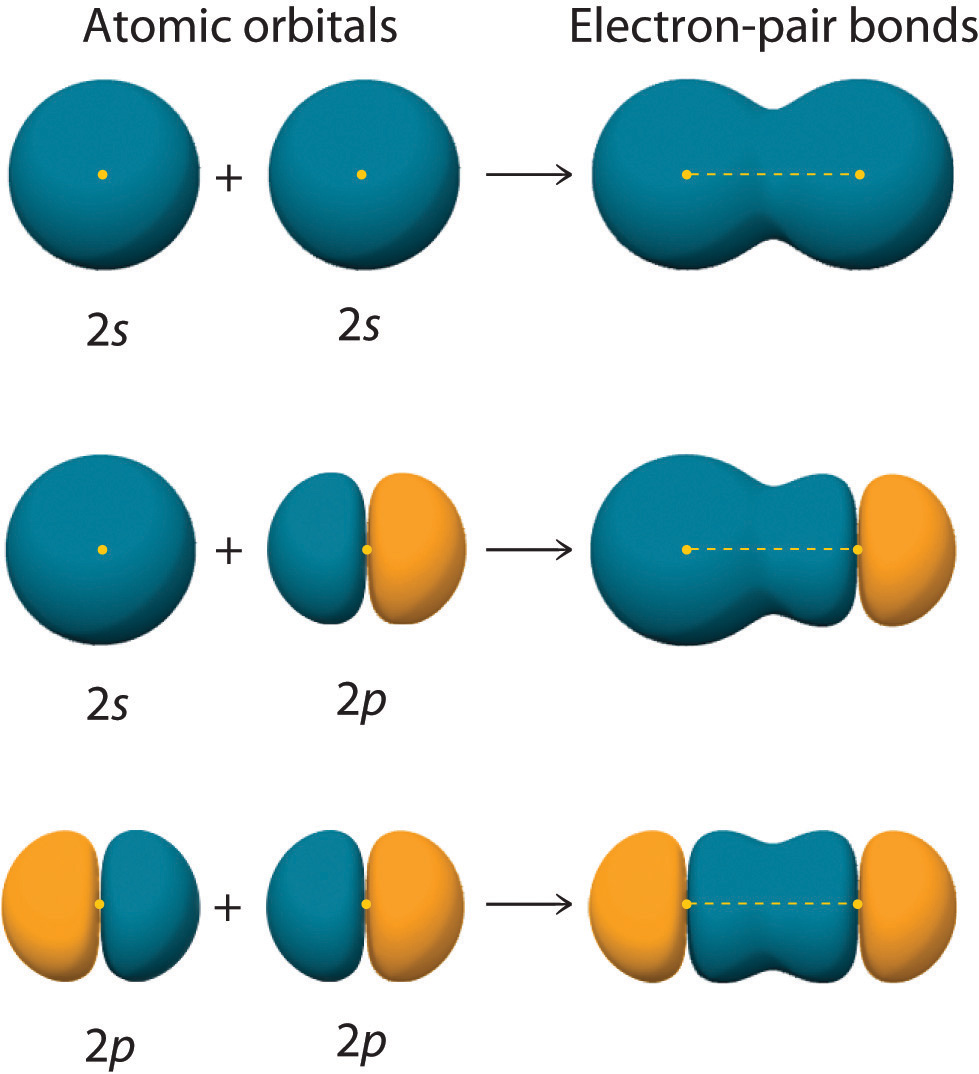
La figura ( PageIndex {2} ) muestra un enlace de par de electrones formado por la superposición de dos ns orbitales atómicos, dos np orbitales atómicos y un [19459170 ] ns y un np orbital donde n = 2. Observe que se produce una superposición de unión cuando los orbitales atómicos que interactúan tienen la orientación correcta (están “apuntando” entre sí) y están en la fase (representada por colores en la Figura ( PageIndex {2} )).
Examinemos los enlaces en BeH 2 , por ejemplo. Según el modelo VSEPR, BeH 2 es un compuesto lineal con cuatro electrones de valencia y dos enlaces Be – H. Su unión también se puede describir utilizando un enfoque orbital atómico. El berilio tiene una configuración electrónica de 1 s 2 2 s 2 , y cada átomo de H tiene un 1 s 1 configuración electrónica. Debido a que el átomo Be tiene una subcapa de 2 s llena, sin embargo, no tiene orbitales ocupados individualmente disponibles para superponerse con los orbitales 1 s ocupados individualmente en los átomos de H. Si un orbital de 1 s ocupado individualmente en hidrógeno se solapara con un orbital de 2 s lleno en berilio, el orbital de unión resultante contendría tres electrones, pero el El máximo permitido por la mecánica cuántica es dos . ¿Cómo es entonces que el berilio puede unirse a dos átomos de hidrógeno? Una forma sería agregar suficiente energía para excitar uno de sus 2 s electrones en un orbital 2 p vacío e invertir su giro, en un proceso llamado promoción:

En este estado excitado, el átomo Be tendría dos orbitales atómicos ocupados individualmente (los 2 s y uno de los 2 p orbitales), cada uno de los cuales podría superponerse con un individualmente ocupó 1 s orbital de un átomo de H para formar un enlace de par de electrones. Aunque esto produciría ( ce {BeH2} ), los dos enlaces Be – H no serían equivalentes: el orbital 1 s de un átomo de hidrógeno se superpondría con un Be 2 s [ 19459171] orbital, y el orbital 1 s del otro átomo de hidrógeno se superpondría con un orbital de una energía diferente, un orbital Be 2 p . Sin embargo, la evidencia experimental indica que los dos enlaces Be – H tienen energías idénticas. Para resolver esta discrepancia y explicar cómo se forman moléculas como ( ce {BeH2} ), los científicos desarrollaron el concepto de hibridación.
Colaboradores
-
Química orgánica con énfasis biológico por Tim Soderberg (Universidad de Minnesota, Morris)