Los químicos estudian las estructuras, las propiedades físicas y las propiedades químicas de las sustancias materiales. Estos consisten en materia , que es cualquier cosa que ocupe espacio y tenga masa. El oro y el iridio son materia, al igual que el maní, las personas y los sellos postales. El humo, el smog y el gas hilarante son materia. La energía, la luz y el sonido, sin embargo, no son materia; Las ideas y las emociones tampoco son importantes.
La masa de un objeto es la cantidad de materia que contiene. No confunda la masa de un objeto con su peso , que es una fuerza causada por la atracción gravitacional que opera sobre el objeto. La masa es una propiedad fundamental de un objeto que no depende de su ubicación. En términos físicos, la masa de un objeto es directamente proporcional a la fuerza requerida para cambiar su velocidad o dirección. Una discusión más detallada de las diferencias entre peso y masa y las unidades utilizadas para medirlas se incluye en Habilidades esenciales 1 ( Sección 1.9 ). El peso, por otro lado, depende de la ubicación de un objeto. Un astronauta cuya masa es de 95 kg pesa alrededor de 210 lb en la Tierra pero solo alrededor de 35 lb en la luna porque la fuerza gravitacional que experimenta en la luna es aproximadamente un sexto de la fuerza experimentada en la Tierra. Para fines prácticos, el peso y la masa a menudo se usan indistintamente en los laboratorios. Debido a que la fuerza de gravedad se considera igual en todas partes en la superficie de la Tierra, 2.2 lb (un peso) es igual a 1.0 kg (una masa), independientemente de la ubicación del laboratorio en la Tierra.
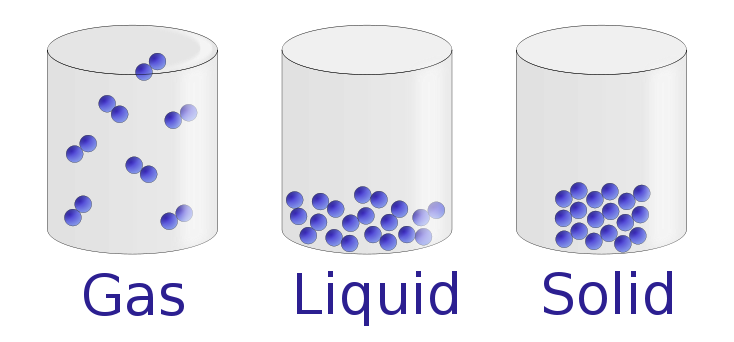
En condiciones normales, hay tres estados distintos de la materia: sólidos, líquidos y gases. Los sólidos son relativamente rígidos y tienen formas y volúmenes fijos. Una roca, por ejemplo, es un sólido. En contraste, los líquidos tienen volúmenes fijos pero fluyen para asumir la forma de sus envases, como una bebida en una lata. Los gases , como el aire en un neumático de automóvil, no tienen formas ni volúmenes fijos y se expanden para llenar completamente sus contenedores. Mientras que el volumen de gases depende en gran medida de su temperatura y presión (la cantidad de fuerza ejercida en un área determinada), los volúmenes de líquidos y sólidos son prácticamente independientes de la temperatura y la presión. La materia a menudo puede cambiar de un estado físico a otro en un proceso llamado cambio físico . Por ejemplo, el agua líquida puede calentarse para formar un gas llamado vapor, o el vapor puede enfriarse para formar agua líquida. Sin embargo, tales cambios de estado no afectan la composición química de la sustancia.
Sustancias y mezclas puras
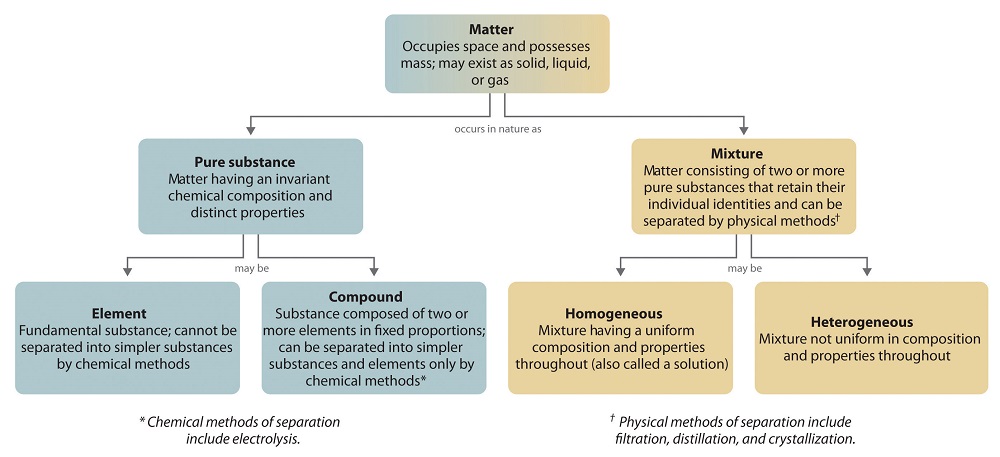
Una sustancia química pura es cualquier materia que tenga una composición química fija y propiedades características. El oxígeno, por ejemplo, es una sustancia química pura que es un gas incoloro e inodoro a 25 ° C. Muy pocas muestras de materia consisten en sustancias puras; en cambio, la mayoría son mezclas, que son combinaciones de dos o más sustancias puras en proporciones variables en las que las sustancias individuales conservan su identidad. El aire, el agua del grifo, la leche, el queso azul, el pan y la suciedad son todas mezclas. Si todas las partes de un material están en el mismo estado, no tienen límites visibles y son uniformes, el material es homogéneo . Ejemplos de mezclas homogéneas son el aire que respiramos y el agua del grifo que bebemos. Las mezclas homogéneas también se denominan soluciones. Así, el aire es una solución de nitrógeno, oxígeno, vapor de agua, dióxido de carbono y varios otros gases; El agua del grifo es una solución de pequeñas cantidades de varias sustancias en el agua. Sin embargo, las composiciones específicas de ambas soluciones no son fijas, sino que dependen tanto de la fuente como de la ubicación; Por ejemplo, la composición del agua del grifo en Boise, Idaho, no es la misma que la composición del agua del grifo en Buffalo, Nueva York. Aunque la mayoría de las soluciones que encontramos son líquidas, las soluciones también pueden ser sólidas. La sustancia gris que todavía usan algunos dentistas para llenar las cavidades de los dientes es una solución sólida compleja que contiene 50% de mercurio y 50% de un polvo que contiene principalmente plata, estaño y cobre, con pequeñas cantidades de zinc y mercurio. Las soluciones sólidas de dos o más metales se denominan comúnmente aleaciones.
Si la composición de un material no es completamente uniforme, entonces es heterogénea (p. Ej., Masa de galleta con chispas de chocolate, queso azul y suciedad). Las mezclas que parecen ser homogéneas a menudo se encuentran heterogéneas después del examen microscópico. La leche, por ejemplo, parece ser homogénea, pero cuando se examina con un microscopio, claramente consiste en pequeños glóbulos de grasa y proteína dispersos en agua. Los componentes de mezclas heterogéneas generalmente se pueden separar por medios simples. Las mezclas sólido-líquido como arena en agua u hojas de té en té se separan fácilmente por filtración, que consiste en pasar la mezcla a través de una barrera, como un filtro, con agujeros o poros que son más pequeños que las partículas sólidas. En principio, las mezclas de dos o más sólidos, como el azúcar y la sal, se pueden separar mediante inspección microscópica y clasificación. Sin embargo, generalmente son necesarias operaciones más complejas, como cuando se separan las pepitas de oro de la grava del río. El primer material sólido se filtra del agua del río; entonces los sólidos se separan por inspección. Si el oro está incrustado en la roca, es posible que deba aislarse mediante métodos químicos.
-and-Milk-(left).jpg?revision=1)
Las mezclas homogéneas (soluciones) se pueden separar en sus sustancias componentes mediante procesos físicos que se basan en diferencias en algunas propiedades físicas, como las diferencias en sus puntos de ebullición. Dos de estos métodos de separación son la destilación y la cristalización. La destilación hace uso de las diferencias en la volatilidad, una medida de la facilidad con que una sustancia se convierte en un gas a una temperatura dada. Un aparato de destilación simple para separar una mezcla de sustancias, al menos una de las cuales es un líquido. El componente más volátil hierve primero y se condensa de nuevo a un líquido en el condensador enfriado por agua, desde el cual fluye hacia el matraz receptor. Si se destila una solución de sal y agua, por ejemplo, el componente más volátil, el agua pura, se acumula en el matraz receptor, mientras que la sal permanece en el matraz de destilación.

Las mezclas de dos o más líquidos con diferentes puntos de ebullición se pueden separar con un aparato de destilación más complejo. Un ejemplo es la refinación del petróleo crudo en una gama de productos útiles: combustible de aviación, gasolina, queroseno, combustible diesel y aceite lubricante (en el orden aproximado de disminución de la volatilidad). Otro ejemplo es la destilación de espíritus alcohólicos como el brandy o el whisky. (¡Este procedimiento relativamente simple causó más de unos pocos dolores de cabeza a las autoridades federales en la década de 1920 durante la era de la Prohibición, cuando todavía proliferaron ilegales en regiones remotas de los Estados Unidos!)
Cristalización separa las mezclas en función de las diferencias de solubilidad, una medida de la cantidad de sustancia sólida que permanece disuelta en una cantidad dada de un líquido específico. La mayoría de las sustancias son más solubles a temperaturas más altas, por lo que una mezcla de dos o más sustancias se puede disolver a una temperatura elevada y luego dejar que se enfríe lentamente. Alternativamente, el líquido, llamado solvente, puede evaporarse. En cualquier caso, la sustancia menos soluble de las disueltas, la que tiene menos probabilidades de permanecer en solución, generalmente forma cristales primero, y estos cristales pueden eliminarse de la solución restante por filtración.

La mayoría de las mezclas se pueden separar en sustancias puras, que pueden ser elementos o compuestos. Un elemento , como el sodio metálico gris, es una sustancia que no puede descomponerse en otras más simples por cambios químicos; un compuesto , como el cloruro de sodio blanco cristalino, contiene dos o más elementos y tiene propiedades químicas y físicas que generalmente son diferentes de las de los elementos que lo componen. Con solo unas pocas excepciones, un compuesto particular tiene la misma composición elemental (los mismos elementos en las mismas proporciones) independientemente de su origen o historia. La composición química de una sustancia se altera en un proceso llamado cambio químico . La conversión de dos o más elementos, como el sodio y el cloro, en un compuesto químico, cloruro de sodio, es un ejemplo de un cambio químico, a menudo llamado reacción química. Actualmente, se conocen unos 118 elementos, pero se han preparado millones de compuestos químicos a partir de estos 118 elementos. Los elementos conocidos se enumeran en la tabla periódica .
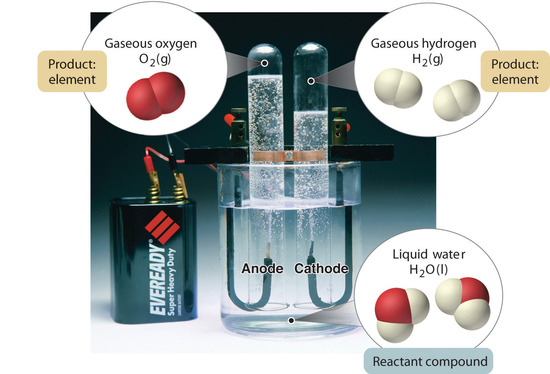
En general, un proceso químico inverso descompone los compuestos en sus elementos. Por ejemplo, el agua (un compuesto) puede descomponerse en hidrógeno y oxígeno (ambos elementos) mediante un proceso llamado electrólisis. En la electrólisis, la electricidad proporciona la energía necesaria para separar un compuesto en sus elementos constituyentes ( Figura ( PageIndex {5} ) ). Se utiliza una técnica similar a gran escala para obtener aluminio puro, un elemento, a partir de sus minerales, que son mezclas de compuestos. Debido a que se requiere una gran cantidad de energía para la electrólisis, el costo de la electricidad es, con mucho, el mayor gasto incurrido en la fabricación de aluminio puro. Por lo tanto, reciclar aluminio es rentable y ecológicamente racional.
La organización general de la materia y los métodos utilizados para separar las mezclas se resumen en Figura ( PageIndex {6} ) .
Resumen
La materia puede clasificarse según sus propiedades físicas y químicas. La materia es cualquier cosa que ocupa espacio y tiene masa. Los tres estados de la materia son sólido, líquido y gaseoso. Un cambio físico implica la conversión de una sustancia de un estado de materia a otro, sin cambiar su composición química. La mayor parte de la materia consiste en mezclas de sustancias puras, que pueden ser homogéneas (de composición uniforme) o heterogéneas (las diferentes regiones poseen diferentes composiciones y propiedades). Las sustancias puras pueden ser compuestos químicos o elementos. Los compuestos pueden descomponerse en elementos mediante reacciones químicas, pero los elementos no pueden separarse en sustancias más simples por medios químicos. Las propiedades de las sustancias se pueden clasificar como físicas o químicas. Los científicos pueden observar las propiedades físicas sin cambiar la composición de la sustancia, mientras que las propiedades químicas describen la tendencia de una sustancia a sufrir cambios químicos (reacciones químicas) que cambian su composición química. Las propiedades físicas pueden ser intensivas o extensivas. Las propiedades intensivas son las mismas para todas las muestras; no depende del tamaño de la muestra; e incluyen, por ejemplo, color, estado físico y puntos de fusión y ebullición. Las propiedades extensivas dependen de la cantidad de material e incluyen masa y volumen. La relación de dos propiedades extensivas, masa y volumen, es una propiedad intensiva importante llamada densidad.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )