Toda la materia tiene propiedades físicas y químicas. Las propiedades físicas son características que los científicos pueden medir sin cambiar la composición de la muestra en estudio, como la masa, el color y el volumen (la cantidad de espacio ocupado por una muestra). Propiedades químicas describen la capacidad característica de una sustancia para reaccionar y formar nuevas sustancias; incluyen su inflamabilidad y susceptibilidad a la corrosión. Todas las muestras de una sustancia pura tienen las mismas propiedades químicas y físicas. Por ejemplo, el cobre puro es siempre un sólido marrón rojizo (una propiedad física) y siempre se disuelve en ácido nítrico diluido para producir una solución azul y un gas marrón (una propiedad química).
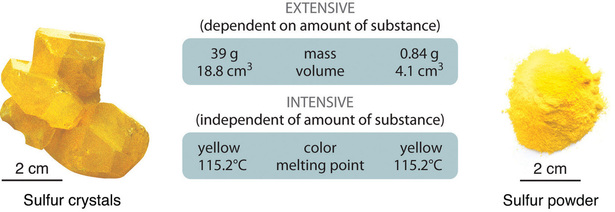
Las propiedades físicas pueden ser extensivas o intensivas. Amplias propiedades varían con la cantidad de la sustancia e incluyen masa, peso y volumen. Propiedades intensivas , por el contrario, no dependen de la cantidad de la sustancia; incluyen color, punto de fusión, punto de ebullición, conductividad eléctrica y estado físico a una temperatura dada. Por ejemplo, el azufre elemental es un sólido cristalino amarillo que no conduce electricidad y tiene un punto de fusión de 115,2 ° C, sin importar la cantidad que se examine ( Figura ( PageIndex {1} ) ). Los científicos suelen medir las propiedades intensivas para determinar la identidad de una sustancia, mientras que las propiedades extensas transmiten información sobre la cantidad de la sustancia en una muestra.
Aunque la masa y el volumen son propiedades extensivas, su relación es una propiedad intensiva importante llamada densidad ( ( rho )). La densidad se define como la masa por unidad de volumen y generalmente se expresa en gramos por centímetro cúbico (g / cm 3 ). A medida que la masa aumenta en un volumen dado, la densidad también aumenta. Por ejemplo, el plomo, con su mayor masa, tiene una densidad mucho mayor que el mismo volumen de aire, al igual que un ladrillo tiene una densidad mayor que el mismo volumen de espuma de poliestireno. A una temperatura y presión determinadas, la densidad de una sustancia pura es una constante:
[ begin {align *} text {densidad} & = { text {mass} over text {volumen}} \ [4pt] rho & = {m over V} label { Eq1} end {align *} ]
El agua pura, por ejemplo, tiene una densidad de 0,998 g / cm 3 a 25 ° C. Las densidades promedio de algunas sustancias comunes están en Tabla ( PageIndex {1} ). Observe que el aceite de maíz tiene una relación masa / volumen menor que el agua. Esto significa que cuando se agrega al agua, el aceite de maíz “flotará” (Figura ( PageIndex {2} )).
| Sustancia | Densidad a 25 ° C (g / cm 3 ) | Sustancia | Densidad a 25 ° C (g / cm 3 ) |
|---|---|---|---|
| sangre | 1.035 | aceite de maíz | 0,922 |
| grasa corporal | 0,918 | mayonesa | 0,910 |
| leche entera | 1.030 | miel | 1.420 |

Propiedad física y cambio
Los cambios físicos son cambios en los que no se rompen ni se forman enlaces químicos. Esto significa que los mismos tipos de compuestos o elementos que estaban allí al comienzo del cambio están allí al final del cambio. Debido a que los materiales finales son los mismos que los materiales iniciales, las propiedades (como color, punto de ebullición, etc.) también serán las mismas. Los cambios físicos implican mover las moléculas, pero no cambiarlas. Algunos tipos de cambios físicos incluyen:
- Cambios de estado (cambios de un sólido a un líquido o un gas y viceversa)
- Separación de una mezcla
- Deformación física (corte, abolladura, estiramiento)
- Fabricación de soluciones (tipos especiales de mezclas).
A medida que se derrite un cubo de hielo, su forma cambia a medida que adquiere la capacidad de fluir. Sin embargo, su composición no cambia. La fusión es un ejemplo de un cambio físico (Figura ( PageIndex {3} )), ya que algunas propiedades del material cambian, pero la identidad de la materia no. Los cambios físicos pueden clasificarse además como reversibles o irreversibles. El cubo de hielo derretido se puede volver a congelar, por lo que la fusión es un cambio físico reversible. Los cambios físicos que implican un cambio de estado son todos reversibles. Otros cambios de estado incluyen vaporización (líquido a gas), congelación (líquido a sólido) y condensación (gas a líquido). Disolver es también un cambio físico reversible. Cuando la sal se disuelve en agua, se dice que la sal ha entrado en estado acuoso. La sal puede recuperarse hirviendo el agua, dejando atrás la sal.

Figura ( PageIndex {3} ): Ice Melting es un cambio físico. Cuando el agua sólida ( ( ce {H_2O} )) como hielo se derrite en un líquido (agua), parece cambiada. Sin embargo, este cambio es solo físico, ya que la composición de las moléculas constituyentes es la misma: 11,19% de hidrógeno y 88,81% de oxígeno en masa.
Propiedades químicas y cambio
Los cambios químicos ocurren cuando los enlaces se rompen y / o se forman entre moléculas o átomos. Esto significa que una sustancia con un cierto conjunto de propiedades (como punto de fusión, color, sabor, etc.) se convierte en una sustancia diferente con diferentes propiedades. Los cambios químicos son con frecuencia más difíciles de revertir que los cambios físicos.
Un buen ejemplo de un cambio químico es quemar papel. En contraste con el acto de rasgar el papel, el acto de quemar papel en realidad resulta en la formación de nuevos químicos (dióxido de carbono y agua, para ser exactos). Otro ejemplo de cambio químico ocurre cuando se forma agua. Cada molécula contiene dos átomos de hidrógeno y un átomo de oxígeno unidos químicamente.
Otro ejemplo de cambio químico es lo que ocurre cuando se quema gas natural en su horno. Esta vez, antes de la reacción tenemos una molécula de metano, ( ce {CH_4} ), y dos moléculas de oxígeno, ( ce {O_2} ), mientras que después de la reacción tenemos dos moléculas de agua, ( ce {H_2O} ), y una molécula de dióxido de carbono, ( ce {CO_2} ). En este caso, no solo ha cambiado la apariencia, sino que también ha cambiado la estructura de las moléculas. Las nuevas sustancias no tienen las mismas propiedades químicas que las originales. Por lo tanto, este es un cambio químico.
La combustión del magnesio metálico también es un cambio químico (Magnesio + Oxígeno → Óxido de Magnesio):
[ ce {2 Mg + O_2 rightarrow 2 MgO}
onumber ]
como es la oxidación del hierro (hierro + oxígeno → óxido de hierro / óxido):
[ ce {4 Fe + 3O_2 rightarrow 2 Fe_2O_3}
onumber ]
Usando los componentes de composición y propiedades, tenemos la capacidad de distinguir una muestra de materia de las otras.
Referencias
- Petrucci, Bissonnette, Arenque, Madura. Química general: principios y aplicaciones modernas. Décima ed. Upper Saddle River, NJ 07458: Pearson Education Inc., 2011.
- Cracolice, Peters. Conceptos básicos de la química introductoria Un enfoque de aprendizaje activo. Segunda ed. Belmont, CA 94001: Brooks / Cole, 2007.
Colaboradores
- Samantha Ma (UC Davis)