Los postulados de la teoría cinética molecular de los gases ignoran tanto el volumen ocupado por las moléculas de un gas como todas las interacciones entre las moléculas, ya sean atractivas o repulsivas. En realidad, sin embargo, todos los gases tienen volúmenes moleculares distintos de cero. Además, las moléculas de gases reales interactúan entre sí de formas que dependen de la estructura de las moléculas y, por lo tanto, difieren para cada sustancia gaseosa. En esta sección, consideramos las propiedades de los gases reales y cómo y por qué difieren de las predicciones de la ley de los gases ideales. También examinamos la licuefacción, una propiedad clave de los gases reales que no es predicha por la teoría cinética molecular de los gases.
Relaciones de presión, volumen y temperatura en gases reales
Para un gas ideal, una gráfica de (PV / nRT ) versus (P ) da una línea horizontal con una intersección de 1 en el eje (PV / nRT ). Sin embargo, los gases reales muestran desviaciones significativas del comportamiento esperado para un gas ideal, particularmente a altas presiones (Figura ( PageIndex {1a} )). Solo a presiones relativamente bajas (menos de 1 atm) los gases reales se aproximan al comportamiento ideal del gas (Figura ( PageIndex {1b} )).
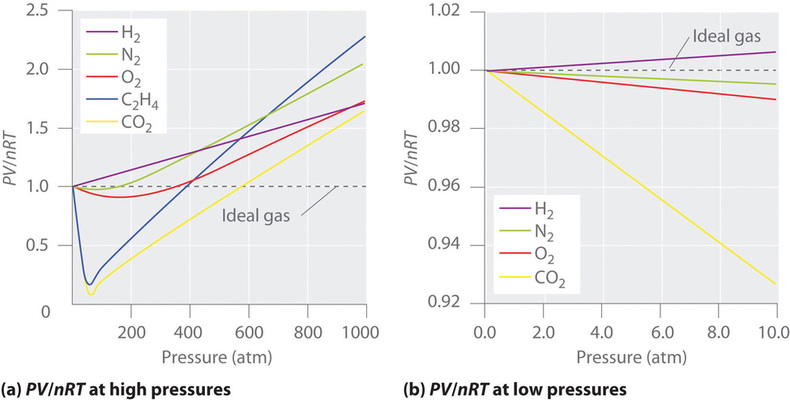
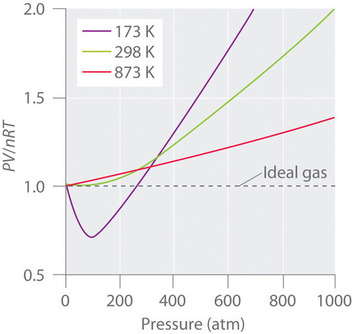
Los gases reales también se acercan más al comportamiento del gas ideal a temperaturas más altas, como se muestra en la Figura ( PageIndex {2} ) para (N_2 ). ¿Por qué los gases reales se comportan de manera tan diferente a los gases ideales a altas presiones y bajas temperaturas? En estas condiciones, los dos supuestos básicos detrás de la ley de los gases ideales, a saber, que las moléculas de gas tienen un volumen insignificante y que las interacciones intermoleculares son insignificantes, ya no son válidas.
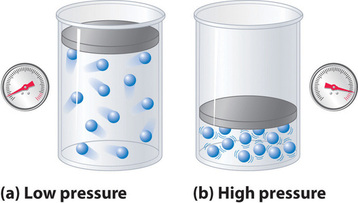
Debido a que se supone que las moléculas de un gas ideal tienen un volumen cero, el volumen disponible para el movimiento es siempre el mismo que el volumen del contenedor. En contraste, las moléculas de un gas real tienen volúmenes pequeños pero medibles. A presiones bajas, las moléculas gaseosas están relativamente separadas, pero a medida que aumenta la presión del gas, las distancias intermoleculares se hacen cada vez más pequeñas (Figura ( PageIndex {3} )). Como resultado, el volumen ocupado por las moléculas se vuelve significativo en comparación con el volumen del contenedor. En consecuencia, el volumen total ocupado por el gas es mayor que el volumen predicho por la ley del gas ideal. Así, a presiones muy altas, el valor medido experimentalmente de PV / nRT es mayor que el valor predicho por la ley de los gases ideales.
Además, todas las moléculas son atraídas entre sí por una combinación de fuerzas. Estas fuerzas se vuelven particularmente importantes para los gases a bajas temperaturas y altas presiones, donde las distancias intermoleculares son más cortas. Las atracciones entre las moléculas reducen el número de colisiones con la pared del contenedor, un efecto que se vuelve más pronunciado a medida que aumenta el número de interacciones atractivas. Debido a que la distancia promedio entre las moléculas disminuye, la presión ejercida por el gas en la pared del recipiente disminuye, y la presión observada es menor de lo esperado (Figura ( PageIndex {4} )). Por lo tanto, como se muestra en la Figura ( PageIndex {2} ), a bajas temperaturas, la relación de (PV / nRT ) es menor de lo previsto para un gas ideal, un efecto que se vuelve particularmente evidente para gases complejos y para gases simples a bajas temperaturas. A presiones muy altas, predomina el efecto del volumen molecular distinto de cero. La competencia entre estos efectos es responsable del mínimo observado en la gráfica (PV / nRT ) versus (P ) para muchos gases.
El volumen molecular distinto de cero hace que el volumen real sea mayor de lo previsto a altas presiones; Las atracciones intermoleculares hacen que la presión sea menor de lo previsto.
A altas temperaturas, las moléculas tienen suficiente energía cinética para vencer las fuerzas de atracción intermoleculares, y predominan los efectos del volumen molecular distinto de cero. Por el contrario, a medida que baja la temperatura, disminuye la energía cinética de las moléculas de gas. Finalmente, se alcanza un punto donde las moléculas ya no pueden superar las fuerzas de atracción intermoleculares, y el gas se licua (se condensa en un líquido).
La ecuación de van der Waals
El físico holandés Johannes van der Waals (1837–1923; Premio Nobel de Física, 1910) modificó la ley de los gases ideales para describir el comportamiento de los gases reales al incluir explícitamente los efectos del tamaño molecular y las fuerzas intermoleculares. En su descripción del comportamiento de los gases, la llamada ecuación van der Waals ,
[ underbrace { left (P + dfrac {an ^ 2} {V ^ 2} right)} _ { text {Pressure Term}} overbrace {(V – nb)} ^ { texto {Término de presión}} = nRT etiqueta {10.9.1} ]
a y b son constantes empíricas que son diferentes para cada gas. Los valores de (a ) y (b ) se enumeran en la Tabla ( PageIndex {1} ) para varios gases comunes.
| Gas | a ((L 2 · atm) / mol 2 ) | b (L / mol) |
|---|---|---|
| Él | 0,03410 | 0,0238 |
| Ne | 0,205 | 0,0167 |
| Ar | 1.337 | 0,032 |
| H 2 | 0,2420 | 0,0265 |
| N 2 | 1.352 | 0,0387 |
| O 2 | 1.364 | 0,0319 |
| Cl 2 | 6,260 | 0,0542 |
| NH 3 | 4.170 | 0,0371 |
| CH 4 | 2.273 | 0,0430 |
| CO 2 | 3.610 | 0,0429 |
El término de presión en la ecuación ( ref {10.9.1} ) corrige las fuerzas de atracción intermoleculares que tienden a reducir la presión de la predicha por la ley de los gases ideales. Aquí, (n ^ 2 / V ^ 2 ) representa la concentración del gas ( (n / V )) al cuadrado porque se necesitan dos partículas para participar en las interacciones intermoleculares por pares del tipo que se muestra en la Figura ( Índice de página {4} ). El término de volumen corrige el volumen ocupado por las moléculas gaseosas.
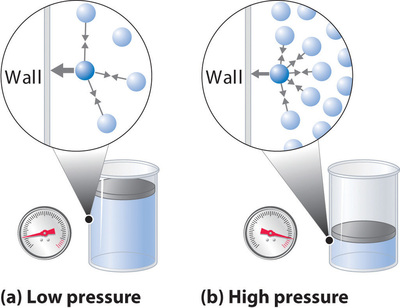
La corrección para el volumen es negativa, pero la corrección para la presión es positiva para reflejar el efecto de cada factor en V y P , respectivamente. Debido a que los volúmenes moleculares distintos de cero producen un volumen medido que es mayor que el predicho por la ley de los gases ideales, debemos restar los volúmenes moleculares para obtener el volumen real disponible. Por el contrario, las fuerzas intermoleculares atractivas producen una presión menor que la esperada según la ley de los gases ideales, por lo que el término (an ^ 2 / V ^ 2 ) debe agregarse a la presión medida para corregir por estos efectos
Licuefacción de gases
La licuefacción de gases es la condensación de gases en forma líquida, que no se anticipa ni explica por la teoría cinética molecular de los gases. Tanto la teoría como la ley de los gases ideales predicen que los gases comprimidos a presiones muy altas y enfriados a temperaturas muy bajas deberían comportarse como gases, aunque fríos y densos. Sin embargo, a medida que los gases se comprimen y enfrían, se condensan invariablemente para formar líquidos, aunque se necesitan temperaturas muy bajas para licuar elementos ligeros como el helio (para He, 4.2 K a una presión de 1 atm).
La licuefacción puede verse como una desviación extrema del comportamiento ideal del gas. Ocurre cuando las moléculas de un gas se enfrían hasta el punto en que ya no poseen suficiente energía cinética para vencer las fuerzas de atracción intermoleculares. La combinación precisa de temperatura y presión necesaria para licuar un gas depende en gran medida de su masa molar y estructura, con moléculas más pesadas y más complejas que generalmente se licúan a temperaturas más altas. En general, las sustancias con coeficientes grandes de van der Waals (a ) son relativamente fáciles de licuar porque los coeficientes grandes a indican interacciones intermoleculares atractivas relativamente fuertes. Por el contrario, las moléculas pequeñas con solo elementos ligeros tienen coeficientes pequeños a , lo que indica interacciones intermoleculares débiles, y son relativamente difíciles de licuar. La licuefacción de gas se usa en una escala masiva para separar O 2 , N 2 , Ar, Ne, Kr y Xe. Después de licuar una muestra de aire, la mezcla se calienta y los gases se separan de acuerdo con sus puntos de ebullición.
Un gran valor de a en la ecuación de van der Waals indica la presencia de interacciones intermoleculares atractivas relativamente fuertes.
Los líquidos ultrafríos formados a partir de la licuefacción de los gases se denominan líquidos criogénicos, del griego kryo , que significa genes “fríos” y , que significa “producir”. Tienen aplicaciones como refrigerantes tanto en la industria como en la biología. Por ejemplo, bajo condiciones cuidadosamente controladas, las temperaturas muy frías que proporcionan los gases licuados como el nitrógeno (punto de ebullición = 77 K a 1 atm) pueden preservar materiales biológicos, como el semen para la inseminación artificial de vacas y otros animales de granja. Estos líquidos también se pueden usar en un tipo especializado de cirugía llamada criocirugía , que destruye selectivamente los tejidos con una pérdida mínima de sangre mediante el uso de frío extremo.

Además, la licuefacción de gases es tremendamente importante en el almacenamiento y envío de combustibles fósiles (Figura ( PageIndex {5} )). El gas natural licuado (GNL) y el gas licuado de petróleo (GLP) son formas licuadas de hidrocarburos producidos a partir de reservas de gas natural o petróleo. El GNL se compone principalmente de metano, con pequeñas cantidades de hidrocarburos más pesados; se prepara enfriando el gas natural por debajo de aproximadamente -162 ° C. Se puede almacenar en contenedores de doble pared, aislados al vacío a presión atmosférica o ligeramente por encima. Debido a que el GNL ocupa solo alrededor de 1/600 del volumen de gas natural, es más fácil y económico de transportar. El GLP es típicamente una mezcla de propano, propeno, butano y butenos y se usa principalmente como combustible para la calefacción del hogar. También se usa como materia prima para plantas químicas y como combustible económico y relativamente no contaminante para algunos automóviles.
Resumen
Ningún gas real exhibe un comportamiento ideal del gas, aunque muchos gases reales se aproximan a él en un rango de condiciones. Las desviaciones del comportamiento ideal del gas se pueden ver en las parcelas de PV / nRT versus P a una temperatura dada; para un gas ideal, PV / nRT versus P = 1 en todas las condiciones. A altas presiones, la mayoría de los gases reales exhiben valores más grandes de PV / nRT que los pronosticados por la ley del gas ideal, mientras que a bajas presiones, la mayoría de los gases reales exhiben PV / nRT valores cercanos a los predichos por la ley de los gases ideales. Los gases se aproximan más al comportamiento ideal del gas a altas temperaturas y bajas presiones. Las desviaciones del comportamiento ideal de la ley de gases pueden describirse mediante la ecuación de van der Waals , que incluye constantes empíricas para corregir el volumen real de las moléculas gaseosas y cuantificar la reducción de la presión debido a las fuerzas de atracción intermoleculares. Si la temperatura de un gas disminuye lo suficiente, se produce licuefacción , en la cual el gas se condensa en forma líquida. Los gases licuados tienen muchas aplicaciones comerciales, incluido el transporte de grandes cantidades de gases en pequeños volúmenes y los usos de líquidos criogénicos ultrafríos .