Las propiedades físicas de una sustancia dependen de su estado físico. El vapor de agua, el agua líquida y el hielo tienen las mismas propiedades químicas , pero sus propiedades físicas son considerablemente diferentes. En general, enlaces covalentes determinan: forma molecular, energías de enlace, propiedades químicas , mientras que fuerzas intermoleculares (enlaces no covalentes) influyen en físico [19459011 ] propiedades de líquidos y sólidos. La teoría cinética molecular de los gases da una descripción razonablemente precisa del comportamiento de los gases. Se puede aplicar un modelo similar a los líquidos, pero debe tener en cuenta los volúmenes de partículas distintos de cero y la presencia de fuertes fuerzas de atracción intermoleculares.

El estado de una sustancia depende del equilibrio entre la energía cinética de las partículas individuales (moléculas o átomos) y las fuerzas intermoleculares . La energía cinética mantiene las moléculas separadas y en movimiento, y es una función de la temperatura de la sustancia. Las fuerzas intermoleculares son fuerzas atractivas que intentan unir las partículas (Figura ( PageIndex {2} )). Como se discutió anteriormente, los gases son muy sensibles a las temperaturas y la presión. Sin embargo, estos también afectan a los líquidos y sólidos también. Calentar y enfriar puede cambiar la energía cinética de las partículas en una sustancia, y así, podemos cambiar el estado físico de una sustancia calentándola o enfriándola. El aumento de la presión sobre una sustancia obliga a las moléculas a estar más juntas, lo que aumenta la fuerza de las fuerzas intermoleculares.
 |
 |
 |
| (a) en estado gaseoso | (b) como un líquido | (c) en forma sólida |
A continuación se muestra una descripción general de las propiedades generales de las tres fases diferentes de la materia.
Propiedades de los gases
- Una colección de moléculas ampliamente separadas
- La energía cinética de las moléculas es mayor que cualquier fuerza de atracción entre las moléculas
- La falta de una fuerza atractiva significativa entre las moléculas permite que un gas se expanda para llenar su contenedor
- Si las fuerzas de atracción se vuelven lo suficientemente grandes, entonces los gases exhiben comportamiento no ideal
Propiedades de los líquidos
- Las fuerzas atractivas intermoleculares son lo suficientemente fuertes como para mantener las moléculas juntas
- Los líquidos son más densos y menos compresibles que los gases
- Los líquidos tienen un volumen definido, independientemente del tamaño y la forma de su recipiente
- Las fuerzas atractivas son no lo suficientemente fuertes, sin embargo, para mantener las moléculas vecinas en una posición fija y las moléculas son libres de moverse o deslizarse unas sobre otras
Por lo tanto, los líquidos se pueden verter y asumir la forma de sus recipientes.
Propiedades de los sólidos
- Las fuerzas intermoleculares entre las moléculas vecinas son lo suficientemente fuertes como para mantenerlas bloqueadas en su posición
- Los sólidos (como los líquidos) no son muy compresibles debido a la falta de espacio entre las moléculas
- Si las moléculas en un sólido adoptan una disposición de empaque altamente ordenada, se dice que las estructuras son cristalinas
Debido a las fuertes fuerzas intermoleculares entre las moléculas vecinas, los sólidos son rígidos.
Propiedades físicas de los líquidos
En un gas, la distancia entre las moléculas, ya sean monoatómicas o poliatómicas, es muy grande en comparación con el tamaño de las moléculas; así, los gases tienen una baja densidad y son altamente compresibles. En contraste, las moléculas en los líquidos están muy juntas, esencialmente sin espacio vacío entre ellas. Sin embargo, como en los gases, las moléculas en los líquidos están en constante movimiento, y su energía cinética (y, por lo tanto, su velocidad) depende de su temperatura. Comenzamos nuestra discusión examinando algunas de las propiedades características de los líquidos para ver cómo cada uno es consistente con una descripción molecular cinética modificada.
Las propiedades de los líquidos pueden explicarse utilizando una versión modificada de la teoría cinética molecular de gases descrita anteriormente. Este modelo explica la mayor densidad, mayor orden y menor compresibilidad de líquidos versus gases; la expansión térmica de líquidos; por qué se difunden; y por qué adoptan la forma (pero no el volumen) de sus contenedores. Una descripción molecular cinética de los líquidos debe tener en cuenta tanto los volúmenes de partículas distintos de cero como la presencia de fuertes fuerzas de atracción intermoleculares. Los sólidos y los líquidos tienen partículas bastante cercanas entre sí, y por eso se denominan “ fases condensadas ” para distinguirlos de los gases
- Densidad : Las moléculas de un líquido se empaquetan relativamente juntas. En consecuencia, los líquidos son mucho más densos que los gases. La densidad de un líquido es típicamente aproximadamente la misma que la densidad del estado sólido de la sustancia. Por lo tanto, las densidades de los líquidos se miden más comúnmente en unidades de gramos por centímetro cúbico (g / cm 3 ) o gramos por mililitro (g / mL) que en gramos por litro (g / L), la unidad comúnmente utilizado para gases.
- Orden molecular: Los líquidos exhiben un orden de corto alcance porque las fuertes fuerzas de atracción intermoleculares hacen que las moléculas se junten con bastante fuerza. Sin embargo, debido a su mayor energía cinética en comparación con las moléculas en un sólido, las moléculas en un líquido se mueven rápidamente una con respecto a la otra. Así, a diferencia de los iones en los sólidos iónicos, las moléculas en los líquidos no están dispuestas en una matriz tridimensional repetitiva. Sin embargo, a diferencia de las moléculas en los gases, la disposición de las moléculas en un líquido no es completamente aleatoria.
- Compresibilidad : Los líquidos tienen tan poco espacio vacío entre sus moléculas componentes que no se pueden comprimir fácilmente. La compresión obligaría a los átomos de las moléculas adyacentes a ocupar la misma región del espacio.
- Expansión térmica : Las fuerzas intermoleculares en los líquidos son lo suficientemente fuertes como para evitar que se expandan significativamente cuando se calientan (generalmente solo un pequeño porcentaje en un rango de temperatura de 100 ° C). Así, los volúmenes de líquidos son algo fijos. Observe en Tabla S1 (con una versión abreviada en la Tabla ( PageIndex {1} )) que la densidad del agua, por ejemplo, cambia solo un 3% en un rango de temperatura de 90 grados.
| T (° C) | Densidad (g / cm 3 ) |
|---|---|
| 0 | 0.99984 |
| 30 | 0,99565 |
| 60 | 0,98320 |
| 90 | 0,96535 |
-
Difusión : Las moléculas en líquidos se difunden porque están en constante movimiento. Sin embargo, una molécula en un líquido no puede moverse mucho antes de chocar con otra molécula, por lo que el camino libre medio en los líquidos es muy corto y la velocidad de difusión es mucho más lenta que en los gases.
-
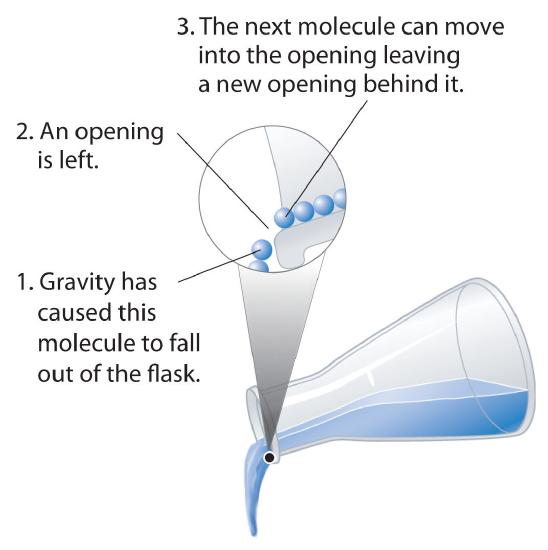
Fluidez : Los líquidos pueden fluir, ajustándose a la forma de sus recipientes, porque sus moléculas pueden moverse libremente. Esta libertad de movimiento y su espacio cercano permiten que las moléculas en un líquido se muevan rápidamente hacia las aberturas dejadas por otras moléculas, generando a su vez más aberturas, y así sucesivamente (Figura ( PageIndex {3} )).
Colaboradores
-
Mike Blaber ( Florida State University )