Aunque se le han presentado algunas de las interacciones que mantienen a las moléculas juntas en un líquido, aún no hemos discutido las consecuencias de esas interacciones para las propiedades de los líquidos. Ahora dirigimos nuestra atención a tres propiedades únicas de los líquidos que dependen íntimamente de la naturaleza de las interacciones intermoleculares:
- tensión superficial,
- acción capilar, y
- viscosidad.
Tensión superficial
Si los líquidos tienden a adoptar las formas de sus recipientes, ¿pequeñas cantidades de agua en un automóvil recién encerado forman gotas elevadas en lugar de una película delgada y continua? La respuesta se encuentra en una propiedad llamada tensión superficial , que depende de las fuerzas intermoleculares. La tensión superficial es la energía requerida para aumentar el área de superficie de un líquido en una cantidad unitaria y varía mucho de líquido a líquido según la naturaleza de las fuerzas intermoleculares, por ejemplo, el agua con enlaces de hidrógeno tiene una tensión superficial de 7,29 x 10 [19459017 ] -2 J / m 2 (a 20 ° C), mientras que el mercurio con enlaces metálicos tiene una tensión superficial 15 veces mayor: 4.86 x 10 -1 J / m 2 (a 20 ° C).
La Figura ( PageIndex {1} ) presenta una vista microscópica de una gota de líquido. Una molécula típica en el interior de la gota está rodeada por otras moléculas que ejercen fuerzas atractivas desde todas las direcciones. En consecuencia, no hay una fuerza neta sobre la molécula que pueda hacer que se mueva en una dirección particular. Por el contrario, una molécula en la superficie experimenta una atracción neta hacia la caída porque no hay moléculas en el exterior para equilibrar las fuerzas ejercidas por las moléculas adyacentes en el interior. Debido a que una esfera tiene el área de superficie más pequeña posible para un volumen dado, las interacciones intermoleculares atractivas entre las moléculas de agua hacen que la gotita adopte una forma esférica. Esto maximiza el número de interacciones atractivas y minimiza el número de moléculas de agua en la superficie. Por lo tanto, las gotas de lluvia son casi esféricas, y las gotas de agua sobre una superficie encerada (no polar), que no interactúa fuertemente con el agua, forman cuentas redondas. Un automóvil sucio está cubierto con una mezcla de sustancias, algunas de las cuales son polares. Las interacciones atractivas entre las sustancias polares y el agua hacen que el agua se extienda en una película delgada en lugar de formar cuentas.
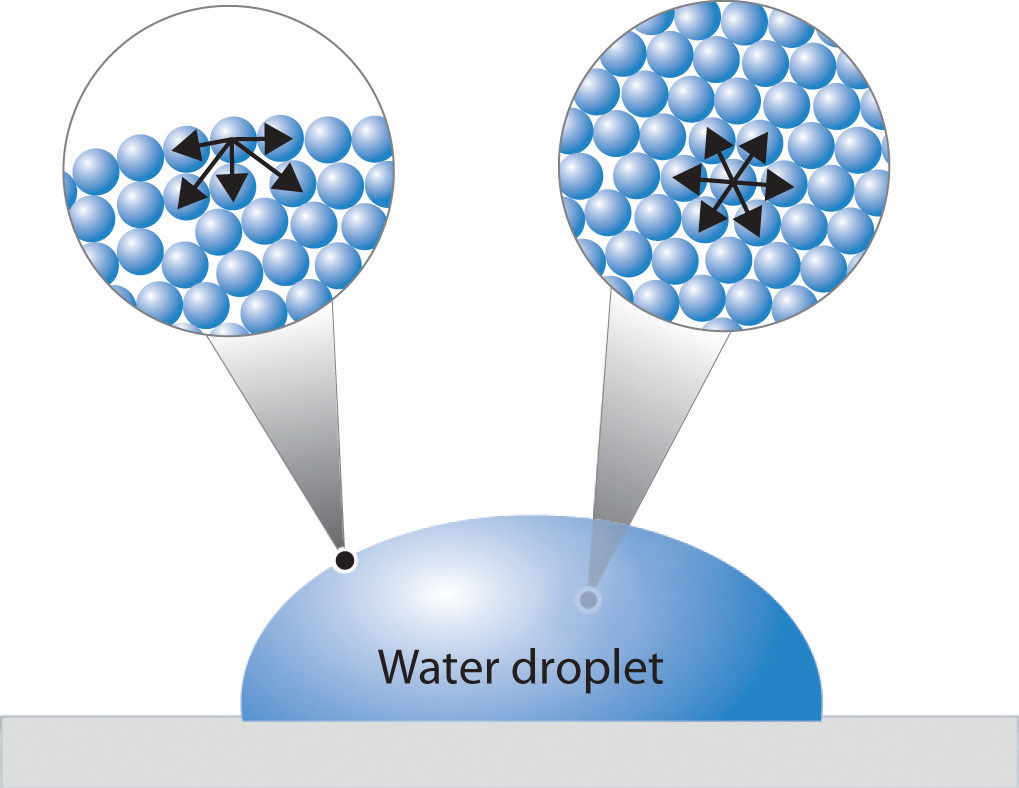
El mismo fenómeno mantiene las moléculas juntas en la superficie de una muestra de agua a granel, casi como si formaran una piel. Cuando se llena un vaso con agua, el vaso se puede llenar en exceso para que el nivel del líquido se extienda por encima del borde. De manera similar, se puede colocar una aguja de coser o un clip de papel en la superficie de un vaso de agua donde “flota”, aunque el acero es mucho más denso que el agua. Muchos insectos aprovechan esta propiedad para caminar sobre la superficie de charcos o estanques sin hundirse. ¡Esto es incluso observable en las condiciones de gravedad cero del espacio como se muestra en la Figura ( PageIndex {2} ) (y más en el enlace de video) donde el agua escurrida de una toalla húmeda continúa flotando a lo largo de la superficie de la toalla!
Tales fenómenos son manifestaciones de tensión superficial , que se define como la energía requerida para aumentar el área superficial de un líquido en una cantidad específica. Por lo tanto, la tensión superficial se mide como energía por unidad de área, como julios por metro cuadrado (J / m 2 ) o dina por centímetro (dyn / cm), donde 1 dyn = 1 × 10 – 5 N. Los valores de la tensión superficial de algunos líquidos representativos se enumeran en la Tabla ( PageIndex {1} ). Observe la correlación entre la tensión superficial de un líquido y la fuerza de las fuerzas intermoleculares: cuanto más fuertes son las fuerzas intermoleculares, mayor es la tensión superficial. Por ejemplo, el agua, con su fuerte enlace de hidrógeno intermolecular, tiene uno de los valores más altos de tensión superficial de cualquier líquido, mientras que las moléculas orgánicas de bajo punto de ebullición, que tienen fuerzas intermoleculares relativamente débiles, tienen tensiones superficiales mucho más bajas. El mercurio es una anomalía aparente, pero su tensión superficial muy alta se debe a la presencia de fuertes enlaces metálicos.
| Sustancia | Tensión superficial (× 10 −3 J / m 2 ) | Viscosidad (mPa • s) | Presión de vapor (mmHg) | Punto de ebullición normal (° C) |
|---|---|---|---|---|
| Compuestos orgánicos | ||||
| éter dietílico | 17 | 0,22 | 531 | 34,6 |
| n -hexano | 18 | 0,30 | 149 | 68,7 |
| acetona | 23 | 0,31 | 227 | 56,5 |
| etanol | 22 | 1,07 | 59 | 78,3 |
| etilenglicol | 48 | 16,1 | ~ 0,08 | 198,9 |
| Elementos líquidos | ||||
| bromo | 41 | 0,94 | 218 | 58.8 |
| mercurio | 486 | 1,53 | 0,0020 | 357 |
| Agua | ||||
| 0 ° C | 75,6 | 1.79 | 4,6 | – |
| 20 ° C | 72,8 | 1,00 | 17,5 | – |
| 60 ° C | 66,2 | 0,47 | 149 | – |
| 100 ° C | 58,9 | 0,28 | 760 | – |
Agregar jabones y detergentes que interrumpan las atracciones intermoleculares entre las moléculas de agua adyacentes puede reducir la tensión superficial del agua. Debido a que afectan las propiedades superficiales de un líquido, los jabones y detergentes se denominan agentes tensioactivos, o tensioactivos . En la década de 1960, los investigadores de la Marina de los EE. UU. Desarrollaron un método para combatir incendios a bordo de portaaviones utilizando “espumas”, que son soluciones acuosas de surfactantes fluorados. Los tensioactivos reducen la tensión superficial del agua por debajo de la del combustible, por lo que la solución fluorada puede extenderse a través de la superficie en llamas y extinguir el fuego. Tales espumas ahora se usan universalmente para combatir incendios a gran escala de líquidos orgánicos.
Acción capilar
Las fuerzas intermoleculares también causan un fenómeno llamado acción capilar , que es la tendencia de un líquido polar a elevarse contra la gravedad en un tubo de diámetro pequeño (un capilar ), como se muestra en la Figura ( PageIndex {3} ). Cuando se coloca un capilar de vidrio en agua líquida, el agua sube al capilar. La altura a la que se eleva el agua depende del diámetro del tubo y la temperatura del agua, pero no del ángulo en el que el tubo ingresa al agua. Cuanto más pequeño es el diámetro, más alto sube el líquido.

La acción capilar es el resultado neto de dos conjuntos opuestos de fuerzas: fuerzas cohesivas , que son las fuerzas intermoleculares que mantienen unido un líquido, y fuerzas adhesivas , que son atractivas fuerzas entre un líquido y la sustancia que compone el capilar. El agua tiene una fuerte adhesión al vidrio, que contiene grupos polares de SiOH, y una fuerte cohesión intermolecular. Cuando se coloca un capilar de vidrio en agua, la tensión superficial debido a las fuerzas cohesivas constriñe el área superficial del agua dentro del tubo, mientras que la adhesión entre el agua y el vidrio crea una fuerza ascendente que maximiza la cantidad de superficie de vidrio en contacto con el agua. . Si las fuerzas adhesivas son más fuertes que las fuerzas cohesivas, como es el caso del agua, entonces el líquido en el capilar se eleva al nivel donde la fuerza de gravedad hacia abajo equilibra exactamente esta fuerza hacia arriba. Sin embargo, si las fuerzas cohesivas son más fuertes que las fuerzas adhesivas, como es el caso del mercurio y el vidrio, el líquido se arrastra hacia el capilar debajo de la superficie del líquido a granel para minimizar el contacto con el vidrio (Figura ( PageIndex {4} )). La superficie superior de un líquido en un tubo se llama menisco , y la forma del menisco depende de las fuerzas relativas de las fuerzas cohesivas y adhesivas. En líquidos como el agua, el menisco es cóncavo; sin embargo, en líquidos como el mercurio, que tienen fuerzas cohesivas muy fuertes y una adhesión débil al vidrio, el menisco es convexo (Figura ( PageIndex {4} )).

Los fluidos y nutrientes son transportados por los tallos de las plantas o los troncos de los árboles por acción capilar. Las plantas contienen pequeños tubos rígidos compuestos de celulosa, a los cuales el agua tiene una fuerte adhesión. Debido a las fuertes fuerzas adhesivas, los nutrientes pueden ser transportados desde las raíces hasta las copas de los árboles que tienen más de 50 m de altura. Las toallas de algodón también están hechas de celulosa; absorben agua porque los pequeños tubos actúan como capilares y “absorben” el agua de la piel. Toda la tela absorbe la humedad, no solo la capa en contacto con su cuerpo.
Viscosidad
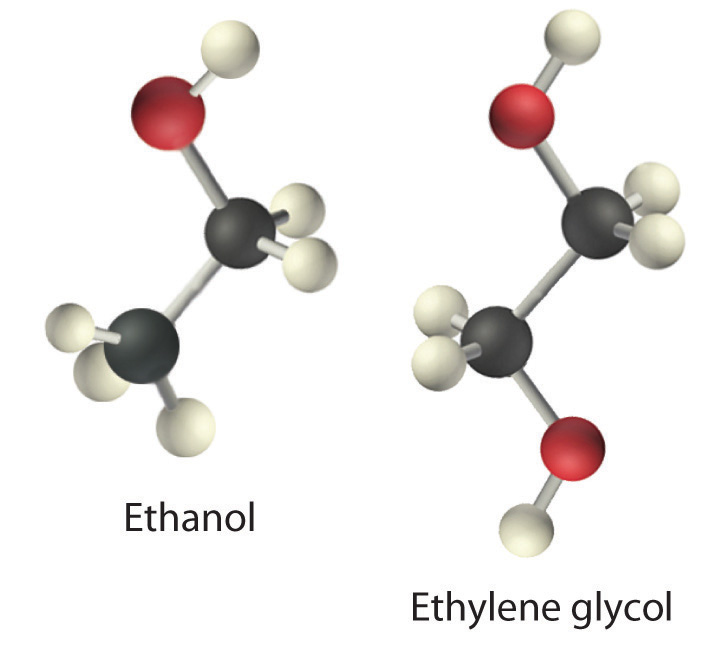
La viscosidad (η) es la resistencia de un líquido a fluir. Algunos líquidos, como la gasolina, el etanol y el agua, fluyen muy fácilmente y, por lo tanto, tienen una baja viscosidad . Otros, como el aceite de motor, la melaza y el jarabe de arce, fluyen muy lentamente y tienen una alta viscosidad . Los dos métodos más comunes para evaluar la viscosidad de un líquido son (1) medir el tiempo que tarda una cantidad de líquido en fluir a través de un tubo vertical estrecho y (2) medir el tiempo que tardan las bolas de acero en caer a través de un volumen dado del líquido. Cuanto mayor es la viscosidad, más lento fluye el líquido a través del tubo y caen las bolas de acero. La viscosidad se expresa en unidades de equilibrio (mPa • s); cuanto mayor es el número, mayor es la viscosidad. Las viscosidades de algunos líquidos representativos se enumeran en la Tabla 11.3.1 y muestran una correlación entre la viscosidad y las fuerzas intermoleculares. Debido a que un líquido puede fluir solo si las moléculas pueden pasar entre sí con una resistencia mínima, las fuertes fuerzas de atracción intermoleculares hacen que sea más difícil que las moléculas se muevan unas con respecto a otras. La adición de un segundo grupo hidroxilo al etanol, por ejemplo, que produce etilenglicol (HOCH 2 CH 2 OH), aumenta la viscosidad 15 veces. Este efecto se debe al mayor número de enlaces de hidrógeno que se pueden formar entre los grupos hidroxilo en las moléculas adyacentes, lo que resulta en fuerzas de atracción intermoleculares dramáticamente más fuertes.
También existe una correlación entre la viscosidad y la forma molecular. Los líquidos que consisten en moléculas largas y flexibles tienden a tener viscosidades más altas que los compuestos de moléculas más esféricas o de cadena más corta. Cuanto más largas sean las moléculas, más fácil será para ellos “enredarse” unas con otras, lo que les dificultará que se muevan unas a otras. Las fuerzas de dispersión de Londres también aumentan con la longitud de la cadena. Debido a una combinación de estos dos efectos, los hidrocarburos de cadena larga (como los aceites de motor) son altamente viscosos.
La viscosidad aumenta a medida que aumentan las interacciones intermoleculares o el tamaño molecular.
Resumen
La tensión superficial, la acción capilar y la viscosidad son propiedades únicas de los líquidos que dependen de la naturaleza de las interacciones intermoleculares. La tensión superficial es la energía requerida para aumentar el área superficial de un líquido en una cantidad dada. Cuanto más fuertes son las interacciones intermoleculares, mayor es la tensión superficial. Los tensioactivos son moléculas, como jabones y detergentes, que reducen la tensión superficial de los líquidos polares como el agua. La acción capilar es el fenómeno en el que los líquidos se elevan en un tubo estrecho llamado capilar. Resulta cuando fuerzas cohesivas , las fuerzas intermoleculares en el líquido, son más débiles que fuerzas adhesivas , la atracción entre un líquido y la superficie del capilar. La forma del menisco , la superficie superior de un líquido en un tubo, también refleja el equilibrio entre las fuerzas adhesivas y cohesivas. La viscosidad de un líquido es su resistencia al flujo. Los líquidos que tienen fuertes fuerzas intermoleculares tienden a tener altas viscosidades.