Aprovechamos los cambios entre los estados de gas, líquido y sólido para enfriar una bebida con cubitos de hielo (sólido a líquido), enfriar nuestros cuerpos mediante la transpiración (líquido a gas) y enfriar los alimentos dentro de un refrigerador (gas a líquido y viceversa). Utilizamos hielo seco, que es CO sólido 2 , como refrigerante (sólido a gas), y hacemos nieve artificial para esquiar y hacer snowboard transformando un líquido en un sólido. En esta sección, examinamos lo que sucede cuando cualquiera de las tres formas de materia se convierte en cualquiera de las otras dos. Estos cambios de estado a menudo se denominan cambios de fase . Los seis cambios de fase más comunes se muestran en la Figura ( PageIndex {1} ).
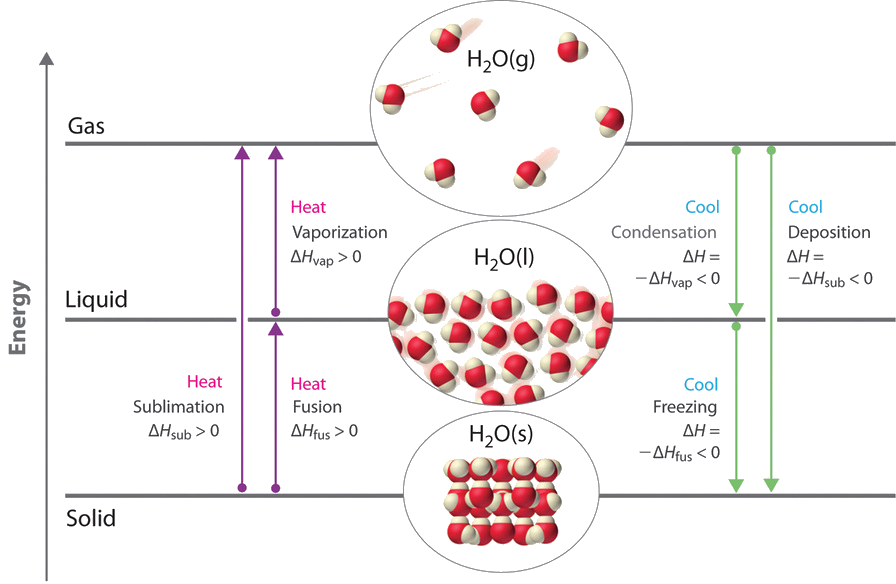
Cambios de energía que acompañan a los cambios de fase
Los cambios de fase son siempre acompañados por un cambio en la energía de un sistema. Por ejemplo, convertir un líquido, en el que las moléculas están muy juntas, en un gas, en el que las moléculas están, en promedio, muy separadas, requiere un aporte de energía (calor) para dar a las moléculas suficiente energía cinética para permitirles superar las fuerzas intermoleculares de atracción. Cuanto más fuertes son las fuerzas atractivas, más energía se necesita para vencerlas. Los sólidos, que están altamente ordenados, tienen las interacciones intermoleculares más fuertes, mientras que los gases, que están muy desordenados, tienen los más débiles. Por lo tanto, cualquier transición de un estado más ordenado a un estado menos ordenado (sólido a líquido, líquido a gas o sólido a gas) requiere un aporte de energía; es endotérmico . Por el contrario, cualquier transición de un estado menos ordenado a un estado más ordenado (líquido a sólido, gas a líquido o gas a sólido) libera energía; es exotérmico . El cambio de energía asociado con cada cambio de fase común se muestra en la Figura ( PageIndex {1} ).
Δ H es positivo para cualquier transición de un estado más ordenado a un estado menos ordenado y negativo para una transición de un estado menos ordenado a un estado más ordenado.
Anteriormente, definimos los cambios de entalpía asociados con varios procesos químicos y físicos. Los puntos de fusión y las entalpías de fusión molar ( (ΔH_ {fus} )), la energía requerida para convertir de un sólido a un líquido, un proceso conocido como fusión (o fusión) [ 19459013], así como los puntos de ebullición normales y las entalpías de vaporización ( (ΔH_ {vap} )) de los compuestos seleccionados se enumeran en la Tabla ( PageIndex {1} ).
| Sustancia | Punto de fusión (° C) | ΔH fus (kJ / mol) | Punto de ebullición (° C) | ΔH vap (kJ / mol) |
|---|---|---|---|---|
| N 2 | −210,0 | 0,71 | −195,8 | 5,6 |
| HCl | −114,2 | 2,00 | −85,1 | 16,2 |
| Br 2 | −7,2 | 10,6 | 58.8 | 30,0 |
| CCl 4 | −22,6 | 2,56 | 76,8 | 29,8 |
| CH 3 CH 2 OH (etanol) | −114,1 | 4,93 | 78,3 | 38,6 |
| CH 3 (CH 2 ) 4 CH 3 ( n -hexano) | −95,4 | 13,1 | 68,7 | 28,9 |
| H 2 O | 0 | 6,01 | 100 | 40,7 |
| Na | 97,8 | 2,6 | 883 | 97,4 |
| NaF | 996 | 33,4 | 1704 | 176,1 |
Las sustancias con los puntos de fusión más altos generalmente tienen las entalpías de fusión más altas; tienden a ser compuestos iónicos que se mantienen unidos por interacciones electrostáticas muy fuertes. Las sustancias con altos puntos de ebullición son aquellas con fuertes interacciones intermoleculares que deben superarse para convertir un líquido en un gas, lo que resulta en altas entalpías de vaporización. La entalpía de vaporización de una sustancia dada es mucho mayor que su entalpía de fusión porque se necesita más energía para separar por completo las moléculas (conversión de un líquido a un gas) que permitir que se muevan libremente entre sí (conversión de un sólido a un líquido).
Se necesita menos energía para permitir que las moléculas se muevan entre sí que para separarlas por completo.
La conversión directa de un sólido en un gas, sin una fase líquida intermedia, se llama sublimación . La cantidad de energía requerida para sublimar 1 mol de un sólido puro es la entalpía de sublimación (Δ H sub ) . Las sustancias comunes que subliman a temperatura y presión estándar (STP; 0 ° C, 1 atm) incluyen CO 2 (hielo seco); yodo (Figura ( PageIndex {2} )); naftaleno, una sustancia utilizada para proteger la ropa de lana contra las polillas; y 1,4-diclorobenceno. Como se muestra en la Figura ( PageIndex {1} ), la entalpía de sublimación de una sustancia es la suma de sus entalpías de fusión y vaporización siempre que todos los valores sean iguales T ; esta es una aplicación de la ley de Hess .
[ΔH_ {sub} = ΔH_ {fus} + ΔH_ {vap} label {Eq1} ]
La fusión, la vaporización y la sublimación son procesos endotérmicos; ocurren solo con la absorción de calor. Cualquiera que haya salido de una piscina en un día fresco y ventoso ha sentido la pérdida de calor que acompaña a la evaporación del agua de la piel. Nuestros cuerpos usan este mismo fenómeno para mantener una temperatura constante: transpiramos continuamente, incluso en reposo, perdiendo aproximadamente 600 ml de agua diariamente por evaporación de la piel. También perdemos alrededor de 400 ml de agua como vapor de agua en el aire que exhalamos, lo que también contribuye al enfriamiento. Los refrigeradores y acondicionadores de aire funcionan con un principio similar: el calor se absorbe del objeto o área a enfriar y se usa para vaporizar un líquido de bajo punto de ebullición, como el amoníaco o los clorofluorocarbonos (CFC) y Los hidrofluorocarbonos (HCFC). El vapor se transporta a una ubicación diferente y se comprime, liberando y disipando el calor. Del mismo modo, los cubitos de hielo enfrían eficientemente una bebida no por su baja temperatura sino porque se requiere calor para convertir el hielo a 0 ° C en agua líquida a 0 ° C.
Curvas de temperatura
Los procesos en el lado derecho de la Figura ( PageIndex {1} ) – congelación, condensación y deposición, que son el reverso de la fusión, sublimación y vaporización – son exotérmicos. Por lo tanto, las bombas de calor que usan refrigerantes son esencialmente acondicionadores de aire que funcionan en reversa. El calor del medio ambiente se utiliza para vaporizar el refrigerante, que luego se condensa en un líquido en bobinas dentro de una casa para proporcionar calor. Los cambios de energía que ocurren durante los cambios de fase se pueden cuantificar usando una curva de calentamiento o enfriamiento.
Curvas de calentamiento
La Figura ( PageIndex {3} ) muestra una curva de calentamiento , un gráfico de temperatura versus tiempo de calentamiento, para una muestra de agua de 75 g. La muestra es inicialmente hielo a 1 atm y -23 ° C; A medida que se agrega calor, la temperatura del hielo aumenta linealmente con el tiempo. La pendiente de la línea depende tanto de la masa del hielo como del calor específico ( C s ) de hielo, que es la cantidad de julios necesarios para elevar la temperatura de 1 g de hielo en 1 ° C. A medida que aumenta la temperatura del hielo, las moléculas de agua en el cristal de hielo absorben cada vez más energía y vibran más vigorosamente. En el punto de fusión, tienen suficiente energía cinética para superar fuerzas atractivas y moverse entre sí. A medida que se agrega más calor, la temperatura del sistema no aumenta aún más, pero permanece constante a 0 ° C hasta que todo el hielo se haya derretido. Una vez que todo el hielo se ha convertido en agua líquida, la temperatura del agua nuevamente comienza a aumentar. Ahora, sin embargo, la temperatura aumenta más lentamente que antes porque la capacidad calorífica específica del agua es mayor que la del hielo. Cuando la temperatura del agua alcanza los 100 ° C, el agua comienza a hervir. Aquí también, la temperatura permanece constante a 100 ° C hasta que toda el agua se haya convertido en vapor. En este punto, la temperatura nuevamente comienza a aumentar, pero a una velocidad más rápida que la observada en las otras fases porque la capacidad de calor del vapor es menor que la del hielo o el agua.
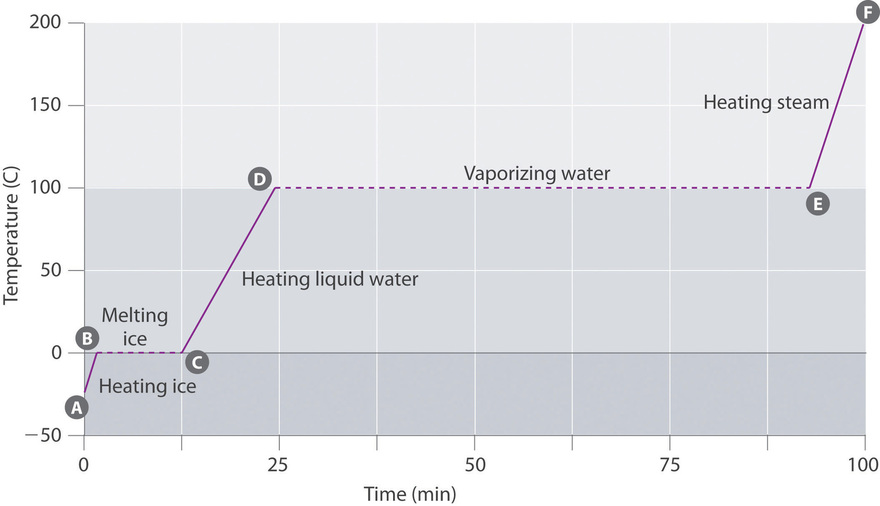
Así la temperatura de un sistema no cambia durante un cambio de fase . En este ejemplo, mientras exista una pequeña cantidad de hielo, la temperatura del sistema permanece a 0 ° C durante el proceso de fusión, y mientras exista una pequeña cantidad de agua líquida, la temperatura del sistema permanece a 100 ° C durante el proceso de ebullición. La velocidad a la que se agrega calor no afecta la temperatura de la mezcla de hielo / agua o agua / vapor porque el calor agregado se usa exclusivamente para superar las fuerzas atractivas que mantienen unida la fase más condensada. Muchos cocineros piensan que los alimentos se cocinarán más rápido si el calor aumenta más, de modo que el agua hierva más rápidamente. En cambio, la olla de agua hervirá a sequedad antes, pero la temperatura del agua no depende de cuán vigorosamente hierva.
La temperatura de una muestra no cambia durante un cambio de fase.
Si se agrega calor a una velocidad constante, como en la Figura ( PageIndex {3} ), entonces la longitud de las líneas horizontales, que representa el tiempo durante el cual la temperatura no cambia, es directamente proporcional a la magnitud de las entalpías asociadas con los cambios de fase. En la Figura ( PageIndex {3} ), la línea horizontal a 100 ° C es mucho más larga que la línea a 0 ° C porque la entalpía de vaporización del agua es varias veces mayor que la entalpía de fusión.
Un líquido sobrecalentado es una muestra de un líquido a la temperatura y presión a la que debería ser un gas. Los líquidos sobrecalentados no son estables; el líquido eventualmente hervirá, a veces violentamente. El fenómeno del sobrecalentamiento provoca “golpes” cuando un líquido se calienta en el laboratorio. Cuando un tubo de ensayo que contiene agua se calienta sobre un mechero Bunsen, por ejemplo, una porción del líquido puede calentarse fácilmente. Cuando el líquido sobrecalentado se convierte en gas, puede empujar o “golpear” el resto del líquido fuera del tubo de ensayo. Al colocar una varilla de agitación o una pequeña pieza de cerámica (un “chip de ebullición”) en el tubo de ensayo, se forman burbujas de vapor en la superficie del objeto para que el líquido hierva en lugar de sobrecalentarse. El sobrecalentamiento es la razón por la cual un líquido calentado en una taza lisa en un horno microondas no puede hervir hasta que la taza se mueva, cuando el movimiento de la taza permite que se formen burbujas.
Curvas de enfriamiento
La curva de enfriamiento , un gráfico de temperatura versus tiempo de enfriamiento, en la Figura ( PageIndex {4} ) representa la temperatura versus el tiempo como una muestra de 75 g de vapor, inicialmente a 1 atm y 200 ° C, se enfría. Aunque podríamos esperar que la curva de enfriamiento sea la imagen especular de la curva de calentamiento en la Figura ( PageIndex {3} ), la curva de enfriamiento es no una imagen especular idéntica. A medida que se elimina el calor del vapor, la temperatura cae hasta que alcanza los 100 ° C. A esta temperatura, el vapor comienza a condensarse en agua líquida. No se producen más cambios de temperatura hasta que todo el vapor se convierte en líquido; entonces la temperatura vuelve a disminuir a medida que se enfría el agua. Podríamos esperar alcanzar otra meseta a 0 ° C, donde el agua se convierte en hielo; en realidad, sin embargo, esto no siempre ocurre. En cambio, la temperatura a menudo cae por debajo del punto de congelación durante algún tiempo, como lo muestra la pequeña inmersión en la curva de enfriamiento por debajo de 0 ° C. Esta región corresponde a una forma inestable del líquido, un líquido sobreenfriado . Si se deja reposar el líquido, si se continúa el enfriamiento, o si se agrega un pequeño cristal de la fase sólida (un cristal de semilla ), el líquido sobreenfriado se convertirá en un sólido, a veces de manera bastante repentina. A medida que el agua se congela, la temperatura aumenta ligeramente debido al calor generado durante el proceso de congelación y luego se mantiene constante en el punto de fusión a medida que el resto del agua se congela. Posteriormente, la temperatura del hielo disminuye nuevamente a medida que se elimina más calor del sistema.
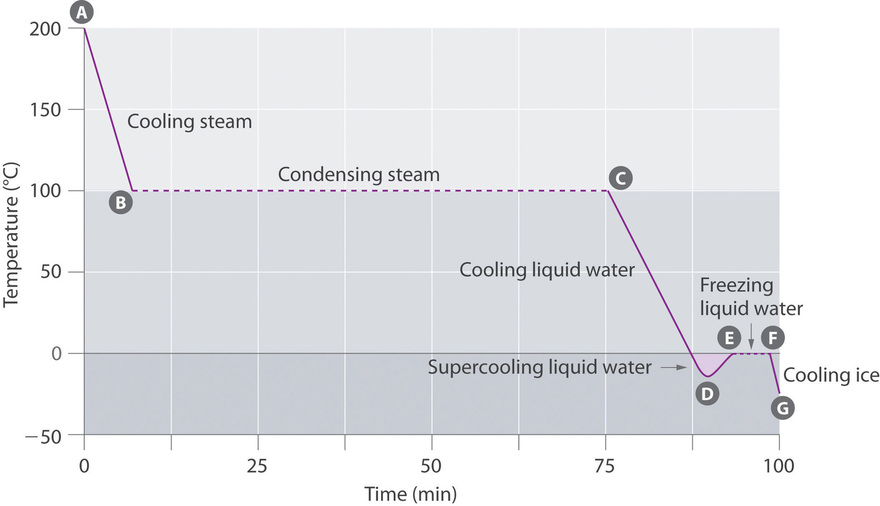
Los efectos de sobreenfriamiento tienen un gran impacto en el clima de la Tierra. Por ejemplo, el sobreenfriamiento de las gotas de agua en las nubes puede evitar que las nubes liberen precipitación sobre regiones que son persistentemente áridas como resultado. Las nubes consisten en pequeñas gotas de agua, que en principio deberían ser lo suficientemente densas como para caer como lluvia. De hecho, sin embargo, las gotas deben agregarse para alcanzar un cierto tamaño antes de que puedan caer al suelo. Por lo general, se requiere una pequeña partícula (un núcleo ) para que las gotas se agreguen; el núcleo puede ser una partícula de polvo, un cristal de hielo o una partícula de yoduro de plata dispersada en una nube durante la siembra (un método para inducir la lluvia). Desafortunadamente, las pequeñas gotas de agua generalmente permanecen como un líquido sobreenfriado hasta aproximadamente -10 ° C, en lugar de congelarse en cristales de hielo que son núcleos más adecuados para la formación de gotas de lluvia. Un enfoque para producir lluvia a partir de una nube existente es enfriar las gotas de agua para que se cristalicen para proporcionar núcleos alrededor de los cuales puedan crecer las gotas de lluvia. Esto se hace mejor dispersando pequeños gránulos de CO 2 (hielo seco) en la nube desde un avión. El CO 2 sólido se sublima directamente al gas a presiones de 1 atm o inferiores, y la entalpía de la sublimación es sustancial (25.3 kJ / mol). A medida que el CO 2 sublima, absorbe el calor de la nube, a menudo con los resultados deseados.
Resumen
La fusión, la vaporización y la sublimación son procesos endotérmicos, mientras que la congelación, la condensación y la deposición son procesos exotérmicos. Los cambios de estado son ejemplos de cambios de fase o transiciones de fase . Todos los cambios de fase van acompañados de cambios en la energía de un sistema. Los cambios de un estado más ordenado a un estado menos ordenado (como un líquido a un gas) son endotérmicos . Los cambios de un estado menos ordenado a un estado más ordenado (como un líquido a un sólido) son siempre exotérmicos . La conversión de un sólido en un líquido se llama fusión (o fusión) . La energía requerida para derretir 1 mol de una sustancia es su entalpía de fusión (Δ H fus ). El cambio de energía requerido para vaporizar 1 mol de una sustancia es la entalpía de vaporización (Δ H vap ). La conversión directa de un sólido en un gas es la sublimación . La cantidad de energía necesaria para sublimar 1 mol de una sustancia es su entalpía de sublimación (Δ H sub ) y es la suma de las entalpías de fusión y vaporización. Los gráficos de la temperatura de una sustancia frente al calor agregado o frente al tiempo de calentamiento a una velocidad constante de calentamiento se denominan curvas de calentamiento . Las curvas de calentamiento relacionan los cambios de temperatura con las transiciones de fase. Un líquido sobrecalentado , un líquido a una temperatura y presión a la que debería ser un gas, no es estable. Una curva de enfriamiento no es exactamente el reverso de la curva de calentamiento porque muchos líquidos no se congelan a la temperatura esperada. En cambio, forman un líquido sobreenfriado , una fase líquida metaestable que existe por debajo del punto de fusión normal. Los líquidos sobreenfriados generalmente se cristalizan al reposar, o al agregar un cristal semilla de la misma u otra sustancia puede inducir la cristalización.