El estado exhibido por una muestra dada de materia depende de la identidad, temperatura y presión de la muestra. Un diagrama de fase es un resumen gráfico del estado físico de una sustancia en función de la temperatura y la presión en un sistema cerrado.
Introducción
Un diagrama de fase típico consiste en regiones discretas que representan las diferentes fases exhibidas por una sustancia (Figura ( PageIndex {1} )). Cada región corresponde al rango de combinaciones de temperatura y presión sobre las cuales esa fase es estable. La combinación de alta presión y baja temperatura (arriba a la izquierda de la Figura ( PageIndex {1} )) corresponde a la fase sólida, mientras que la fase gaseosa se ve favorecida a alta temperatura y baja presión (abajo a la derecha). La combinación de alta temperatura y alta presión (arriba a la derecha) corresponde a un fluido supercrítico.
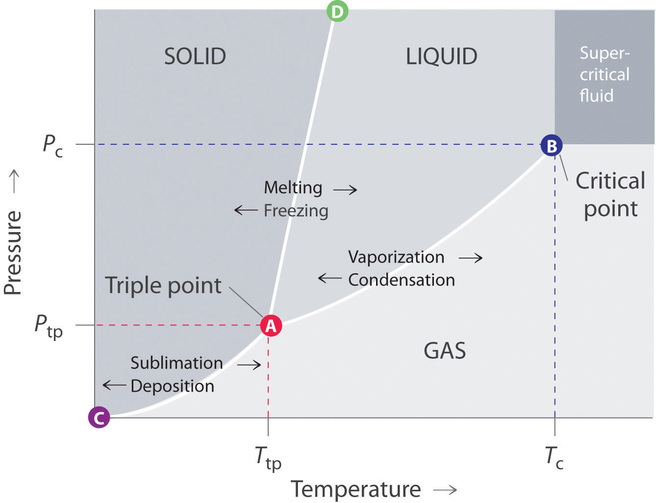
Las líneas en un diagrama de fase corresponden a las combinaciones de temperatura y presión a las que dos fases pueden coexistir en equilibrio. En la Figura ( PageIndex {1} ), la línea que conecta los puntos A y D separa las fases sólida y líquida y muestra cómo el punto de fusión de un sólido varía con la presión. Las fases sólida y líquida están en equilibrio a lo largo de esta línea; cruzar la línea horizontalmente corresponde a derretirse o congelarse. La línea que conecta los puntos A y B es la curva de presión de vapor del líquido, que discutimos en Sección 11.5 . Termina en el punto crítico, más allá del cual la sustancia existe como un fluido supercrítico. La línea que conecta los puntos A y C es la curva de presión de vapor de la fase sólida . En esta línea, el sólido está en equilibrio con la fase de vapor mediante sublimación y deposición. Finalmente, el punto A, donde se cruzan las líneas sólido / líquido, líquido / gas y sólido / gas, es el punto triple ; es la única combinación de temperatura y presión a la que las tres fases (sólido, líquido y gaseoso) están en equilibrio y, por lo tanto, pueden existir simultáneamente. Como no pueden coexistir más de tres fases, un diagrama de fase nunca puede tener más de tres líneas que se crucen en un solo punto.
Recuerde que un diagrama de fases, como el de la Figura ( PageIndex {1} ), es para una sola sustancia pura en un sistema cerrado, no para un líquido en un vaso abierto en contacto con el aire a 1 presión atm. En la práctica, sin embargo, las conclusiones alcanzadas sobre el comportamiento de una sustancia en un sistema cerrado generalmente se pueden extrapolar a un sistema abierto sin un gran error.
El diagrama de fase del agua
La Figura ( PageIndex {2} ) muestra el diagrama de fase del agua e ilustra que el punto triple del agua ocurre a 0.01 ° C y 0.00604 atm (4.59 mmHg). Mucho más reproducible que el punto de fusión del hielo, que depende de la cantidad de aire disuelto y la presión atmosférica, el punto triple (273.16 K) se utiliza para definir la escala de temperatura absoluta (Kelvin). El punto triple también representa la presión más baja a la que puede existir una fase líquida en equilibrio con el sólido o el vapor. Por lo tanto, a presiones inferiores a 0.00604 atm, el hielo no se derrite en un líquido a medida que aumenta la temperatura; el sólido se sublima directamente al vapor de agua. La sublimación de agua a baja temperatura y presión se puede utilizar para “liofilizar” alimentos y bebidas. La comida o bebida se enfría primero a temperaturas bajo cero y se coloca en un recipiente en el que la presión se mantiene por debajo de 0,00604 atm. Luego, a medida que aumenta la temperatura, el agua se sublima, dejando la comida deshidratada (como la utilizada por mochileros o astronautas) o la bebida en polvo (como con el café liofilizado).

El diagrama de fase para el agua ilustrado en la Figura ( PageIndex {2b} ) muestra el límite entre el hielo y el agua en una escala expandida. La curva de fusión del hielo se inclina hacia arriba y ligeramente hacia la izquierda en lugar de hacia arriba y hacia la derecha como en la Figura ( PageIndex {1} ); es decir, el punto de fusión del hielo disminuye al aumentar la presión; a 100 MPa (987 atm), el hielo se derrite a −9 ° C. El agua se comporta de esta manera porque es una de las pocas sustancias conocidas para las cuales el sólido cristalino es menos denso que el líquido (otros incluyen antimonio y bismuto). El aumento de la presión del hielo que está en equilibrio con el agua a 0 ° C y 1 atm tiende a acercar algunas de las moléculas, disminuyendo así el volumen de la muestra. La disminución en el volumen (y el aumento correspondiente en la densidad) es menor para un sólido o líquido que para un gas, pero es suficiente para derretir parte del hielo.
En la Figura ( PageIndex {2b} ) el punto A está ubicado en P = 1 atm y T = −1.0 ° C, dentro de la región sólida (hielo) del diagrama de fases. A medida que la presión aumenta a 150 atm mientras la temperatura permanece igual, la línea desde el punto A cruza el límite de hielo / agua hasta el punto B, que se encuentra en la región de agua líquida. En consecuencia, la aplicación de una presión de 150 atm derretirá el hielo a -1.0 ° C. Ya hemos indicado que la dependencia de la presión del punto de fusión del agua es de vital importancia. Si el límite sólido / líquido en el diagrama de fase del agua se inclinara hacia arriba y hacia la derecha en lugar de hacia la izquierda, el hielo sería más denso que el agua, los cubitos de hielo se hundirían, las tuberías de agua no se reventarían cuando se congelen, y el anticongelante ser innecesario en motores de automóviles.
El diagrama de fases del dióxido de carbono
En contraste con el diagrama de fase del agua, el diagrama de fase de CO 2 (Figura ( PageIndex {3} )) tiene una curva de fusión más típica, inclinada hacia arriba y hacia la derecha. El punto triple es −56.6 ° C y 5.11 atm, lo que significa que el CO líquido 2 no puede existir a presiones inferiores a 5.11 atm. Por lo tanto, a 1 atm, el CO 2 sólido se sublima directamente al vapor mientras se mantiene una temperatura de -78.5 ° C, la temperatura de sublimación normal. El CO sólido 2 se conoce generalmente como hielo seco porque es un sólido frío sin fase líquida observada cuando se calienta.

Observe también el punto crítico a 30.98 ° C y 72.79 atm. El dióxido de carbono supercrítico está emergiendo como refrigerante natural, lo que lo convierte en una solución baja en carbono (y, por lo tanto, más ecológica) para las bombas de calor domésticas.

El punto crítico
Como lo demuestran los diagramas de fases anteriores, una combinación de alta presión y baja temperatura permite que los gases se licúen. A medida que aumentamos la temperatura de un gas, la licuefacción se vuelve cada vez más difícil porque se requieren presiones cada vez más altas para superar el aumento de la energía cinética de las moléculas. De hecho, para cada sustancia, hay una temperatura por encima de la cual el gas ya no se puede licuar, independientemente de la presión. Esta temperatura es la temperatura crítica ( T c ) , la temperatura más alta a la que una sustancia puede existir como líquido. Por encima de la temperatura crítica, las moléculas tienen demasiada energía cinética para que las fuerzas de atracción intermoleculares las mantengan juntas en una fase líquida separada. En cambio, la sustancia forma una sola fase que ocupa completamente el volumen del recipiente. Las sustancias con fuertes fuerzas intermoleculares tienden a formar una fase líquida en un rango de temperatura muy grande y, por lo tanto, tienen altas temperaturas críticas. Por el contrario, las sustancias con interacciones intermoleculares débiles tienen temperaturas críticas relativamente bajas. Cada sustancia también tiene una presión crítica ( P c ) , la presión mínima necesaria para licuarla a la temperatura crítica. La combinación de temperatura crítica y presión crítica se denomina punto crítico . Las temperaturas y presiones críticas de varias sustancias comunes se enumeran en la Figura ( PageIndex {1} ).
| Sustancia | T c (° C) | P c (cajero automático) |
|---|---|---|
| NH 3 | 132,4 | 113,5 |
| CO 2 | 31,0 | 73,8 |
| CH 3 CH 2 OH (etanol) | 240,9 | 61,4 |
| Él | −267,96 | 2,27 |
| Hg | 1477 | 1587 |
| CH 4 | −82,6 | 46,0 |
| N 2 | −146,9 | 33,9 |
| H 2 O | 374,0 | 217,7 |
Fluidos supercríticos
Para comprender lo que sucede en el punto crítico, considere los efectos de la temperatura y la presión sobre las densidades de líquidos y gases, respectivamente. A medida que aumenta la temperatura de un líquido, disminuye su densidad. A medida que aumenta la presión de un gas, aumenta su densidad. En el punto crítico, las fases líquida y gaseosa tienen exactamente la misma densidad, y solo existe una fase. Esta fase única se llama fluido supercrítico , que exhibe muchas de las propiedades de un gas pero tiene una densidad más típica de un líquido. Por ejemplo, la densidad del agua en su punto crítico ( T = 374 ° C, P = 217.7 atm) es 0.32 g / mL, aproximadamente un tercio de la del agua líquida a temperatura ambiente pero mucho mayor que la del vapor de agua en la mayoría de las condiciones. La transición entre una mezcla de líquido / gas y una fase supercrítica se demuestra para (CO_2 ) en la Figura ( PageIndex {4} ). A la temperatura crítica, el menisco que separa las fases líquida y gaseosa desaparece.
En los últimos años, los fluidos supercríticos han evolucionado de curiosidades de laboratorio a sustancias con importantes aplicaciones comerciales. Por ejemplo, el dióxido de carbono tiene una temperatura crítica baja (31 ° C), una presión crítica comparativamente baja (73 atm) y baja toxicidad, por lo que es fácil de contener y relativamente seguro de manipular. Debido a que muchas sustancias son bastante solubles en CO supercrítico 2 , los procesos comerciales que lo usan como solvente ahora están bien establecidos en la industria del petróleo, la industria alimentaria y otros. El CO supercrítico 2 se bombea a pozos de petróleo que ya no producen mucho petróleo para disolver el petróleo residual en los depósitos subterráneos. La solución menos viscosa se bombea a la superficie, donde el aceite se puede recuperar por evaporación (y reciclaje) del CO 2 . En la industria de alimentos, sabores y fragancias, el CO supercrítico 2 se usa para extraer componentes de sustancias naturales para su uso en perfumes, eliminar ácidos orgánicos desagradables del lúpulo antes de hacer cerveza y extraer selectivamente cafeína del café entero frijoles sin eliminar componentes importantes del sabor. El último proceso fue patentado en 1974, y ahora prácticamente todo el café descafeinado se produce de esta manera. El método anterior utilizaba solventes orgánicos volátiles como el cloruro de metileno (diclorometano [CH 2 Cl 2 ], punto de ebullición = 40 ° C), que es difícil de eliminar por completo de los granos y Se sabe que causa cáncer en animales de laboratorio a altas dosis.
Resumen
Los estados de la materia exhibidos por una sustancia bajo diferentes temperaturas y presiones pueden resumirse gráficamente en un diagrama de fase , que es un gráfico de presión versus temperatura. Los diagramas de fase contienen regiones discretas correspondientes a las fases sólida, líquida y gaseosa. Las regiones sólida y líquida están separadas por la curva de fusión de la sustancia, y las regiones líquida y gaseosa están separadas por su curva de presión de vapor, que termina en el punto crítico. Dentro de una región dada, solo una sola fase es estable, pero a lo largo de las líneas que separan las regiones, dos fases están en equilibrio a una temperatura y presión dadas. Las líneas que separan las tres fases se cruzan en un solo punto, el punto triple , que es la única combinación de temperatura y presión en la que las tres fases pueden coexistir en equilibrio. El agua tiene un diagrama de fase inusual: su punto de fusión disminuye al aumentar la presión porque el hielo es menos denso que el agua líquida. El diagrama de fases del dióxido de carbono muestra que el dióxido de carbono líquido no puede existir a presión atmosférica. En consecuencia, el dióxido de carbono sólido se sublima directamente a un gas.