Los sólidos cristalinos tienen arreglos ordenados regulares de componentes unidos por fuerzas intermoleculares uniformes, mientras que los componentes de sólidos amorfos no están dispuestos en arreglos regulares. Con pocas excepciones, las partículas que componen un material sólido, ya sean iónicas, moleculares, covalentes o metálicas, se mantienen en su lugar mediante fuertes fuerzas de atracción entre ellas. Cuando hablamos de sólidos, por lo tanto, consideramos las posiciones de los átomos, moléculas o iones, que están esencialmente fijos en el espacio, en lugar de sus movimientos (que son más importantes en líquidos y gases). Los constituyentes de un sólido se pueden organizar de dos maneras generales: pueden formar una estructura tridimensional repetitiva regular llamada red cristalina, produciendo así un sólido cristalino, o pueden agregarse sin un orden particular, en cuyo caso forman un amorfo sólido (del griego ámorphos, que significa “sin forma”).


Los sólidos cristalinos, o cristales, tienen estructuras internas distintivas que a su vez conducen a superficies o caras planas distintivas. Las caras se cruzan en ángulos que son característicos de la sustancia. Cuando se expone a los rayos X, cada estructura también produce un patrón distintivo que se puede utilizar para identificar el material. Los ángulos característicos no dependen del tamaño del cristal; reflejan la disposición repetitiva regular de los átomos, moléculas o iones componentes en el espacio. Cuando se divide un cristal iónico (Figura ( PageIndex {1} ), por ejemplo, las interacciones repulsivas hacen que se rompa a lo largo de planos fijos para producir nuevas caras que se cruzan en los mismos ángulos que los del cristal original. En un covalente sólido, como un diamante cortado, los ángulos en los que se encuentran las caras tampoco son arbitrarios, sino que están determinados por la disposición de los átomos de carbono en el cristal.
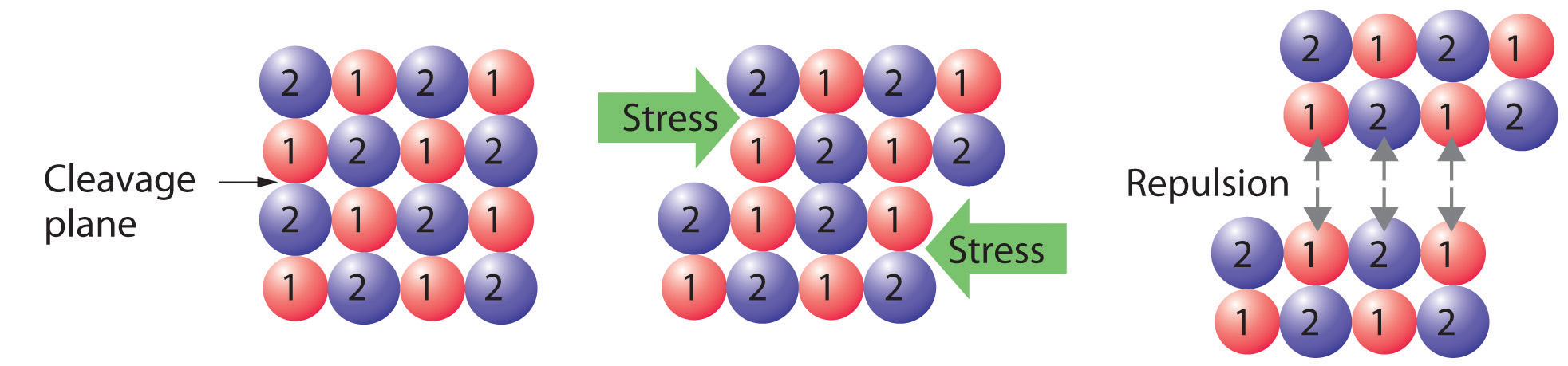
Los cristales tienden a tener puntos de fusión relativamente definidos y bien definidos porque todos los átomos, moléculas o iones componentes están a la misma distancia del mismo número y tipo de vecinos; es decir, la regularidad de la red cristalina crea entornos locales que son iguales. Por lo tanto, las fuerzas intermoleculares que mantienen unido el sólido son uniformes, y se necesita la misma cantidad de energía térmica para romper cada interacción simultáneamente.
Los sólidos amorfos tienen dos propiedades características. Cuando se cortan o rompen, producen fragmentos con superficies irregulares, a menudo curvadas; y tienen patrones mal definidos cuando se exponen a rayos X porque sus componentes no están dispuestos en una matriz regular. Un sólido amorfo y translúcido se llama vidrio. Casi cualquier sustancia puede solidificarse en forma amorfa si la fase líquida se enfría lo suficientemente rápido. Sin embargo, algunos sólidos son intrínsecamente amorfos, ya que sus componentes no pueden encajar lo suficientemente bien como para formar una red cristalina estable o contienen impurezas que interrumpen la red. Por ejemplo, aunque la composición química y las unidades estructurales básicas de un cristal de cuarzo y un cristal de cuarzo son las mismas, ambas son SiO 2 y ambas consisten en tetraedros de SiO 4 unidos, las disposiciones de los átomos en el espacio no lo son. El cuarzo cristalino contiene una disposición altamente ordenada de átomos de silicio y oxígeno, pero en el vidrio de cuarzo los átomos están dispuestos casi al azar. Cuando el SiO fundido 2 se enfría rápidamente (4 K / min), forma vidrio de cuarzo, mientras que los cristales de cuarzo grandes y perfectos vendidos en tiendas de minerales han tenido tiempos de enfriamiento de miles de años. En contraste, el aluminio cristaliza mucho más rápidamente. El aluminio amorfo se forma solo cuando el líquido se enfría a una velocidad extraordinaria de 4 × 10 13 K / s, lo que impide que los átomos se organicen en una matriz regular.
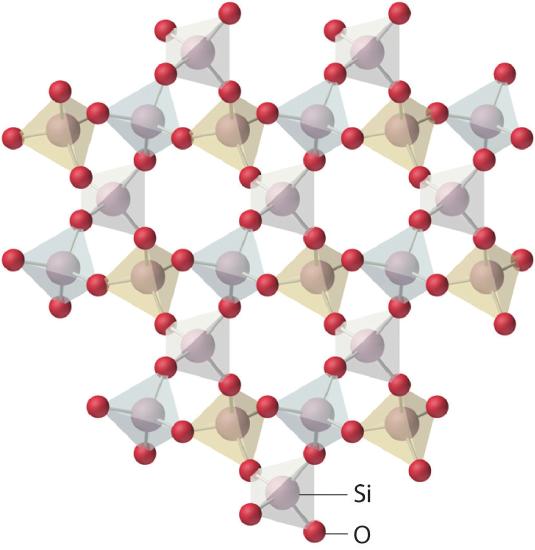
En un sólido amorfo, el entorno local, incluidas las distancias a las unidades vecinas y el número de vecinos, varía en todo el material. Se necesitan diferentes cantidades de energía térmica para superar estas diferentes interacciones. En consecuencia, los sólidos amorfos tienden a ablandarse lentamente en un amplio rango de temperatura en lugar de tener un punto de fusión bien definido como un sólido cristalino. Si un sólido amorfo se mantiene a una temperatura justo debajo de su punto de fusión durante largos períodos de tiempo, las moléculas componentes, átomos o iones pueden reorganizarse gradualmente en una forma cristalina más ordenada.
Cristales
Debido a que un sólido cristalino consiste en patrones repetitivos de sus componentes en tres dimensiones (una red cristalina), podemos representar todo el cristal dibujando la estructura de las unidades idénticas más pequeñas que, cuando se apilan juntas, forman el cristal. Esta unidad repetitiva básica se llama celda unitaria. Por ejemplo, la celda unitaria de una hoja de sellos postales idénticos es un sello único, y la celda unitaria de una pila de ladrillos es un solo ladrillo. En esta sección, describimos las disposiciones de los átomos en varias celdas unitarias.
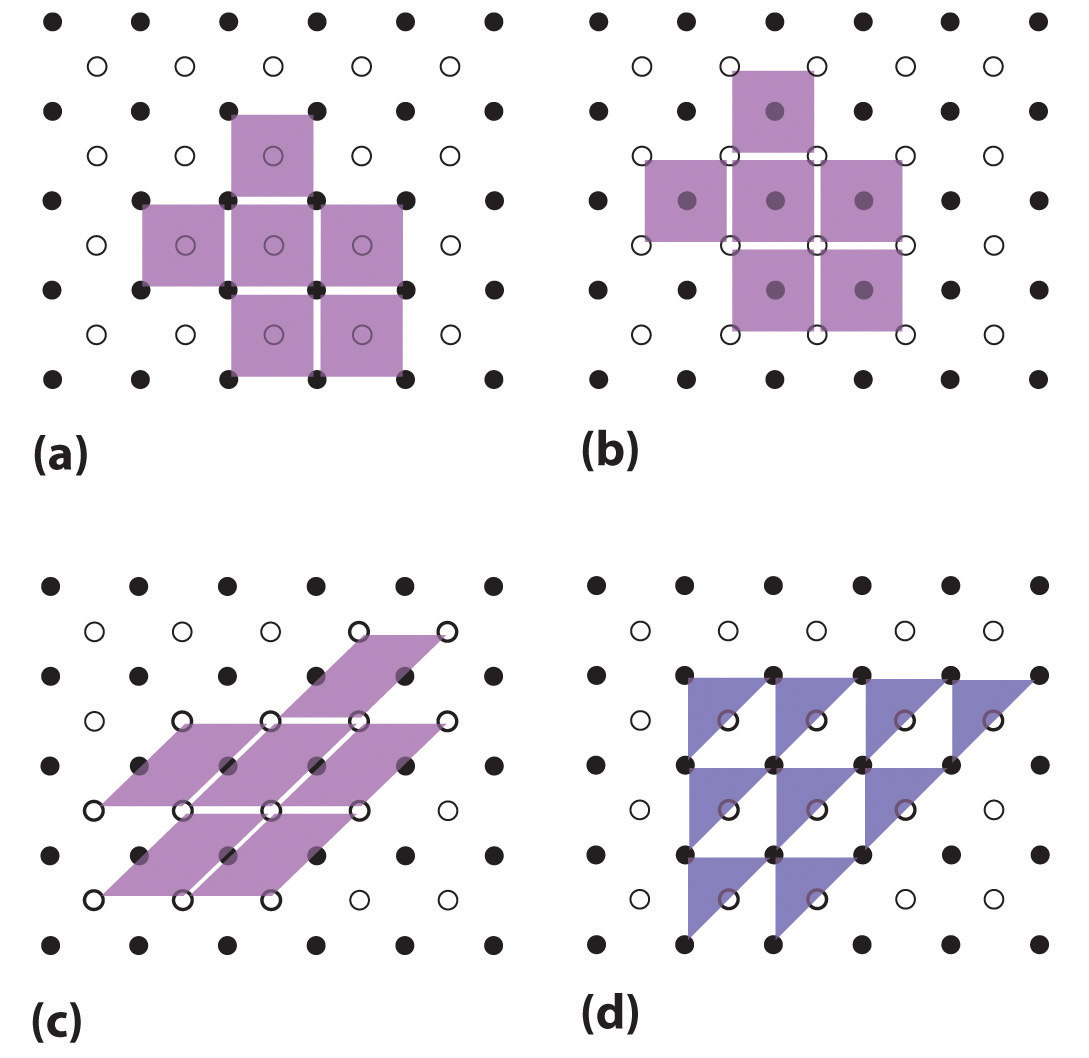
Las celdas unitarias son más fáciles de visualizar en dos dimensiones. En muchos casos, se puede usar más de una celda unitaria para representar una estructura dada, como se muestra para el dibujo de Escher en el primer capítulo y para una red cristalina bidimensional en la Figura ( PageIndex {2} ). Por lo general, se elige la celda unitaria más pequeña que describe completamente el orden. El único requisito para una celda unitaria válida es que repetirla en el espacio debe producir la red regular. Por lo tanto, la celda unitaria en la parte (d) en la Figura ( PageIndex {2} ) no es una opción válida porque repetirla en el espacio no produce la red deseada (hay agujeros triangulares). El concepto de celdas unitarias se extiende a una red tridimensional en el dibujo esquemático de la Figura ( PageIndex {3} ).
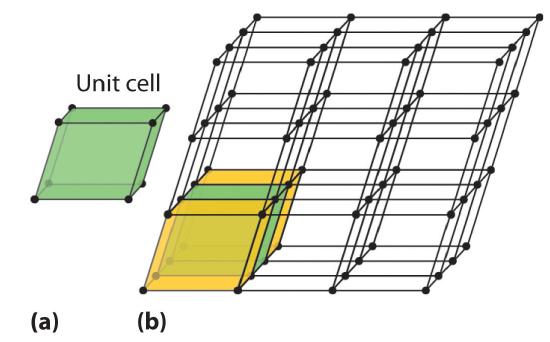
La celda de la unidad
Hay siete tipos fundamentalmente diferentes de celdas unitarias, que difieren en las longitudes relativas de los bordes y los ángulos entre ellas (Figura ( PageIndex {4} )). Cada celda unitaria tiene seis lados, y cada lado es un paralelogramo. Nos centramos principalmente en las celdas unitarias cúbicas, en las que todos los lados tienen la misma longitud y todos los ángulos son 90 °, pero los conceptos que presentamos también se aplican a sustancias cuyas celdas unitarias no son cúbicas.
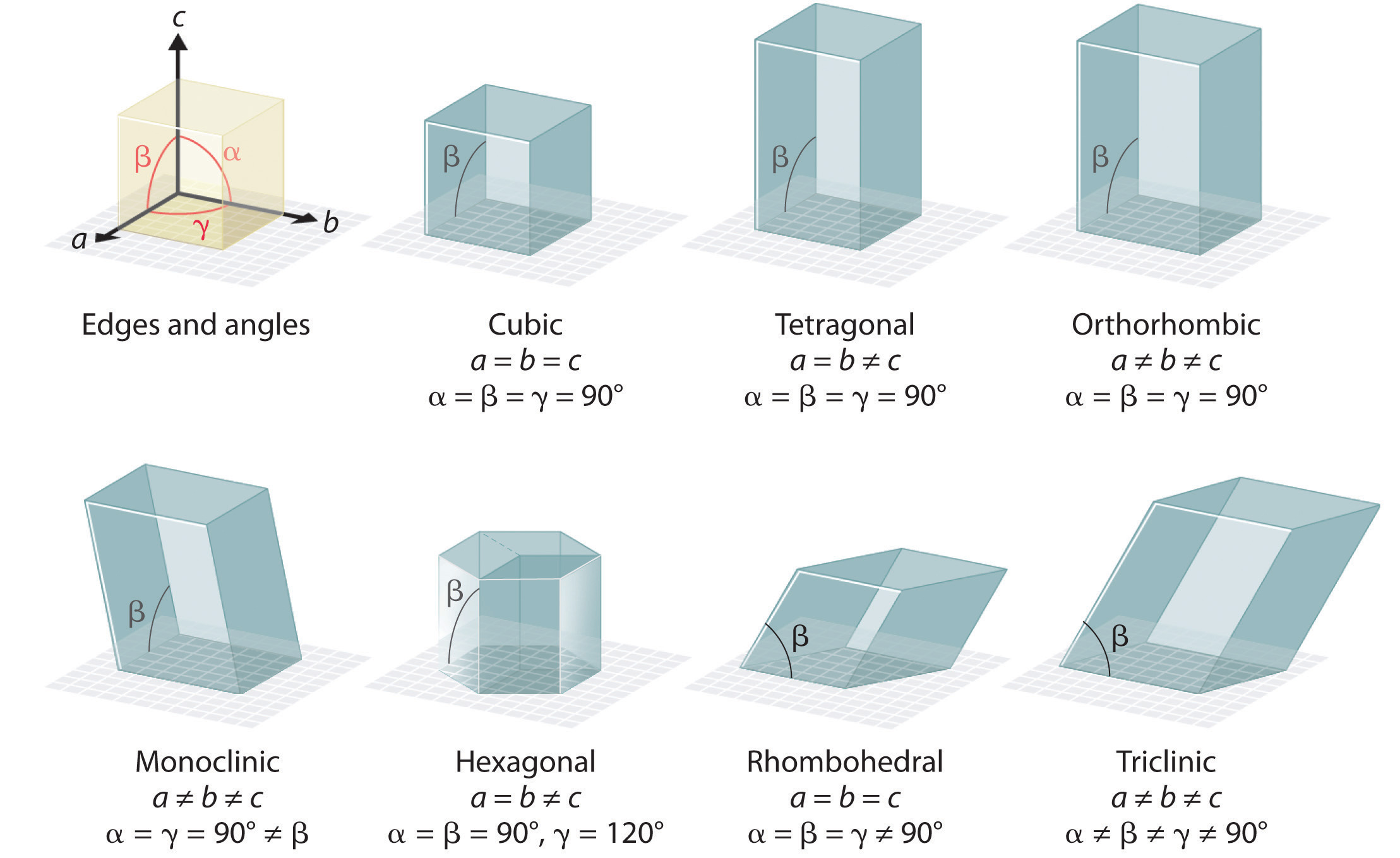
Si la celda unidad cúbica consta de ocho átomos, moléculas o iones componentes ubicados en las esquinas del cubo, entonces se llama cúbica simple (Figura ( PageIndex {5a} )). Si la celda unitaria también contiene un componente idéntico en el centro del cubo, entonces es cúbico centrado en el cuerpo (bcc) ( ( PageIndex {5b} )). Si hay componentes en el centro de cada cara además de los que están en las esquinas del cubo, entonces la celda unitaria es cúbica centrada en la cara (fcc) (Figura ( PageIndex {5c} )).
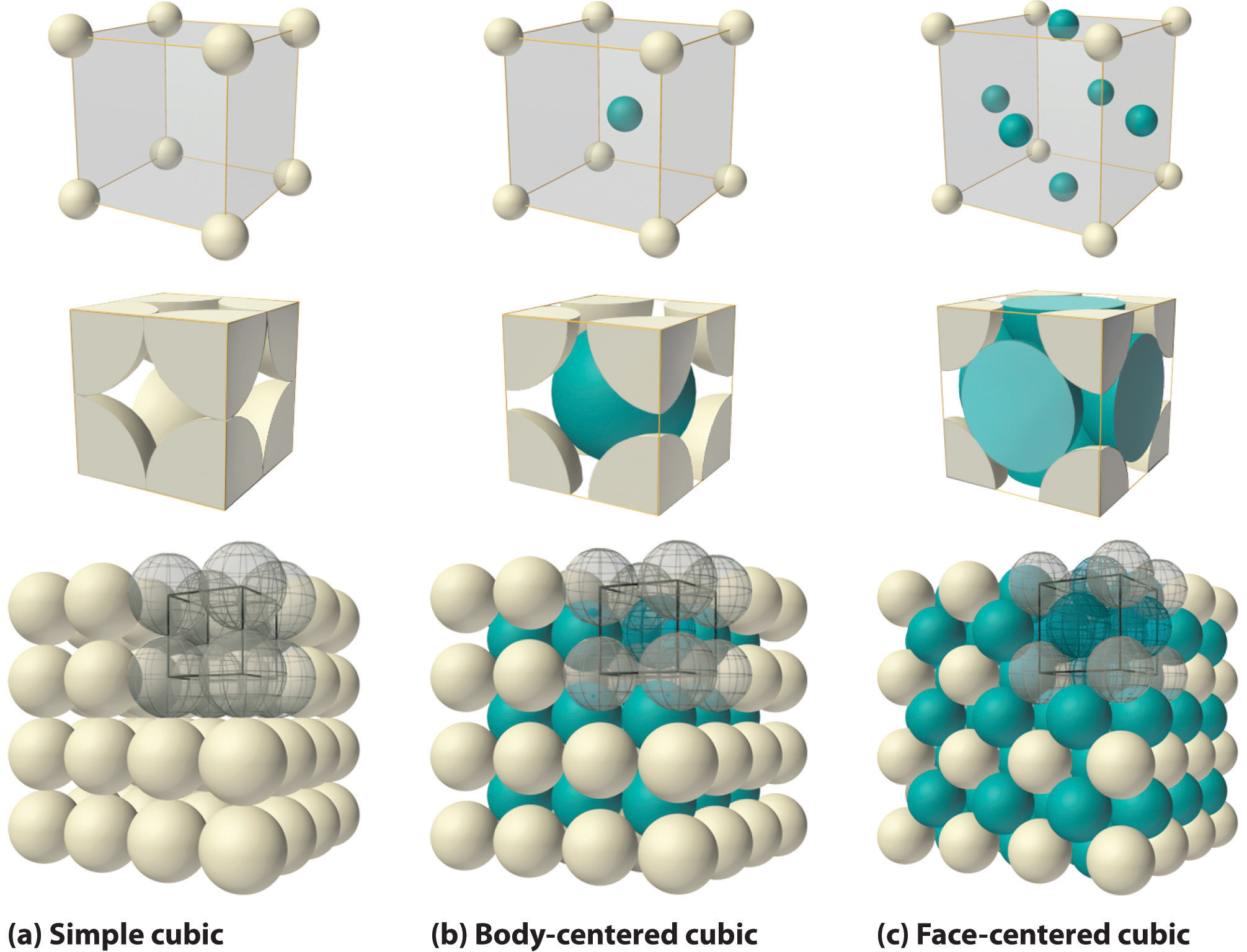
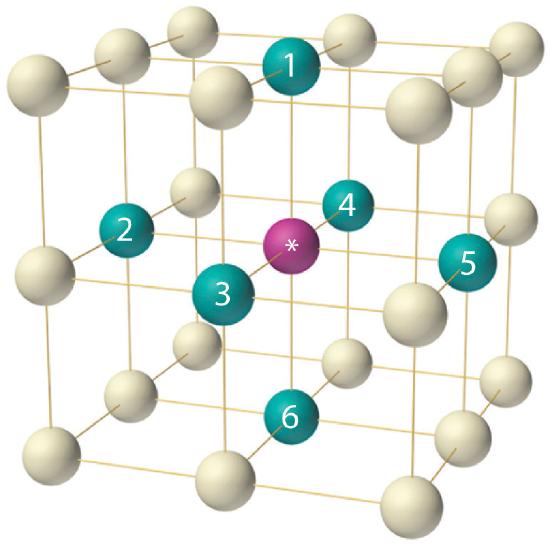
Como se indica en la Figura ( PageIndex {5} ), un sólido consta de una gran cantidad de celdas unitarias dispuestas en tres dimensiones. Por lo tanto, cualquier propiedad intensiva del material a granel, como su densidad, también debe estar relacionada con su celda unitaria. Dado que la densidad es la masa de sustancia por unidad de volumen, podemos calcular la densidad del material a granel a partir de la densidad de una sola celda unitaria. Para hacer esto, necesitamos saber el tamaño de la celda unitaria (para obtener su volumen), la masa molar de sus componentes y el número de componentes por celda unitaria. Sin embargo, cuando contamos átomos o iones en una celda unitaria, los que se encuentran sobre una cara, un borde o una esquina contribuyen a más de una celda unitaria, como se muestra en la Figura ( PageIndex {5} ). Por ejemplo, un átomo que se encuentra en la cara de una celda unitaria es compartido por dos celdas unitarias adyacentes y, por lo tanto, se cuenta como un átomo ({1 over 2} ) por celda unitaria. Del mismo modo, un átomo que se encuentra en el borde de una celda unitaria es compartido por cuatro celdas unitarias adyacentes, por lo que contribuye a un átomo ({1 over 4} ) a cada una. Un átomo en una esquina de una celda unitaria es compartido por las ocho celdas unitarias adyacentes y, por lo tanto, contribuye a un átomo ({1 over 8} ) a cada una. La afirmación de que los átomos que se encuentran en un borde o una esquina de una celda unitaria cuentan como ({1 over 4} ) o ({1 over 8} ) átomo por celda unidad, respectivamente, es verdadera para todas las unidades celdas excepto la hexagonal, en la que tres celdas unitarias comparten cada borde vertical y seis comparten cada esquina (Figura ( PageIndex {4} ) :), lo que lleva a valores de ({1 over 3} ) y ({1 over 6} ) átomo por unidad de celda, respectivamente, para átomos en estas posiciones. En contraste, los átomos que se encuentran completamente dentro de una celda unitaria, como el átomo en el centro de una celda unitaria centrada en el cuerpo, pertenecen solo a esa celda unitaria.
Ahora que sabemos cómo contar átomos en células unitarias, podemos usar células unitarias para calcular las densidades de compuestos simples. Sin embargo, tenga en cuenta que estamos suponiendo que un sólido consiste en una matriz regular perfecta de células unitarias, mientras que las sustancias reales contienen impurezas y defectos que afectan muchas de sus propiedades en masa, incluida la densidad. En consecuencia, los resultados de nuestros cálculos serán cercanos pero no necesariamente idénticos a los valores obtenidos experimentalmente.
Embalaje de esferas
Nuestra discusión sobre las estructuras tridimensionales de los sólidos ha considerado solo sustancias en las que todos los componentes son idénticos. Como veremos, tales sustancias pueden verse como consistentes en esferas idénticas empaquetadas en el espacio; la forma en que se empaquetan los componentes produce las diferentes celdas unitarias. La mayoría de las sustancias con estructuras de este tipo son metales.
Estructura cúbica simple
La disposición de los átomos en un sólido que tiene una celda unidad cúbica simple se mostró en la Figura ( PageIndex {5a} ). Cada átomo en la red tiene solo seis vecinos más cercanos en una disposición octaédrica. En consecuencia, la simple red cúbica es una forma ineficiente de agrupar átomos en el espacio: solo el 52% del espacio total está ocupado por los átomos. El único elemento que cristaliza en una celda unitaria simple es el polonio. Sin embargo, las células unitarias cúbicas simples son comunes entre los compuestos iónicos binarios, donde cada catión está rodeado por seis aniones y viceversa.
Estructura cúbica centrada en el cuerpo
La celda unidad cúbica centrada en el cuerpo es una forma más eficiente de empaquetar esferas y es mucho más común entre los elementos puros. Cada átomo tiene ocho vecinos más cercanos en la celda unitaria, y el 68% del volumen está ocupado por los átomos. Como se muestra en la Figura ( PageIndex {5b} ), la estructura cúbica centrada en el cuerpo consiste en una sola capa de esferas en contacto entre sí y alineadas de modo que sus centros estén en las esquinas de un cuadrado; una segunda capa de esferas ocupa los “agujeros” de forma cuadrada sobre las esferas en la primera capa. La tercera capa de esferas ocupa los agujeros cuadrados formados por la segunda capa, de modo que cada uno se encuentra directamente sobre una esfera en la primera capa, y así sucesivamente. Todos los metales alcalinos, bario, radio y varios de los metales de transición tienen estructuras cúbicas centradas en el cuerpo.
Estructuras hexagonales compactas y cúbicas compactas
La forma más eficiente de empaquetar esferas es la disposición compacta, que tiene dos variantes. En la Figura ( PageIndex {6a} ) se muestra una sola capa de esferas compactas. Cada esfera está rodeada por otras seis en el mismo plano para producir una disposición hexagonal. Sobre cualquier conjunto de siete esferas hay seis depresiones dispuestas en un hexágono. En principio, los seis sitios son iguales, y cualquiera de ellos podría estar ocupado por un átomo en la siguiente capa. Sin embargo, en realidad, estos seis sitios se pueden dividir en dos conjuntos, etiquetados como B y C en la Figura ( PageIndex {6a} ). Los sitios B y C difieren porque tan pronto como colocamos una esfera en una posición B, ya no podemos colocar una esfera en ninguna de las tres posiciones C adyacentes a A y viceversa.
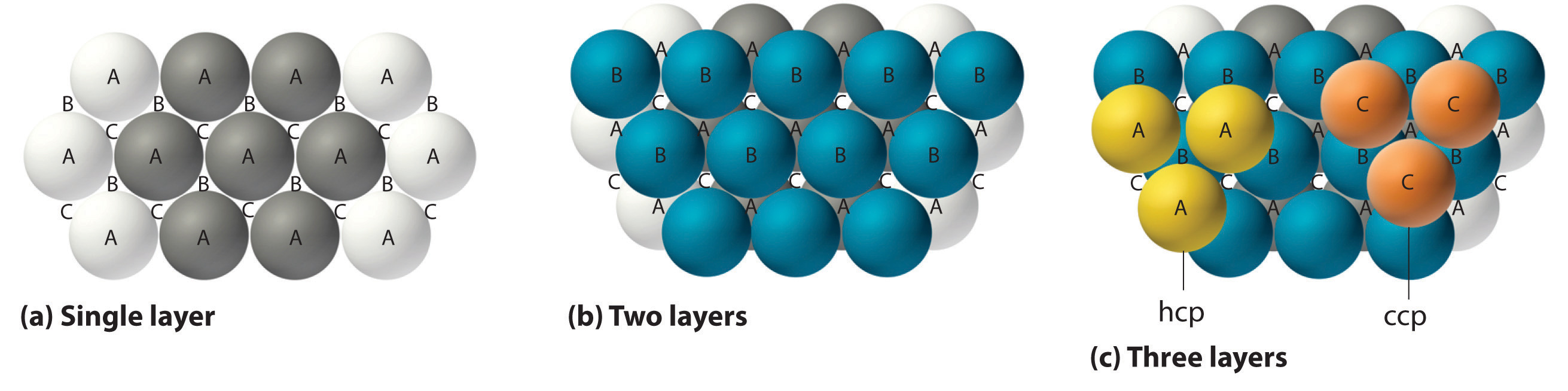
Si colocamos la segunda capa de esferas en las posiciones B de la Figura ( PageIndex {6a} ), obtenemos la estructura de dos capas que se muestra en la Figura ( PageIndex {6b} ). Ahora hay dos alternativas para colocar el primer átomo de la tercera capa: podemos colocarlo directamente sobre uno de los átomos en la primera capa (una posición A) o en una de las posiciones C, que corresponde a las posiciones que no teníamos use para los átomos en la primera o segunda capa (Figura ( PageIndex {6c} )). Si elegimos la primera disposición y repetimos el patrón en capas sucesivas, las posiciones de los átomos se alternan de capa a capa en el patrón ABABAB …, lo que resulta en una estructura hexagonal compacta (hcp) (Figura ( PageIndex {7a} )). Si elegimos la segunda disposición y repetimos el patrón indefinidamente, las posiciones de los átomos se alternan como ABCABC …, dando una estructura cúbica compacta (ccp) (Figura ( PageIndex {7b} )). Debido a que la estructura ccp contiene capas empaquetadas hexagonalmente, no se ve particularmente cúbica. Sin embargo, como se muestra en la Figura ( PageIndex {7b} ), simplemente girando la estructura revela su naturaleza cúbica, que es idéntica a una estructura fcc. Las estructuras hcp y ccp difieren solo en la forma en que se apilan sus capas. Ambas estructuras tienen una eficiencia global de empaquetamiento del 74%, y en cada átomo tiene 12 vecinos más cercanos (6 en el mismo plano más 3 en cada uno de los planos inmediatamente superiores e inferiores).
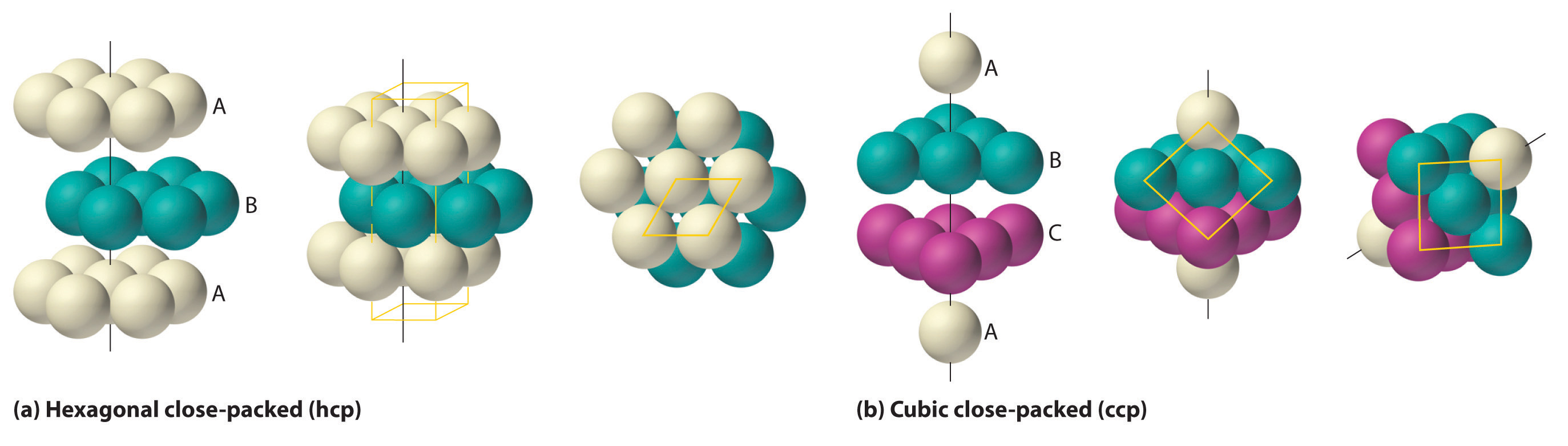
La tabla ( PageIndex {1} ) compara la eficiencia del empaque y el número de vecinos más cercanos para las diferentes estructuras cúbicas y compactas; El número de vecinos más cercanos se llama número de coordinación. La mayoría de los metales tienen estructuras hcp, ccp o bcc, aunque varios metales exhiben estructuras hcp y ccp, dependiendo de la temperatura y la presión.
| Estructura | Porcentaje del espacio ocupado por los átomos | Número de coordinación |
|---|---|---|
| cúbico simple | 52 | 6 |
| cúbico centrado en el cuerpo | 68 | 8 |
| cierre hexagonal cerrado | 74 | 12 |
| cúbico cerrado (idéntico al cúbico centrado en la cara) | 74 | 12 |
Resumen
Un sólido cristalino puede ser representado por su celda unidad, que es la unidad idéntica más pequeña que, cuando se apilan juntas, produce la estructura tridimensional característica. Los sólidos se caracterizan por una disposición tridimensional extendida de átomos, iones o moléculas en los que los componentes generalmente están bloqueados en sus posiciones. Los componentes se pueden organizar en una matriz tridimensional repetitiva regular (una red cristalina), que da como resultado un sólido cristalino, o más o menos al azar para producir un sólido amorfo. Los sólidos cristalinos tienen bordes y caras bien definidos, difractan rayos X y tienden a tener puntos de fusión agudos. En contraste, los sólidos amorfos tienen superficies irregulares o curvas, no dan patrones de difracción de rayos X bien resueltos y se funden en un amplio rango de temperaturas.
La unidad de repetición más pequeña de una red cristalina es la celda unitaria. La celda unidad cúbica simple contiene solo ocho átomos, moléculas o iones en las esquinas de un cubo. Una celda unitaria cúbica centrada en el cuerpo (bcc) contiene un componente adicional en el centro del cubo. Una celda unitaria cúbica centrada en la cara (fcc) contiene un componente en el centro de cada cara además de los de las esquinas del cubo. Los arreglos cúbicos y bcc simples llenan solo el 52% y el 68% del espacio disponible con átomos, respectivamente. La estructura hexagonal compacta (hcp) tiene una disposición repetitiva ABABAB …, y la estructura cúbica compacta (ccp) tiene un patrón repetitivo ABCABC …; este último es idéntico a una red fcc. Las disposiciones hcp y ccp ocupan el 74% del espacio disponible y tienen un número de coordinación de 12 para cada átomo en la red, el número de vecinos más cercanos. Las redes simples cúbicas y bcc tienen números de coordinación de 6 y 8, respectivamente.