Respuestas numéricas
1. (6.7 veces 10 ^ 4 ; amu )
3. 9.24 atm
5. La solución (CaCl_2 ) tendrá una presión de vapor más baja, porque contiene tres veces más partículas que la solución de glucosa.
7. 0.36 m (NaCl ), 2.6 g (NaCl )
9. 60 g de NaBr
11. 700 g (NaCl )
13. (MgCl_2 ) produce tres partículas en solución versus dos para (NaCl ), por lo que la misma concentración molal de (MgCl_2 ) producirá una depresión del punto de congelación 50% mayor que para (NaCl ) Sin embargo, la masa molar de (MgCl_2 ) es 95.3 g / mol versus 48.45 g / mol para (NaCl ). En consecuencia, una solución que contiene 1 g (NaCl ) por 1000 g (H_2O ) producirá una depresión del punto de congelación de 0.064 ° C versus 0.059 ° C para una solución que contenga 1 g (MgCl_2 ) por 1000 g ( H_2O ). Por lo tanto, dado el mismo costo por gramo, (NaCl ) es más efectivo. Sí, (MgCl_2 ) sería efectivo a −8 ° C; se requeriría una solución de 1,43 m (136 g por 1000 g de H2O).
16.
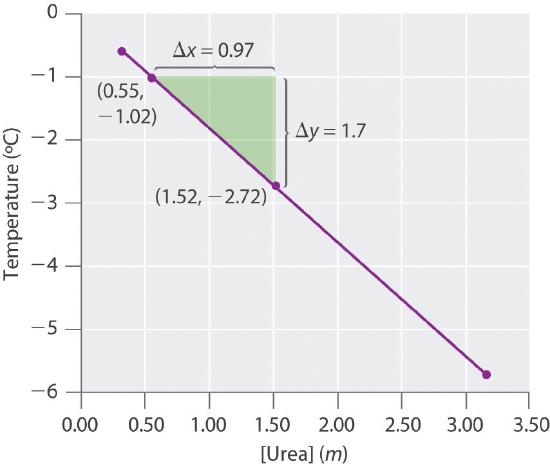
k f = 1,81 (° C • kg) / mol, masa molecular de urea = 60,0 g / mol