Una de las principales razones para estudiar la cinética química es utilizar mediciones de las propiedades macroscópicas de un sistema, como la tasa de cambio en la concentración de reactivos o productos con el tiempo, para descubrir la secuencia de eventos que ocurren en el nivel molecular durante una reacción. Esta descripción molecular es el mecanismo de la reacción; describe cómo los átomos, iones o moléculas individuales interactúan para formar productos particulares. Los cambios escalonados se denominan colectivamente mecanismo de reacción.
En un motor de combustión interna, por ejemplo, el isooctano reacciona con oxígeno para dar dióxido de carbono y agua:
[2C_8H_ {18 ; (l)} + 25O_2 (g) rightarrow 16CO_ {2 , (g)} + 18H_2O _ {(g)} label {14.6.1} ]
Para que esta reacción ocurra en un solo paso, 25 moléculas de dioxígeno y 2 moléculas de isooctano tendrían que colisionar simultáneamente y convertirse en 34 moléculas de producto, lo cual es muy poco probable. Es más probable que una serie compleja de reacciones tenga lugar de forma gradual. Cada reacción individual, que se denomina reacción elemental , involucra uno, dos o (rara vez) tres átomos, moléculas o iones. La secuencia general de las reacciones elementales es el mecanismo de la reacción. La suma de los pasos individuales, o reacciones elementales, en el mecanismo debe dar la ecuación química equilibrada para la reacción general.
La secuencia general de reacciones elementales es el mecanismo de la reacción.
Molecularidad y el paso determinante de la velocidad
Para demostrar cómo el análisis de las reacciones elementales nos ayuda a determinar el mecanismo de reacción general, examinaremos la reacción mucho más simple del monóxido de carbono con dióxido de nitrógeno.
[NO_ {2} (g) + CO (g) rightarrow NO _ {(g)} + CO_ {2 , (g)} label {14.6.2} ]
De la ecuación química equilibrada, uno podría esperar que la reacción ocurra a través de una colisión de una molécula de (NO_2 ) con una molécula de (CO ) que resulta en la transferencia de un átomo de oxígeno del nitrógeno al carbono . La ley de velocidad determinada experimentalmente para la reacción, sin embargo, es la siguiente:
[tasa = k [NO_2] ^ 2 etiqueta {14.6.3} ]
El hecho de que la reacción es de segundo orden en ([NO_2] ) e independiente de ([CO] ) nos dice que no ocurre por el modelo de colisión simple descrito anteriormente. Si lo hiciera, su ley de tasa prevista sería
[tasa = k [NO_2] [CO]. ]
El siguiente mecanismo de dos pasos es consistente con la ley de tasas si el paso 1 es mucho más lento que el paso 2:
| ( textrm {paso 1} ) | ( mathrm {NO_2} + mathrm {NO_2} xrightarrow { textrm {slow}} mathrm {NO_3} + textrm {NO} ) | ( textrm {reacción elemental} ) |
| ( textrm {paso 2} ) | ( subrayado { mathrm {NO_3} + mathrm {CO} rightarrow mathrm {NO_2} + mathrm {CO_2}} ) | ( textrm {reacción elemental} ) |
| ( textrm {sum} ) | ( mathrm {NO_2} + mathrm {CO} rightarrow mathrm {NO} + mathrm {CO_2} ) | ( textrm {reacción general} ) |
Según este mecanismo, la reacción general ocurre en dos pasos, o reacciones elementales. Sumar los pasos 1 y 2 y cancelar en ambos lados de la ecuación proporciona la ecuación química equilibrada general para la reacción. La molécula (NO_3 ) es un intermedio en la reacción, una especie que no aparece en la ecuación química equilibrada para la reacción general. Se forma como producto del primer paso, pero se consume en el segundo paso.
La suma de las reacciones elementales en un mecanismo de reacción debe dar la ecuación química global equilibrada de la reacción.
Uso de la molecularidad para describir una ley de tasas
La molecularidad de una reacción elemental es el número de moléculas que chocan durante ese paso en el mecanismo. Si solo hay una molécula reactiva en una reacción elemental, ese paso se designa como unimolecular; si hay dos moléculas reactivas, es bimolecular; y si hay tres moléculas reactivas (una situación relativamente rara), es termolecular. Las reacciones elementales que implican la colisión simultánea de más de tres moléculas son altamente improbables y nunca se han observado experimentalmente. (Para entender por qué, ¡intenta hacer que tres o más canicas o bolas de billar choquen entre sí simultáneamente!)
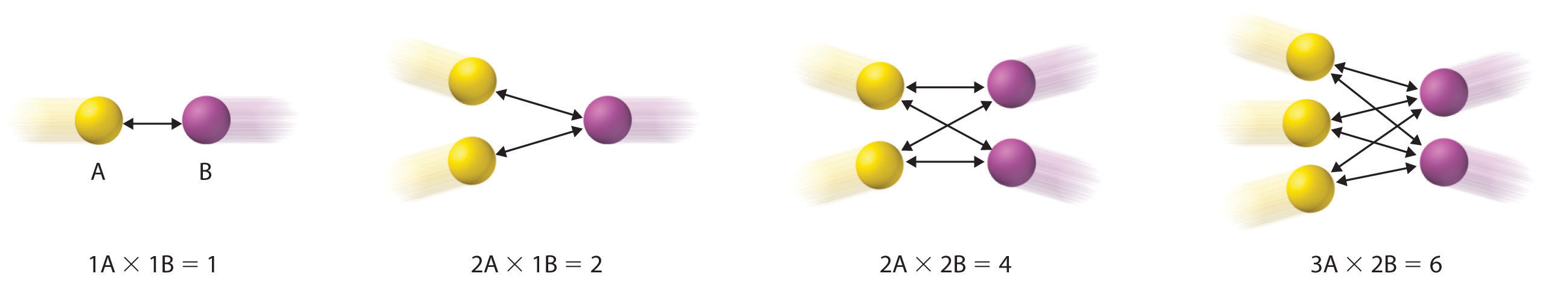
Escribir la ley de velocidad para una reacción elemental es sencillo porque sabemos cuántas moléculas deben colisionar simultáneamente para que ocurra la reacción elemental; por lo tanto, el orden de la reacción elemental es el mismo que su molecularidad ( Tabla ( PageIndex {1} )). En contraste, la ley de velocidad para la reacción no puede determinarse a partir de la ecuación química equilibrada para la reacción general. La ley de velocidad general para una reacción elemental unimolecular (productos A →) es velocidad = k [A]. Para las reacciones bimoleculares, la velocidad de reacción depende del número de colisiones por unidad de tiempo, que es proporcional al producto de las concentraciones de los reactivos, como se muestra en Figur e ( PageIndex {1} ) . Para una reacción elemental bimolecular de la forma A + B → productos, la ley de velocidad general es velocidad = k [A] [B].
| Reacción elemental | Molecularidad | Ley de tasas | Orden de reacción |
|---|---|---|---|
| A → productos | unimolecular | tasa = k [A] | primero |
| 2A → productos | bimolecular | tasa = k [A] 2 | segundo |
| A + B → productos | bimolecular | tasa = k [A] [B] | segundo |
| 2A + B → productos | termolecular | tasa = k [A] 2 [B] | tercero |
| A + B + C → productos | termolecular | tasa = k [A] [B] [C] | tercero |
Para las reacciones elementales, el orden de la reacción elemental es el mismo que su molecularidad. En contraste, la ley de velocidad no puede determinarse a partir de la ecuación química equilibrada para la reacción general (a menos que sea un mecanismo de un solo paso y, por lo tanto, también sea un paso elemental).
Identificación del paso de determinación de la velocidad
Observe la importante diferencia entre escribir leyes de velocidad para reacciones elementales y la ecuación química equilibrada de la reacción general. Debido a que la ecuación química balanceada no revela necesariamente las reacciones elementales individuales por las cuales ocurre la reacción, no podemos obtener la ley de velocidad para una reacción solo de la ecuación química balanceada general. De hecho, es la ley de velocidad para la reacción general más lenta, que es la misma que la ley de velocidad para el paso más lento en el mecanismo de reacción, el paso que determina la velocidad , que debe dar la velocidad determinada experimentalmente ley para la reacción general. Esta afirmación es cierta si un paso es sustancialmente más lento que todos los demás, generalmente por un factor de 10 o más. Si dos o más pasos lentos tienen tasas comparables, las leyes de tasas determinadas experimentalmente pueden volverse complejas. Nuestra discusión se limita a las reacciones en las cuales un paso puede identificarse como sustancialmente más lento que cualquier otro. La razón de esto es que cualquier proceso que ocurra a través de una secuencia de pasos puede tener lugar no más rápido que el paso más lento de la secuencia. En una línea de montaje automotriz, por ejemplo, un componente no se puede usar más rápido de lo que se produce. Del mismo modo, la presión arterial está regulada por el flujo de sangre a través de los conductos más pequeños, los capilares. Debido a que el movimiento a través de los capilares constituye el paso determinante de la velocidad del flujo sanguíneo, la presión arterial puede regularse mediante medicamentos que hacen que los capilares se contraigan o dilaten. Una reacción química que ocurre a través de una serie de reacciones elementales puede tener lugar no más rápido que el paso más lento en la serie de reacciones.

Mire las leyes de velocidad para cada reacción elemental en nuestro ejemplo, así como para la reacción general.
| ( textrm {paso 1} ) | ( mathrm {NO_2} + mathrm {NO_2} xrightarrow { mathrm {k_1}} mathrm {NO_3} + textrm {NO} ) | ( textrm {rate} = k_1 [ mathrm {NO_2}] ^ 2 textrm {(predicho)} ) |
| ( textrm {paso 2} ) | ( underline { mathrm {NO_3} + mathrm {CO} xrightarrow {k_2} mathrm {NO_2} + mathrm {CO_2}} ) | ( textrm {rate} = k_2 [ mathrm {NO_3}] [ mathrm {CO}] textrm {(predicho)} ) |
| ( textrm {sum} ) | ( mathrm {NO_2} + mathrm {CO} xrightarrow {k} mathrm {NO} + mathrm {CO_2} ) | ( textrm {rate} = k [ mathrm {NO_2}] ^ 2 textrm {(observado)} ) |
La ley de velocidad determinada experimentalmente para la reacción de (NO_2 ) con (CO ) es la misma que la ley de velocidad predicha para el paso 1. Esto nos dice que la primera reacción elemental es el paso de determinación de la velocidad, entonces (k ) para la reacción general debe ser igual a (k_1 ). Es decir, NO 3 se forma lentamente en el paso 1, pero una vez que se forma, reacciona muy rápidamente con CO en el paso 2.
A veces los químicos pueden proponer dos o más mecanismos que sean consistentes con los datos disponibles. Sin embargo, si un mecanismo propuesto predice la ley de velocidad experimental incorrecta, el mecanismo debe ser incorrecto.
Resumen
Una reacción química equilibrada no revela necesariamente las reacciones elementales individuales por las cuales ocurre una reacción o su ley de velocidad. Un mecanismo de reacción es el camino microscópico por el cual los reactivos se transforman en productos. Cada paso es una reacción elemental. Las especies que se forman en un paso y se consumen en otro son intermedias. Cada reacción elemental se puede describir en términos de su molecularidad , el número de moléculas que chocan en ese paso. El paso más lento en un mecanismo de reacción es el paso determinante de la velocidad.