Objetivos de aprendizaje
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozca los significados precisos de todos los términos resaltados en el contexto de este tema.
- Escribe la ecuación para la reacción de transferencia de protones que involucra un ácido o base de Brønsted-Lowry, y muestra cómo se puede interpretar como una reacción de transferencia de pares de electrones, identificando claramente al donante y al aceptor.
- Dé un ejemplo de una reacción ácido-base de Lewis que no involucra protones.
- Escribe ecuaciones que ilustren el comportamiento de un sistema ácido-base no acuoso dado.
El concepto de donante-receptor de protones de Brønsted-Lowry ha sido una de las teorías más exitosas de la química. Pero como con cualquier teoría de este tipo, es justo preguntarse si este no es solo un caso especial de una teoría más general que podría abarcar un rango aún más amplio de ciencia química. En 1916, G.N. Lewis de la Universidad de California propuso que el par de electrones es el actor dominante en la química ácido-base. La teoría de Lewis no se hizo muy conocida hasta aproximadamente 1923 (el mismo año en que Brønsted y Lowry publicaron su trabajo), pero desde entonces ha sido reconocida como una herramienta muy poderosa para describir reacciones químicas de tipos muy diferentes y se usa ampliamente en Química orgánica e inorgánica. Según Lewis,
- Un ácido es una sustancia que acepta un par de electrones, y al hacerlo, forma un enlace covalente con la entidad que suministra los electrones.
- Una base es una sustancia que dona un par de electrones no compartidos a una especie receptora con la cual los electrones pueden ser compartidos.
En la química moderna, los donantes de electrones a menudo se denominan nucleófilos, mientras que los aceptores son electrófilos.
Las reacciones de transferencia de protones implican transferencia de pares de electrones
Al igual que cualquier ácido de Arrhenius también es un ácido de Brønsted, cualquier ácido de Brønsted también es un ácido de Lewis, por lo que los diversos conceptos ácido-base son todos “compatibles”. Aunque realmente no necesitamos pensar en las transferencias de pares de electrones cuando tratamos con reacciones ordinarias de ácido-base en solución acuosa, es importante entender que es la oportunidad de compartir pares de electrones que permite la transferencia de protones.
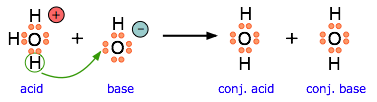
Esta ecuación para una simple neutralización ácido-base muestra cómo las definiciones de Brønsted y Lewis son realmente visiones diferentes del mismo proceso. Tome nota especial de los siguientes puntos:
- La flecha muestra el movimiento de un protón del ion hidronio al ion hidróxido.
- Observe cuidadosamente que los pares de electrones no se mueven; permanecen unidos a sus átomos centrales. El par de electrones en la base se “dona” al aceptor (el protón) solo en el sentido de que termina siendo compartido con el aceptador, en lugar de ser propiedad exclusiva del átomo de oxígeno en el hidróxido ion.
- Aunque el ion hidronio es el ácido de Lewis nominal aquí, en sí mismo no acepta un par de electrones, sino que actúa simplemente como la fuente del protón que se coordina con la base de Lewis.
El punto sobre el par de electrones restante en la especie donante es especialmente importante a tener en cuenta. Por un lado, distingue una reacción ácido-base de Lewis de una reacción de oxidación-reducción , en la que se produce una transferencia física de uno o más electrones del donante al receptor. El producto de una reacción ácido-base de Lewis se conoce formalmente como un “aducto” o “complejo”, aunque normalmente no usamos estos términos para reacciones simples de transferencia de protones como la del ejemplo anterior. Aquí, el protón se combina con el ion hidróxido para formar el “aducto” H 2 O. Los siguientes ejemplos ilustran estos puntos para otras reacciones de transferencia de protones con las que ya debería estar familiarizado.
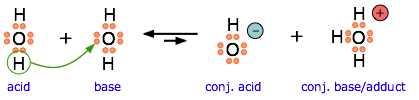
Otro ejemplo, que muestra la autoprotólisis del agua. Tenga en cuenta que la base conjugada es también el aducto.
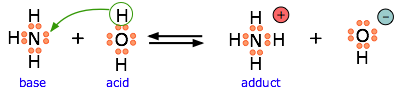
El amoníaco es una base de Brønsted y de Lewis, debido al par de electrones no compartido en el nitrógeno. El reverso de esta reacción representa la hidrólisis del ion amonio.
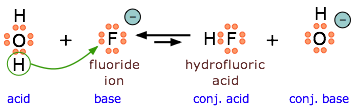
Debido a que ( ce {HF} ) es un ácido débil, las sales de fluoruro se comportan como bases en solución acuosa. Como base de Lewis, F – acepta un protón del agua, que se transforma en un ion hidróxido.
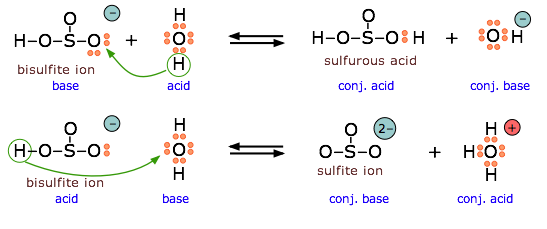
El ion bisulfito es anfibrótico y puede actuar como donante o aceptor de electrones.
Reacciones ácido-base sin transferir protones
La principal utilidad de la definición de Lewis es que extiende el concepto de ácidos y bases más allá del ámbito de las reacciones de transferencia de protones. El ejemplo clásico es la reacción del trifluoruro de boro con amoníaco para formar un aducto :
[ ce {BF_3 + NH_3 rightarrow F_3B-NH_3} ]
Uno de los tipos más comunes de reacciones ácido-base de Lewis ocurre cuando los ligandos donadores de electrones forman complejos de coordinación con iones de metales de transición.
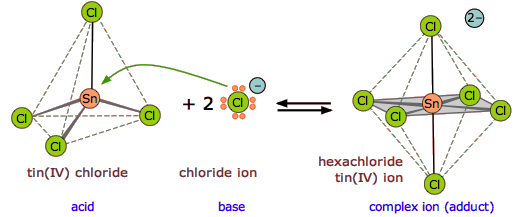
Ejercicio ( PageIndex {1} )
Aquí hay varios ejemplos más de reacciones ácido-base de Lewis que no pueden acomodarse dentro de los modelos Brønsted o Arrhenius. Identifique el ácido de Lewis y la base de Lewis en cada reacción.
- ( ce {Al (OH) _3 + OH ^ {-} rightarrow Al (OH) _4 ^ -} )
- ( ce {SnS_2 + S ^ {2–} rightarrow SnS_3 ^ {2 -}} )
- ( ce {Cd (CN) _2 + 2 CN ^ – rightarrow Cd (CN) _4 ^ {2 +}} )
- ( ce {AgCl + 2 NH_3 rightarrow Ag (NH_3) _2 ^ + + Cl ^ -} )
- ( ce {Fe ^ {2+} + NO rightarrow Fe (NO) ^ {2 +}} )
- ( ce {Ni ^ {2+} + 6 NH_3 rightarrow Ni (NH_3) _5 ^ {2 +}} )
Aplicaciones a mecanismos de reacción orgánicos
Aunque la química orgánica está más allá del alcance de estas lecciones, es instructivo ver cómo los donantes y aceptores de electrones juegan un papel en las reacciones químicas. Los siguientes dos diagramas muestran los mecanismos de dos tipos comunes de reacciones iniciadas por ácidos de Lewis inorgánicos simples:
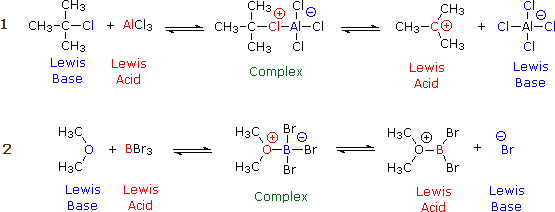
En cada caso, la especie etiquetada como “Complejo” es un intermedio que se descompone en los productos, que son conjugados de los pares de ácido y base originales. Las cargas eléctricas indicadas en los complejos son cargas formales, pero las de los productos son “reales”.
En la reacción 1, el octeto incompleto del átomo de aluminio en ( ce {AlCl3} ) sirve como un mejor aceptor de electrones para el átomo de cloro que la parte isobutilo de la base. En la reacción 2, el par de electrones no unidos en el dimetil éter se coordina con el átomo de boro deficiente en electrones, lo que conduce a un complejo que se descompone al liberar un ion bromuro.
Sistemas de base de ácido protónico no acuoso
Normalmente pensamos que las reacciones ácido-base de Brønsted-Lowry tienen lugar en soluciones acuosas, pero esto no siempre tiene que ser así. Una vista más general abarca una variedad de sistemas solventes ácido-base , de los cuales el sistema de agua es solo uno (Tabla ( PageIndex {1} )). Cada uno de estos tiene como base un disolvente anfibrótico (uno capaz de experimentar autoprotólisis), en paralelo con el caso familiar del agua.
El sistema de amoníaco es uno de los sistemas no acuosos más comunes en química. El amoníaco líquido hierve a –33 ° C, y puede mantenerse convenientemente como un líquido enfriando con hielo seco (–77 ° C). Es un buen solvente para sustancias que también se disuelven en agua, como sales iónicas y compuestos orgánicos, ya que es capaz de formar enlaces de hidrógeno. Sin embargo, muchas otras sustancias conocidas también pueden servir como la base de los sistemas de solventes protónicos como indica la Tabla ( PageIndex {1} ):
|
solvente
|
reacción de autoprotólisis
|
pK ap |
|---|---|---|
| agua | 2 H 2 O → H 3 O + + OH – | 14 |
| amoníaco | 2 NH 3 → NH 4 + + NH 2 – | 33 |
| ácido acético | 2 CH 3 COOH → CH 3 COOH 2 + + CH 3 COO – | 13 |
| etanol | 2 C 2 H 5 OH → C 2 H 5 OH 2 + + C 2 H 5 O – | 19 |
| peróxido de hidrógeno | 2 HO-OH → HO-OH 2 + + HO-O – | 13 |
| ácido fluorhídrico | 2 HF → H 2 F + + F – | 10 |
| ácido sulfúrico | 2 H 2 SO 4 → H 3 SO 4 + + HSO 4 – | 3,5 |
Un uso de los sistemas ácido-base no acuosos es examinar las fuerzas relativas de los ácidos y bases fuertes, cuyas fuerzas son ” niveladas ” por el hecho de que todas están totalmente convertidas en H 3 O + u OH – iones en agua. Al estudiarlos en solventes no acuosos apropiados que son aceptores o donantes de protones más pobres, se pueden determinar sus fuerzas relativas.
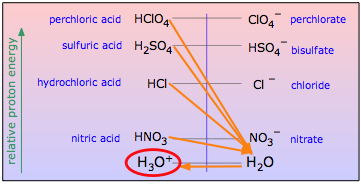
Figura ( PageIndex {2} ): El uso de solventes no acuosos permite el estudio de ácidos fuertes que se ven obstaculizados por la “nivelación” del solvente.
Contribuyentes y atribuciones