Los ácidos y las bases se conocen desde hace mucho tiempo. Cuando Robert Boyle los caracterizó en 1680, observó que los ácidos disuelven muchas sustancias, cambian el color de ciertos tintes naturales (por ejemplo, cambian el tornasol de azul a rojo) y pierden estas propiedades características después de entrar en contacto con los álcalis (bases). En el siglo XVIII, se reconoció que los ácidos tienen un sabor agrio, reaccionan con la piedra caliza para liberar una sustancia gaseosa (ahora conocida como CO 2 ) e interactúan con los álcalis para formar sustancias neutras. En 1815, Humphry Davy contribuyó en gran medida al desarrollo del concepto ácido-base moderno al demostrar que el hidrógeno es el componente esencial de los ácidos. Por esa misma época, Joseph Louis Gay-Lussac concluyó que los ácidos son sustancias que pueden neutralizar las bases y que estas dos clases de sustancias solo pueden definirse entre sí. El significado del hidrógeno fue enfatizado en 1884 cuando Svante Arrhenius definió un ácido como un compuesto que se disuelve en agua para producir cationes de hidrógeno (ahora reconocidos como iones hidronio) y una base como un compuesto que se disuelve en agua para producen aniones de hidróxido.
Anteriormente, definimos ácidos y bases como lo hizo Arrhenius: un ácido es un compuesto que se disuelve en agua para producir iones de hidronio ( (H_3O ^ + )) y una base como un compuesto que se disuelve en agua para producir iones de hidróxido ( ( ce {OH -} )). Esta definición no está mal; Es simplemente limitado. Ampliamos la definición de un ácido o una base utilizando la definición más general propuesta en 1923 por el químico danés Johannes Brønsted y el químico inglés Thomas Lowry. Su definición se centra en el protón, ( ce {H ^ +} ). Un protón es lo que queda cuando un átomo de hidrógeno normal, ( ce {^ 1_1H} ), pierde un electrón. Un compuesto que dona un protón a otro compuesto se llama ácido Brønsted-Lowry, y un compuesto que acepta un protón se llama base Brønsted-Lowry. Una reacción ácido-base es la transferencia de un protón de un donante de protones (ácido) a un aceptor de protones (base). En un capítulo posterior de este texto, presentaremos el modelo más general de comportamiento ácido-base presentado por el químico estadounidense G. N. Lewis.
Los ácidos pueden ser compuestos como (HCl ) o (H_2SO_4 ), ácidos orgánicos como el ácido acético ( ( ce {CH_3COOH} )) o ácido ascórbico (vitamina C) o (H_2O ) Aniones (como ( ce {HSO_4 ^ -} ), ( ce {H_2PO_4 ^ -} ), ( ce {HS ^ -} ) y ( ce {HCO_3 ^ -} )) y cationes (como ( ce {H_3O ^ +} ), ( ce {NH_4 ^ +} ) y ( ce {[Al (H_2O) _6] ^ {3+} } )) también puede actuar como ácidos. Las bases se dividen en las mismas tres categorías. Las bases pueden ser moléculas neutras (como ( ce {H_2O} ), ( ce {NH_3} ) y ( ce {CH_3NH_2} )), aniones (como ( ce {OH ^ -} ), ( ce {HS ^ -} ), ( ce {HCO_3 ^ -} ), ( ce {CO_3 ^ {2 -}} ), ( ce { F ^ -} ), y ( ce {PO_4 ^ {3 -}} )), o cationes (como ( ce {[Al (H_2O) _5OH] ^ {2 +}} )) . Las bases más conocidas son compuestos iónicos como ( ce {NaOH} ) y ( ce {Ca (OH) _2} ), que contienen el ion hidróxido, ( ce {OH ^ -} ) . El ion hidróxido en estos compuestos acepta un protón de los ácidos para formar agua:
[ ce {H ^ + + OH ^ – rightarrow H_2O} label {16.2.1} ]
Llamamos al producto que queda después de que un ácido dona un protón la base conjugada del ácido. Esta especie es una base porque puede aceptar un protón (para volver a formar el ácido):
[ text {acid} rightleftharpoons text {proton} + text {conjugate base} label {16.2.2a} ]
[ ce {HF rightleftharpoons H ^ + + F ^ -} label {16.2.2b} ]
[ ce {H_2SO_4 rightleftharpoons H ^ + + HSO_4 ^ {-}} label {16.2.2c} ]
[ ce {H_2O rightleftharpoons H ^ + + OH ^ -} label {16.2.2d} ]
[ ce {HSO_4 ^ – rightleftharpoons H ^ + + SO_4 ^ {2 -}} label {16.2.2e} ]
[ ce {NH_4 ^ + rightleftharpoons H ^ + + NH_3} label {16.2.2f} ]
Llamamos al producto que resulta cuando una base acepta un protón, el ácido conjugado de la base . Esta especie es un ácido porque puede ceder un protón (y así volver a formar la base):
[ text {base} + text {proton} rightleftharpoons text {conjugate acid} label {16.2.3a} ]
[ ce {OH ^ – + H ^ + rightleftharpoons H2O} label {16.2.3b} ]
[ ce {H_2O + H ^ + rightleftharpoons H3O +} label {16.2.3c} ]
[ ce {NH_3 + H ^ + rightleftharpoons NH4 +} label {16.2.3d} ]
[ ce {S ^ {2-} + H ^ + rightleftharpoons HS -} label {16.2.3e} ]
[ ce {CO_3 ^ {2-} + H ^ + rightleftharpoons HCO3 -} label {16.2.3f} ]
[ ce {F ^ – + H ^ + rightleftharpoons HF} label {16.2.3g} ]
En estos dos conjuntos de ecuaciones, los comportamientos de los ácidos como donantes de protones y las bases como aceptores de protones se representan de forma aislada. En realidad, todas las reacciones ácido-base implican la transferencia de protones entre ácidos y bases. Por ejemplo, considere la reacción ácido-base que tiene lugar cuando el amoniaco se disuelve en agua. Una molécula de agua (que funciona como un ácido) transfiere un protón a una molécula de amoníaco (que funciona como una base), produciendo la base conjugada de agua, ( ce {OH ^ -} ), y el ácido conjugado de amoníaco, ( ce {NH4 +} ):
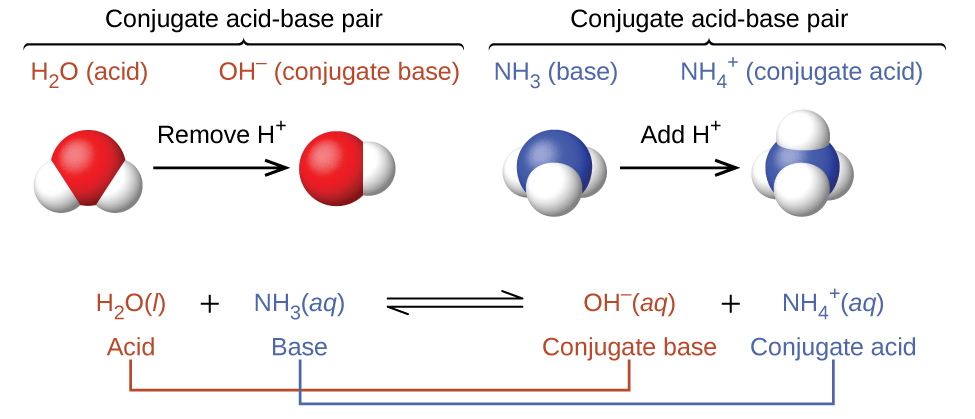
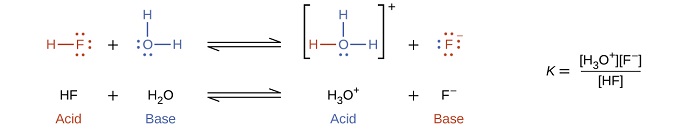
La reacción entre un ácido de Brønsted-Lowry y el agua se llama ionización de ácido . Por ejemplo, cuando el fluoruro de hidrógeno se disuelve en agua e ioniza, los protones se transfieren de las moléculas de fluoruro de hidrógeno a las moléculas de agua, produciendo iones hidronio e iones fluoruro:
Cuando agregamos una base al agua, se produce una reacción de ionización de bases en la que los protones se transfieren de las moléculas de agua a las moléculas de la base. Por ejemplo, al agregar piridina al agua se obtienen iones de hidróxido e iones de piridinio:
‘ class=”internal default” height=”167″ width=”612″ src=”https://chem.libretexts.org/@api/deki/files/56740/CNX_Chem_14_01_NH3_img.jpg?revision=1″>
Observe que ambas reacciones de ionización se representan como procesos de equilibrio. El grado relativo en el que se producen estas reacciones de ionización de ácido y base es un tema importante tratado en una sección posterior de este capítulo. En los párrafos anteriores vimos que el agua puede funcionar como ácido o como base, dependiendo de la naturaleza del soluto disuelto en ella. De hecho, en agua pura o en cualquier solución acuosa, el agua actúa como ácido y como base. Una fracción muy pequeña de moléculas de agua dona protones a otras moléculas de agua para formar iones hidronio e iones hidróxido:
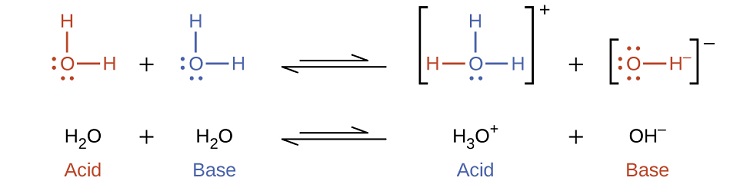
Este tipo de reacción, en la que una sustancia se ioniza cuando una molécula de la sustancia reacciona con otra molécula de la misma sustancia, se conoce como autoionización . El agua pura se somete a autoionización en un grado muy leve. Solo alrededor de dos de cada (10 ^ 9 ) moléculas en una muestra de agua pura se ionizan a 25 ° C. La constante de equilibrio para la ionización del agua se llama constante del producto iónico para el agua ( K w ):
[ ce {H_2O} _ {(l)} + ce {H_2O} _ {(l)} rightleftharpoons ce {H_3O ^ +} _ {(aq)} + ce {OH ^ – } _ {(aq)} ; ; ; K_ ce {w} = ce {[H_3O ^ +] [OH ^ -]} label {16.2.4} ]
La ligera ionización del agua pura se refleja en el pequeño valor de la constante de equilibrio; a 25 ° C, Kw tiene un valor de (1.0 times 10 ^ {- 14} ). El proceso es endotérmico, por lo que el grado de ionización y las concentraciones resultantes de ion hidronio e ion hidróxido aumentan con la temperatura. Por ejemplo, a 100 ° C, el valor de (K_ ce {w} ) es aproximadamente (5.1 veces 10 ^ {- 13} ), aproximadamente 100 veces mayor que el valor a 25 ° C.
El producto iónico del agua a 80 ° C es (2.4 times 10 ^ {- 13} ). ¿Cuáles son las concentraciones de iones hidronio e hidróxido en agua pura a 80 ° C?
( ce {[H_3O ^ +]} = ce {[OH ^ -]} = 4.9 veces 10 ^ {- 7} ; M )
Es importante darse cuenta de que el equilibrio de autoionización para el agua se establece en todas las soluciones acuosas. Agregar un ácido o una base al agua no cambiará la posición del equilibrio. El ejemplo 16.2.2 demuestra los aspectos cuantitativos de esta relación entre las concentraciones de iones hidronio e hidróxido.
¿Cuál es la concentración de iones hidronio en una solución acuosa con una concentración de iones hidróxido de 0.001 M a 25 ° C?
[ ce {[H3O +]} = 1 por 10 ^ {- 11} M ]
Especies anfibróticas
Al igual que el agua, muchas moléculas e iones pueden ganar o perder un protón en las condiciones adecuadas. Dichas especies se dice que son anfibróticas . Otro término usado para describir tales especies es anfótero , que es un término más general para una especie que puede actuar como un ácido o una base por cualquier definición (no solo la de Brønsted-Lowry). Considere, por ejemplo, el ion bicarbonato, que puede donar o aceptar un protón como se muestra aquí:
[ ce {HCO ^ -} _ {3 (aq)} + ce {H_2O} _ {(l)} rightleftharpoons ce {CO ^ {2 -}} _ {3 (aq)} + ce {H_3O ^ +} _ {(aq)} label {16.2.5a} ]
[ ce {HCO ^ -} _ {3 (aq)} + ce {H_2O} _ {(l)} rightleftharpoons ce {H_2CO} _ {3 (aq)} + ce { OH ^ -} _ {(aq)} label {16.2.5b} ]
Escribe ecuaciones separadas que representen la reacción de ( ce {H2PO4 -} )
- como base con HBr
- como un ácido con ( ce {OH ^ -} )
- (H_2PO_ {4 (aq)} ^ – + HBr _ {(aq)} rightleftharpoons H_3PO_ {4 (aq)} + Br ^ -_ {(aq)} )
- (H_2PO_ {4 (aq)} ^ – + OH ^ -_ {(aq)} rightleftharpoons HPO_ {4 (aq)} ^ {2-} + H_2O _ {(l)} )
Resumen
Un compuesto que puede donar un protón (un ion de hidrógeno) a otro compuesto se llama ácido Brønsted-Lowry. El compuesto que acepta el protón se llama base Brønsted-Lowry. La especie que queda después de que un ácido de Brønsted-Lowry ha perdido un protón es la base conjugada del ácido. La especie formada cuando una base Brønsted-Lowry gana un protón es el ácido conjugado de la base. Así, una reacción ácido-base ocurre cuando un protón se transfiere de un ácido a una base, con la formación de la base conjugada del ácido reactivo y la formación del ácido conjugado de la base reactiva. Las especies anfibróticas pueden actuar como donantes de protones y aceptores de protones. El agua es la especie anfibrótica más importante. Puede formar tanto el ion hidronio, H 3 O + , como el ion hidróxido, ( ce {OH ^ -} ) cuando se somete a autoionización:
[ ce {2 H_2O} _ {(l)} rightleftharpoons H_3O ^ + _ {(aq)} + OH ^ -_ {(aq)} ]
El producto iónico del agua, K w es la constante de equilibrio para la reacción de autoionización:
[K_ ce {w} = mathrm {[H_2O ^ +] [OH ^ -] = 1.0 veces 10 ^ {- 14} ; a; 25 ° C} ]
Ecuaciones clave
- [K _ { ce w} = ce {[H3O +] [OH ^ -]} = 1.0 veces 10 ^ {- 14} textrm {(a 25 ° C)} ]
Glosario
- ionización ácida
- reacción que implica la transferencia de un protón de un ácido al agua, produciendo iones hidronio y la base conjugada del ácido
- anfibrótico
- especies que pueden ganar o perder un protón en una reacción
- anfótero
- especies que pueden actuar como ácido o como base
- autoionización
- reacción entre especies idénticas que producen productos iónicos; para el agua, esta reacción implica la transferencia de protones para producir iones hidronio e hidróxido
- ionización base
- reacción que implica la transferencia de un protón del agua a una base, produciendo iones de hidróxido y el ácido conjugado de la base
- Ácido Brønsted-Lowry
- donante de protones
- Base Brønsted-Lowry
- aceptor de protones
- ácido conjugado
- sustancia formada cuando una base gana un protón
- base conjugada
- sustancia formada cuando un ácido pierde un protón
- constante de producto iónico para agua ( K w )
- constante de equilibrio para la autoionización del agua
