El producto de solubilidad de un compuesto iónico describe las concentraciones de iones en equilibrio con un sólido, pero ¿qué sucede si algunos de los cationes se asocian con aniones en lugar de estar completamente rodeados de solvente? Luego, las predicciones de la solubilidad total del compuesto basadas en el supuesto de que el soluto existe únicamente como iones discretos diferirían sustancialmente de la solubilidad real, al igual que las predicciones de las concentraciones iónicas. En general, cuatro situaciones explican por qué la solubilidad de un compuesto puede ser diferente a la esperada: formación de pares de iones, disociación incompleta de solutos moleculares, formación de iones complejos y cambios en el pH.
Formación de pares iónicos
Un par de iones consiste en un catión y un anión que están en contacto íntimo en solución, en lugar de estar separados por disolvente ( Figura ( PageIndex {1} ) ) . Los iones en un par de iones se mantienen unidos por la misma fuerza electrostática atractiva en los sólidos iónicos. Como resultado, los iones en un par de iones migran como una sola unidad, cuya carga neta es la suma de las cargas de los iones. En muchos sentidos, podemos ver un par de iones como una especie intermedia entre el sólido iónico (en el que cada ion participa en muchas interacciones catión-anión que mantienen los iones en una matriz rígida) y los iones completamente disociados en solución (donde cada uno es completamente rodeado de moléculas de agua y libre para migrar independientemente).
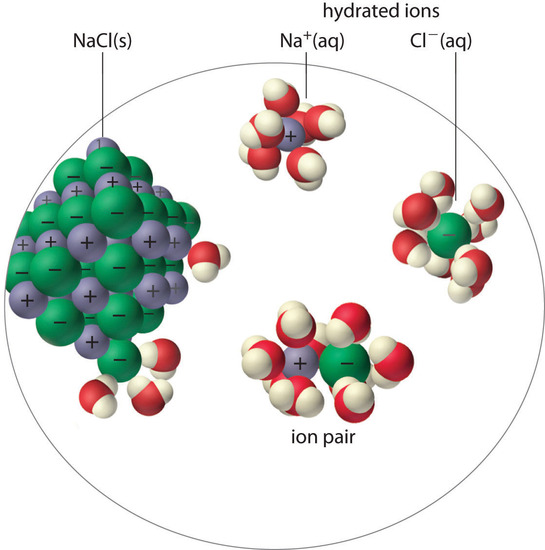
Como se ilustra para el sulfato de calcio en la siguiente ecuación, se debe incluir un segundo equilibrio para describir la solubilidad de las sales que forman pares de iones:
[ mathrm {CaSO_4 (s)} rightleftharpoons underbrace { mathrm {Ca ^ {2 +}} cdot mathrm {SO_4 ^ {2 -} (aq)}} _ { textrm {ion par}} rightleftharpoons mathrm {Ca ^ {2 +} (aq)} + mathrm {SO_4 ^ {2 -} (aq)} label {17.5.3.1} ]
El par de iones está representado por los símbolos de los iones individuales separados por un punto, lo que indica que están asociados en solución. La formación de un par iónico es un proceso dinámico, al igual que cualquier otro equilibrio, por lo que un par iónico particular puede existir solo brevemente antes de disociarse en los iones libres, cada uno de los cuales puede asociarse brevemente con otros iones.
La formación de pares de iones puede tener un efecto importante sobre la solubilidad medida de una sal. Por ejemplo, la K sp medida para sulfato de calcio es 4,93 × 10 −5 a 25 ° C. La solubilidad de CaSO 4 debería ser 7.02 × 10 −3 M si el único equilibrio involucrado fuera el siguiente:
[CaSO_ {4 (s)} rightleftharpoons Ca ^ {2 +} _ {(aq)} + SO ^ {2 -} _ {4 (aq)} label {17.5.2} ] [ 19459010]
De hecho, la solubilidad medida experimentalmente del sulfato de calcio a 25 ° C es 1.6 × 10 −2 M, casi el doble del valor predicho de su K sp [ 19459027]. La razón de la discrepancia es que la concentración de pares de iones en una solución saturada de CaSO 4 es casi tan alta como la concentración de los iones hidratados. Recuerde que la magnitud de las interacciones electrostáticas atractivas es mayor para los iones pequeños y altamente cargados. Por lo tanto, la formación de pares de iones es más importante para las sales que contienen M 2 + y M 3 + iones, como Ca 2 + y La 3 + , y es relativamente poco importante para las sales que contienen cationes monopositivos, excepto el más pequeño, Li + [ 19459029]. Por lo tanto, esperamos que una solución saturada de CaSO 4 contenga una alta concentración de pares de iones y su solubilidad sea mayor de lo previsto en su K sp .
La formación de pares de iones aumenta la solubilidad de una sal.
Disociación incompleta
Un soluto molecular también puede ser más soluble de lo previsto por las concentraciones medidas de iones en solución debido a una disociación incompleta. Esto es particularmente común con ácidos orgánicos débiles. Aunque los ácidos fuertes (HA) se disocian completamente en sus iones constituyentes (H + y A – ) en agua, los ácidos débiles como los ácidos carboxílicos no ( K a = 1,5 × 10 −5 ). Sin embargo, la forma molecular (no disociada) de un ácido débil (HA) a menudo es bastante soluble en agua; por ejemplo, el ácido acético (CH 3 CO 2 H) es completamente miscible con agua. Sin embargo, muchos ácidos carboxílicos tienen una solubilidad limitada en agua, como el ácido benzoico (C 6 H 5 CO 2 H), con K a = 6,25 × 10 −5 . Al igual que con el sulfato de calcio, debemos incluir un equilibrio adicional para describir la solubilidad del ácido benzoico:
[C_6H_5CO_2H _ {(s)} rightleftharpoons C_6H_5CO_2H _ {(aq)} rightleftharpoons C_6H_5CO ^ −_ {2 (aq)} + H ^ + _ {(aq)} label {17.5.3} ]
En un caso como este, medir solo la concentración de los iones subestima enormemente la concentración total del ácido orgánico en solución. En el caso del ácido benzoico, por ejemplo, el pH de una solución saturada a 25 ° C es 2.85, correspondiente a [H + ] = [C 6 H 5 CO 2 – ] = 1.4 × 10 −3 M. Sin embargo, la concentración total de ácido benzoico en la solución es 2.8 × 10 [ 19459028] −2 M. Así, aproximadamente el 95% del ácido benzoico en solución está en forma de moléculas neutras hidratadas – (C_6H_5CO_2H _ {(aq)} ) – y solo alrededor del 5% está presente como iones disociados ( Figura ( PageIndex {2} ) ).
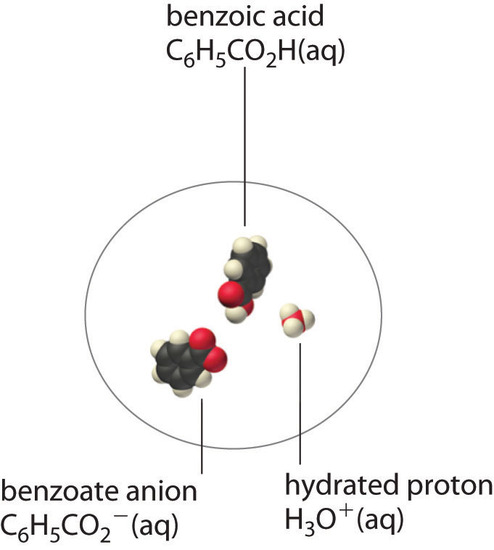
Aunque pares de iones, como Ca 2 + · SO 4 2− , y electrolitos no disociados, como C [ 19459026] 6 H 5 CO 2 H, ambos son eléctricamente neutros, hay una gran diferencia en las fuerzas responsables de su formación. Las fuerzas atractivas electrostáticas simples entre el catión y el anión mantienen unido el par iónico, mientras que un enlace O-H covalente polar mantiene unido el electrolito no disociado.
La disociación incompleta de un soluto molecular que es miscible con agua puede aumentar la solubilidad del soluto.
Formación de iones complejos
Anteriormente, aprendiste que los iones metálicos en solución acuosa están hidratados, es decir, rodeados por un caparazón de cuatro o seis moléculas de agua. Un ion hidratado es un tipo de ion complejo (o, simplemente, complejo), una especie formada entre un ion metálico central y uno o más ligandos circundantes , moléculas o iones que contienen al menos un par solitario de electrones, como el ion [Al (H 2 O) 6 ] 3+ .
Se forma un ión complejo a partir de un ión metálico y un ligando debido a una interacción ácido-base de Lewis. El ion metálico cargado positivamente actúa como un ácido de Lewis, y el ligando, con uno o más pares de electrones solitarios, actúa como una base de Lewis. Los iones metálicos pequeños y altamente cargados, como Cu 2 + o Ru 3 + , tienen la mayor tendencia a actuar como ácidos de Lewis y, en consecuencia, tienen la mayor tendencia a formar iones complejos.
Como ejemplo de la formación de iones complejos, considere la adición de amoníaco a una solución acuosa del Cu hidratado 2 + ion {[Cu (H 2) O) 6 ] 2+ }. Debido a que es una base más fuerte que H 2 O, el amoníaco reemplaza las moléculas de agua en el ion hidratado para formar el [Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ ion. Formación del complejo [Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ se acompaña de un cambio dramático de color, como se muestra en Figura ( PageIndex {1} ) . La solución cambia del azul claro de [Cu (H 2 O) 6 ] 2+ a la característica azul-violeta del [Cu (NH [ 19459026] 3 ) 4 (H 2 O) 2 ] 2+ ion.
La constante de formación
La sustitución de las moléculas de agua de [Cu (H 2 O) 6 ] 2+ se produce en pasos secuenciales. Omitiendo las moléculas de agua unidas a Cu 2 + por simplicidad, podemos escribir las reacciones de equilibrio de la siguiente manera:
[ begin {align} mathrm {Cu ^ {2 +} (aq)} + mathrm {NH_ {3 (aq)}} & rightleftharpoons mathrm {[Cu (NH_3)] ^ ^ 2 +} _ {(aq)}} hspace {5mm} K_1
\ mathrm {[Cu (NH_3)] ^ {2 +} _ {(aq)}} + mathrm {NH_ {3 (aq )}} & rightleftharpoons mathrm {[Cu (NH_3) _2] ^ {2 +} _ {(aq)}} hspace {3mm} K_2
\ mathrm {[Cu (NH_3) _2] ^ {2 +} _ {(aq)}} + mathrm {NH_ {3 (aq)}} & rightleftharpoons mathrm {[Cu (NH_3) _3] ^ {2 +} _ {(aq)}} hspace {3mm} K_3
\ mathrm {[Cu (NH_3) _3] ^ {2 +} _ {(aq)}} + mathrm {NH_ {3 (aq)}} & rightleftharpoons mathrm {[ Cu (NH_3) _4] ^ {2 +} _ {(aq)}} hspace {3mm} K_4 end {align} label {17.3.1} ]
La suma de las reacciones escalonadas es la ecuación general para la formación del ion complejo: El ion hidratado Cu 2 + contiene seis H 2 O ligandos, pero el ion complejo que se produce contiene solo cuatro ligandos (NH_3 ), no seis.
[Cu ^ {2 +} _ {(aq)} + 4NH_ {3 (aq)} rightleftharpoons [Cu (NH_3) _4] ^ {2 +} _ {(aq)} label {17.3. 2} ]
La constante de equilibrio para la formación del ion complejo a partir del ion hidratado se denomina constante de formación ( K f ) . La expresión constante de equilibrio para K f tiene la misma forma general que cualquier otra expresión constante de equilibrio. En este caso, la expresión es la siguiente:
[K_ textrm f = dfrac { left [[ mathrm {Cu (NH_3) _4}] ^ {2 +} right]} {[ mathrm {Cu ^ {2 +}}] [ mathrm {NH_3}] ^ 4} = 2.1 times10 ^ {13} = K_1K_2K_3K_4 label {17.3.3} ]
La constante de formación ( K f ) tiene la misma forma general que cualquier otra expresión de equilibrio constante.
El agua, un líquido puro, no aparece explícitamente en la expresión de equilibrio constante, y el ion hidratado Cu 2 + (aq) se representa como Cu 2 [ 19459029] + por simplicidad. En cuanto a cualquier equilibrio, cuanto mayor sea el valor de la constante de equilibrio (en este caso, K f ), más estable será el producto. Con K f = 2,1 × 10 13 , el [Cu (NH 3 ) 4 (H [ 19459026] 2 O) 2 ] 2+ el ion complejo es muy estable. Las constantes de formación para algunos iones complejos comunes se enumeran en Tabla ( PageIndex {1} ) .
| Iones complejos | Ecuación de equilibrio | K f | |
|---|---|---|---|
| * Los valores informados son constantes de formación generales. Fuente: Datos de Lange’s Handbook of Chemistry , 15ª ed. (1999)
|
|||
| Complejos de amoníaco | [Ag (NH 3 ) 2 ] + | Ag + + 2NH 3 ⇌ [Ag (NH 3 ) 2 ] + [19459064 ] |
1,1 × 10 7 |
| [Cu (NH 3 ) 4 ] 2+ | Cu 2 + + 4NH 3 ⇌ [Cu (NH 3 ) 4 ] ] 2+ | 2,1 × 10 13 | |
| [Ni (NH 3 ) 6 ] 2+ | Ni 2 + + 6NH 3 ⇌ [Ni (NH 3 ) 6 ] ] 2+ | 5,5 × 10 8 | |
| Complejos de cianuro | [Ag (CN) 2 ] – | Ag + + 2CN – ⇌ [Ag (CN) 2 ] – | 1,1 × 10 18 |
| [Ni (CN) 4 ] 2− | Ni 2 + + 4CN – ⇌ [Ni (CN) 4 ] 2− [ 19459064] |
2,2 × 10 31 | |
| [Fe (CN) 6 ] 3− | Fe 3 + + 6CN – ⇌ [Fe (CN) 6 ] 3− [ 19459064] |
1 × 10 42 | |
| Complejos de hidróxido | [Zn (OH) 4 ] 2− | Zn 2 + + 4OH – ⇌ [Zn (OH) 4 ] 2− [ 19459064] |
4,6 × 10 17 |
| [Cr (OH) 4 ] – | Cr 3 + + 4OH – ⇌ [Cr (OH) 4 ] – | 8,0 × 10 29 | |
| Complejos de haluro | [HgCl 4 ] 2− | Hg 2 + + 4Cl – ⇌ [HgCl 4 ] 2− | 1,2 × 10 15 |
| [CdI 4 ] 2− | Cd 2 + + 4I ⇌ [CdI 4 ] 2− | 2,6 × 10 5 | |
| [AlF 6 ] 3− | Al 3 + + 6F – ⇌ [AlF 6 ] 3− | 6,9 × 10 19 | |
| Otros complejos | [Ag (S 2 O 3 ) 2 ] 3− | Ag + + 2S 2 O 3 2− ⇌ [Ag (S 2 O [ 19459026] 3 ) 2 ] 3− | 2,9 × 10 13 |
| [Fe (C 2 O 4 ) 3 ] 3− | Fe 3 + + 3C 2 O 4 2− ⇌ [Fe (C [19459026 ] 2 O 4 ) 3 ] 3− | 2,0 × 10 20 | |
El efecto de la formación de iones complejos en la solubilidad
¿Qué sucede con la solubilidad de una sal escasamente soluble si se agrega a la solución un ligando que forma un ion complejo estable? Un ejemplo de este tipo ocurre en la fotografía convencional en blanco y negro. Recuerde que la película fotográfica en blanco y negro contiene microcristales sensibles a la luz de AgBr, o mezclas de AgBr y otros haluros de plata. AgBr es una sal escasamente soluble, con una K sp de 5,35 × 10 −13 a 25 ° C. Cuando se abre el obturador de la cámara, la luz del objeto que se está fotografiando golpea algunos de los cristales en la película e inicia una reacción fotoquímica que convierte AgBr en Ag negro metal. Las imágenes negativas estables y bien formadas aparecen en tonos de gris, que corresponden al número de granos de AgBr convertidos, y las áreas expuestas a la mayor cantidad de luz son las más oscuras. Para arreglar la imagen y evitar que más cristales de AgBr se conviertan en metal Ag durante el procesamiento de la película, el AgBr sin reaccionar en la película se elimina mediante una reacción de complejación para disolver la sal escasamente soluble.
La reacción para la disolución del bromuro de plata es la siguiente:
[AgBr _ {(s)} rightleftharpoons Ag ^ + _ {(aq)} + Br ^ {-} _ {(aq)} label {17.3.4a} ]
con
[K_ {sp} = 5.35 veces 10 ^ {- 13} text {a 25 ° C} label {17.3.4b} ]
El equilibrio se encuentra muy a la izquierda, y las concentraciones de equilibrio de Ag + y Br – iones son muy bajas (7.31 × 10 −7 M ) Como resultado, eliminar AgBr sin reaccionar incluso de un solo rollo de película usando agua pura requeriría decenas de miles de litros de agua y una gran cantidad de tiempo. El principio de Le Châtelier nos dice, sin embargo, que podemos impulsar la reacción hacia la derecha eliminando uno de los productos, lo que hará que se disuelva más AgBr. El ion bromuro es difícil de eliminar químicamente, pero el ion plata forma una variedad de complejos de dos coordenadas estables con ligandos neutros, como el amoníaco, o con ligandos aniónicos, como el cianuro o el tiosulfato (S 2 O [19459026 ] 3 2− ). En el procesamiento fotográfico, el exceso de AgBr se disuelve usando una solución concentrada de tiosulfato de sodio.
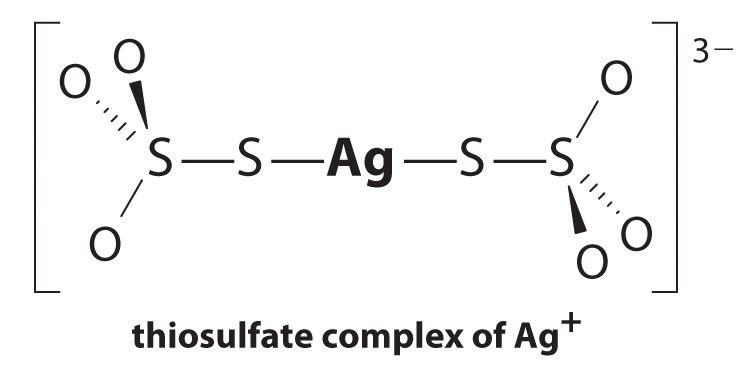
La reacción de Ag + con tiosulfato es la siguiente:
[Ag ^ + _ {(aq)} + 2S_2O ^ {2 -} _ {3 (aq)} rightleftharpoons [Ag (S_2O_3) _2] ^ {3 -} _ {(aq)} label {17.3.5a} ]
con
[K_f = 2.9 times 10 ^ {13} label {17.3.5b} ]
La magnitud de la constante de equilibrio indica que casi todos los iones Ag + en solución serán complejados inmediatamente por tiosulfato para formar [Ag (S 2 O 3 [19459027 ]) 2 ] 3− . Podemos ver el efecto del tiosulfato en la solubilidad de AgBr al escribir las reacciones apropiadas y sumarlas:
( begin {align} mathrm {AgBr (s)} rightleftharpoons mathrm {Ag ^ + (aq)} + mathrm {Br ^ – (aq)} hspace {3mm} K _ { textrm {sp}} & = 5.35 times10 ^ {- 13}
\ mathrm {Ag ^ + (aq)} + mathrm {2S_2O_3 ^ {2 -} (aq)} rightleftharpoons mathrm {[Ag (S_2O_3) _2] ^ {3 -} (aq)} hspace {3mm} K_ textrm f & = 2.9 times10 ^ {13}
\ mathrm {AgBr (s)} + mathrm {2S_2O_3 ^ {2 -} (aq)} rightleftharpoons mathrm {[Ag (S_2O_3) _2] ^ {3 -} (aq)} + mathrm {Br ^ – (aq)} hspace {3mm} K & = K _ { textrm {sp}} K _ { textrm f} = 15 end {align} label {17.3.6} )
Comparando K con K sp muestra que la formación del ion complejo aumenta la solubilidad de AgBr en aproximadamente 3 × 10 13 [19459029 ] El aumento dramático en la solubilidad combinado con el bajo costo y la baja toxicidad explica por qué el tiosulfato de sodio se usa casi universalmente para desarrollar películas en blanco y negro. Si se desea, la plata se puede recuperar de la solución de tiosulfato usando cualquiera de varios métodos y reciclar.
Si un ion complejo tiene una gran K f , la formación de un ion complejo puede aumentar drásticamente la solubilidad de las sales poco solubles.
Complexing agents, molecules or ions that increase the solubility of metal salts by forming soluble metal complexes, are common components of laundry detergents. Long-chain carboxylic acids, the major components of soaps, form insoluble salts with Ca 2 + and Mg 2 + , which are present in high concentrations in “hard” water. The precipitation of these salts produces a bathtub ring and gives a gray tinge to clothing. Adding a complexing agent such as pyrophosphate (O 3 POPO 3 4− , or P 2 O 7 4− ) or triphosphate (P 3 O 10 5− ) to detergents prevents the magnesium and calcium salts from precipitating because the equilibrium constant for complex-ion formation is large:
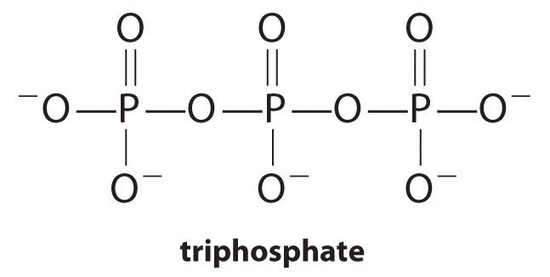
[Ca^{2+}_{(aq)} + O_3POPO^{4−}_{4(aq)} rightleftharpoons [Ca(O_3POPO_3)]^{2−}_{(aq)} label{17.3.7a}]
con
[K_f = 4times 10^4label{17.3.7b}]
However, phosphates can cause environmental damage by promoting eutrophication, the growth of excessive amounts of algae in a body of water, which can eventually lead to large decreases in levels of dissolved oxygen that kill fish and other aquatic organisms. Consequently, many states in the United States have banned the use of phosphate-containing detergents, and France has banned their use beginning in 2007. “Phosphate-free” detergents contain different kinds of complexing agents, such as derivatives of acetic acid or other carboxylic acids. The development of phosphate substitutes is an area of intense research.
Commercial water softeners also use a complexing agent to treat hard water by passing the water over ion-exchange resins, which are complex sodium salts. When water flows over the resin, sodium ion is dissolved, and insoluble salts precipitate onto the resin surface. Water treated in this way has a saltier taste due to the presence of Na + , but it contains fewer dissolved minerals.
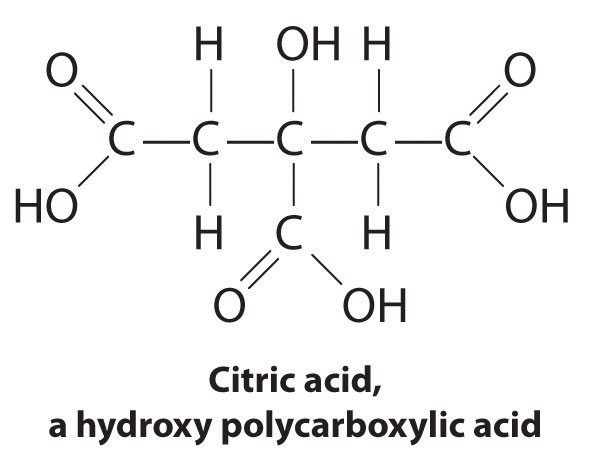
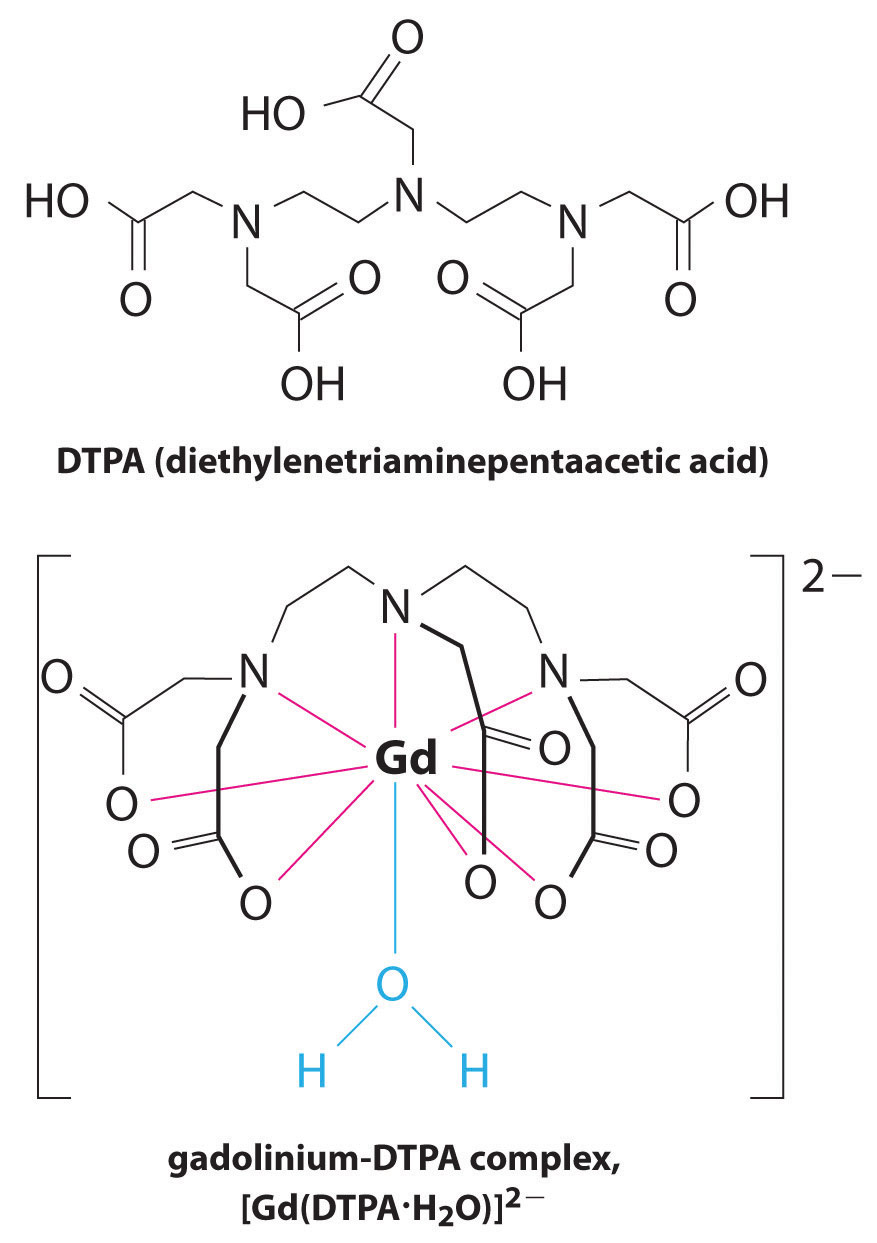
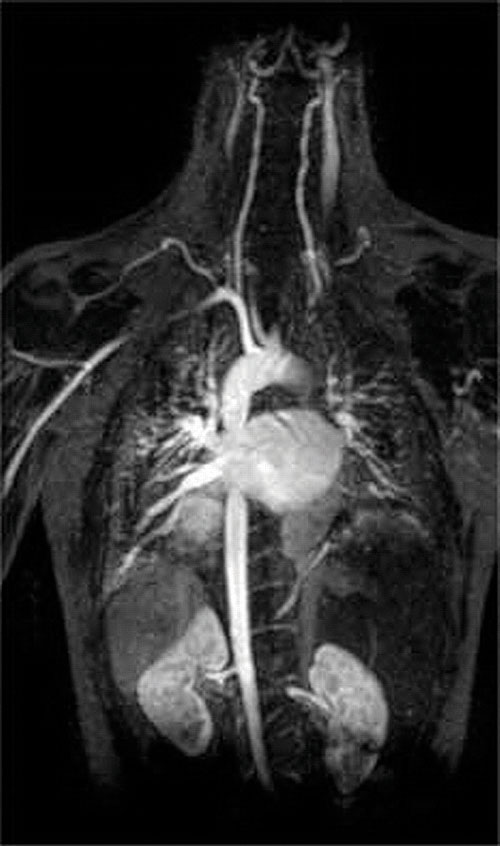
Another application of complexing agents is found in medicine. Unlike x-rays, magnetic resonance imaging (MRI) can give relatively good images of soft tissues such as internal organs. MRI is based on the magnetic properties of the 1 H nucleus of hydrogen atoms in water, which is a major component of soft tissues. Because the properties of water do not depend very much on whether it is inside a cell or in the blood, it is hard to get detailed images of these tissues that have good contrast. To solve this problem, scientists have developed a class of metal complexes known as “MRI contrast agents.” Injecting an MRI contrast agent into a patient selectively affects the magnetic properties of water in cells of normal tissues, in tumors, or in blood vessels and allows doctors to “see” each of these separately ( Figure (PageIndex{4}) ). One of the most important metal ions for this application is Gd 3 + , which with seven unpaired electrons is highly paramagnetic. Because Gd 3 + (aq) is quite toxic, it must be administered as a very stable complex that does not dissociate in the body and can be excreted intact by the kidneys. The complexing agents used for gadolinium are ligands such as DTPA 5− (diethylene triamine pentaacetic acid), whose fully protonated form is shown here.
Summary
Ion-pair formation, the incomplete dissociation of molecular solutes, the formation of complex ions, and changes in pH all affect solubility. There are four explanations why the solubility of a compound can differ from the solubility indicated by the concentrations of ions: (1) ion pair formation, in which an anion and a cation are in intimate contact in solution and not separated by solvent, (2) the incomplete dissociation of molecular solutes, (3) the formation of complex ions, and (4) changes in pH. An ion pair is held together by electrostatic attractive forces between the cation and the anion, whereas incomplete dissociation results from intramolecular forces, such as polar covalent O–H bonds.
The formation of complex ions can substantially increase the solubility of sparingly soluble salts if the complex ion has a large K f . A complex ion is a species formed between a central metal ion and one or more surrounding ligands, molecules or ions that contain at least one lone pair of electrons. Small, highly charged metal ions have the greatest tendency to act as Lewis acids and form complex ions. The equilibrium constant for the formation of the complex ion is the formation constant ( K f ). The formation of a complex ion by adding a complexing agent increases the solubility of a compound.