El agua es el recurso más importante. Sin agua la vida no es posible. Desde un punto de vista químico, el agua, H 2 O, es un compuesto puro, pero en realidad, rara vez bebes, ves, tocas o usas agua pura. El agua de varias fuentes contiene gases disueltos, minerales, sustancias orgánicas e inorgánicas.
La hidrosfera
El sistema total de agua que rodea el planeta Tierra se llama hidrosfera . Incluye sistemas de agua dulce, océanos, vapor de la atmósfera y aguas biológicas. Los océanos Ártico, Atlántico, Índico y Pacífico cubren el 71% de la superficie terrestre y contienen el 97% de toda el agua. Menos del 1% es agua dulce, y el 2-3% es hielo y glaciares. La capa de hielo antártico es casi del tamaño del continente de América del Norte. Estas aguas dominan nuestro clima y clima, afectando directa e indirectamente nuestra vida cotidiana. Cubren 3.35×10 8 km 2 . Los cuatro océanos tienen un volumen total de 1.35×10 9 km 3 .
- La luz solar se atenúa en 1/10 por cada 75 m en el océano, y los humanos apenas ven la luz por debajo de 500 m. La temperatura de casi todo el océano profundo es de 4 ° C (277 K).
- La profundidad promedio del océano es de 4 km, y el punto más profundo en la Fosa de las Marianas es de 10,912 m (35,802 pies), lo que se compara con la altura de 8,8 km para el Monte Everest.
Los procesos hidrosféricos son pasos por los cuales el agua realiza ciclos en el planeta Tierra. Estos procesos incluyen sublimación de hielo, evaporación de líquido, transporte de humedad por aire, lluvia, nieve, río, lago y corrientes oceánicas. Todos estos procesos están relacionados con las propiedades físicas y químicas del agua, y muchas agencias gubernamentales están configuradas para estudiar y registrar fenómenos relacionados con ellas. El estudio de estos procesos se llama hidrología
Entre los planetas, la Tierra es el único en el que hay aguas sólidas, líquidas y gaseosas. Estas condiciones son adecuadas para la vida, para las cuales el agua es una parte vital. El agua es la sustancia más abundante en la biosfera de la Tierra. El agua subterránea es una parte importante del sistema de agua. Cuando el vapor se enfría, se desarrollan nubes y lluvia. Parte de la lluvia se filtra a través del suelo hacia las rocas subyacentes. El agua en las rocas es agua subterránea , que se mueve lentamente.
Un cuerpo de roca, que contiene cantidades apreciables de agua, se llama un acuífero . Debajo de la capa freática , el acuífero se llena (o satura) con agua. Sobre la capa freática se encuentra la zona no saturada. Algunas regiones tienen dos o más capas freáticas. Estas zonas generalmente están separadas por material impermeable al agua, como rocas y arcilla. El agua subterránea puede llevarse a la superficie perforando debajo de la capa freática y bombeada. La cantidad de agua que se puede bombear depende de la estructura del acuífero. Se almacena poca agua en capas apretadas de granito, pero grandes cantidades de agua se almacenan en capas de caliza de acuífero. En algunas áreas, hay ríos subterráneos.
| Especie | ( ce {Cl ^ {-}} ) | ( ce {Na ^ {+}} ) | ( ce {SO4 ^ {^ -}} ) | ( ce {Mg ^ {2 +}} ) | ( ce {Ca ^ {2 +}} ) | ( ce {K ^ {+}} ) | ( ce {HCO3 ^ {-}} ) | ( ce {Br ^ {-}} ) | ( ce {Sr ^ {2 +}} ) | ( ce {BO4 ^ {3 -}} ) | ( ce {F ^ {-}} ) | ( ce {H4SiO4} ) | ( ce {H ^ {+}} ) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| mg / Kg | 10,760 | 2,710 | 2,710 | 1,290 | 411 | 399 | 142 | 67 | 8 | 4,5 | 1.3 | 0,5-10 | (10 ^ {- 8,35} ) |
Iones comunes presentes en agua natural
La hidrología es también el estudio de cómo los sólidos y los solutos interactúan en y con el agua. En este enlace, las composiciones de agua de mar, composición de la atmósfera, composiciones de lluvia y nieve, y composiciones de aguas de ríos y aguas de lagos se detallan. La tabla ( PageIndex {1} ) enumera los principales iones presentes en el agua de mar. La composición varía, dependiendo de la región, profundidad, latitud y temperatura del agua. Las aguas en las desembocaduras de los ríos contienen menos sal. Si los iones son utilizados por organismos vivos, su contenido varía según las poblaciones de organismos.
Las partículas de polvo y los iones presentes en el aire son el centro de nucleación de las gotas de agua. Por lo tanto, las aguas de lluvia y nieve también contienen tales iones: Ca 2+ , Mg 2+ , Na + , K + , NH 4 + . Estos cationes están equilibrados por aniones, HCO 3 – , SO 4 – , NO 2 – , Cl – y NO 3 – . El pH de la lluvia está entre 5.5 y 5.6. Las aguas de lluvia y nieve finalmente se convierten en aguas de ríos o lagos. Cuando caen las aguas de lluvia o nieve, interactúan con la vegetación, el suelo superior, la roca del lecho, el lecho del río y el lecho del lago, disolviendo lo que sea soluble. Las bacterias, las algas y los insectos acuáticos también prosperan. Las solubilidades de las sales inorgánicas se rigen por la cinética y el equilibrio de la disolución. Los iones más comunes en las aguas de los lagos y ríos son los mismos que los presentes en el agua de lluvia, pero en concentraciones más altas. El pH de estas aguas depende del lecho del río y del lecho del lago. Las aguas naturales contienen minerales disueltos. Las aguas que contienen iones Ca 2+ y Mg 2+ generalmente se denominan agua dura .
Agua dura
Los minerales generalmente se disuelven en cuerpos de agua naturales como lagos, ríos, manantiales y vías subterráneas (aguas subterráneas). El carbonato de calcio, CaCO 3 , es uno de los compuestos inorgánicos más comunes en la corteza terrestre. Es el ingrediente tanto para la calcita como para la aragonita. Estos dos minerales tienen estructuras y apariencia cristalinas diferentes. Esta fotografía muestra cristales de Calcita típica.
Los minerales de carbonato de calcio se disuelven en agua, con un producto de solubilidad como se muestra a continuación.
[CaCO_3 rightleftharpoons Ca ^ {2+} + CO_3 ^ {2-} ; ; ; K_ {sp} = 5 veces 10 ^ {- 9} ]
A partir del producto de solubilidad, podemos (ver ejemplo 1) evaluar la solubilidad molar como 7.1×10 -5 M o 7.1 mg / L (7.1 ppm de CaCO 3 en agua). La solubilidad aumenta a medida que disminuye el pH (aumenta la acidez). Esto se agrava cuando el agua está saturada con dióxido de carbono, CO 2 . La solución saturada de CO 2 contiene ácido carbónico, que ayuda a la disolución debido a la reacción:
[H_2O + CO_2 rightleftharpoons H_2CO_3 ]
[CaCO_3 + H_2CO_3 rightleftharpoons Ca ^ {2+} + 2 HCO_3 ^ – ]
Debido a estas reacciones, algunas aguas naturales contienen más de 300 ppm de carbonatos de calcio o sus equivalentes.
El dióxido de carbono en el agua natural crea un fenómeno interesante. El agua de lluvia está saturada con CO 2 , y disuelve las calizas. Cuando se pierde CO 2 debido a los cambios de temperatura o al escape de las gotas de agua, se produce la reacción inversa. Sin embargo, el sólido formado puede ser una fase menos estable llamada aragonita, que tiene la misma fórmula química, pero una estructura cristalina diferente a la de la calcita.
La lluvia disuelve el carbonato de calcio mediante las dos reacciones que se muestran arriba. El agua lleva los iones consigo, sorbe a través de la grieta de las rocas. Cuando llegó al techo de una cueva, la gota cuelga allí durante mucho tiempo antes de caer. Durante este tiempo, el dióxido de carbono escapa y aumenta el pH del agua. Los cristales de carbonato de calcio comienzan a aparecer. Calcita, aragonita, estalactita y estalagmita son cuatro sólidos comunes que se encuentran en la formación de cuevas.
Las aguas naturales contienen iones metálicos. El agua que contiene calcio, magnesio y sus contraaniones se llaman aguas duras . Las aguas duras deben tratarse para las siguientes aplicaciones.
- Portador de transferencia de calor en calderas y sistemas de refrigeración
- Disolventes y reactivos en aplicaciones químicas industriales
- Agua doméstica para lavado y limpieza
Agua dura temporal vs. permanente
Debido a la reversibilidad de la reacción,
[CaCO_ {3 (s)} + H_2CO_3 rightleftharpoons Ca ^ {2+} + 2 HCO_3 ^ – ]
agua que contiene Ca 2+ , Mg 2+ y CO 3 2- iones se llama agua dura temporal , porque la dureza se puede eliminar hirviendo. La ebullición impulsa la reacción inversa, causando depósitos en tuberías y escamas en calderas. Los depósitos reducen la eficiencia de la transferencia de calor en las calderas y disminuyen los caudales de agua en las tuberías. Por lo tanto, el agua dura temporal debe ablandarse antes de que ingrese a la caldera, el tanque de agua caliente o un sistema de enfriamiento. La cantidad de iones metálicos que se pueden eliminar por ebullición se denomina dureza temporal
Después de la ebullición, los iones metálicos permanecen debido a la presencia de iones cloruro, iones sulfato, iones nitrato y una solubilidad bastante alta de MgCO 3 . La cantidad de iones metálicos que no se pueden eliminar por ebullición se llama dureza permanente. La dureza total es la suma de la dureza temporal y la dureza permanente. La dureza a menudo se expresa como equivalencia de la cantidad de iones de calcio en la solución. Por lo tanto, el acondicionamiento del agua es un tema importante. Se ha estimado que el valor del mercado de tratamiento de agua tiene un valor de $ 30 mil millones.
Ablandamiento de la soda de lima
El ablandamiento con cal y soda es la eliminación de la dureza temporal mediante la adición de una cantidad calculada de cal hidratada, Ca (OH) 2 :
[Ca ^ {2+} + 2 HCO_3 ^ – + Ca (OH) _ {2 (s)} rightarrow 2 CaCO_ {3 (s)} + 2 H_2O ]
Agregar más cal hace que aumente el pH del agua y, como resultado, la reacción elimina los iones de magnesio:
[Mg ^ {2+} + Ca (OH) _ {2 (s)} rightarrow Mg (OH) _ {2 (s)} + Ca ^ {2 +} ]
Los iones de calcio adicionales se pueden eliminar mediante la adición de carbonato de sodio.
[Na_2CO_3 rightarrow 2 Na ^ + + CO_3 ^ {2 -} ]
[Ca ^ {2+} + CO_3 ^ {2-} + rightarrow CaCO_ {3 (s)} ]
En este tratamiento, la cantidad de Ca (OH) 3 requerida es equivalente a la dureza temporal más la dureza de magnesio. La cantidad de carbonato de sodio requerida es equivalente a la dureza permanente. Por lo tanto, el ablandamiento de la soda de lima es efectivo si se han determinado tanto la dureza temporal como la total. El ion de sodio permanecerá en el agua después del tratamiento. El pH del agua también es bastante alto dependiendo de la cantidad de cal y carbonatos de sodio utilizados.
Tratamiento de complejación
La adición de reactivo complejante para formar complejos solubles con Ca 2+ y Mg 2+ previene la formación de sólidos. Uno de los agentes complejantes es el trifosfato de sodio Na 3 PO 4 , que se comercializa como Calgon, etc. El fosfato es el agente complejante. También se pueden usar otros agentes complejantes como Na 2 H 2 EDTA, pero el agente complejante EDTA 4- forma complejos fuertes con metales de transición. Esto causa problemas de corrosión, a menos que las tuberías del sistema estén hechas de acero inoxidable.
Intercambio de iones
Hoy en día, la mayoría de los ablandadores de agua usan zeolitas y emplean técnicas de intercambio iónico para ablandar el agua dura. Las zeolitas son un grupo de aluminosilicatos cristalinos hidratados que se encuentran en ciertas rocas volcánicas. Los átomos de aluminio y silicio coordinados tetraédricamente forman grupos tetraédricos AlO 4 y SiO 4 . Se interconectan entre sí compartiendo átomos de oxígeno formando estructuras de tipo jaula como se muestra a la derecha. Este diagrama y el siguiente diagrama estructural están tomados de una introducción a las zeolitas. Hay muchos tipos de zeolitas, algunas recién sintetizadas.
De cualquier tipo, la estructura cristalina de las zeolitas contiene grandes jaulas. Las jaulas están conectadas entre sí formando un marco con muchas cavidades y canales. Los iones positivos y negativos pueden quedar atrapados en estas cavidades y canales como se muestra a continuación.
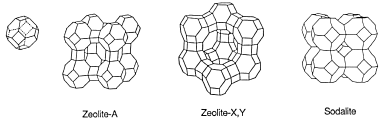
Por cada oxígeno que no se comparte en los grupos tetraédricos AlO 4 y SiO 4 , queda una carga negativa en el grupo. Estas cargas negativas se equilibran atrapando iones de metales alcalinos y alcalinotérreos. Cuando quedan atrapados más cationes, los iones de hidróxido y cloruro permanecerán en las cavidades y canales de las zeolitas.
Para preparar una zeolita para el tratamiento del agua, se sumergen en una solución concentrada de NaCl. Las cavidades atrapan tantos iones de sodio como pueden acomodar. Después del tratamiento, la zeolita se designa como Na-zeolita. Luego se drena la solución salina y la zeolita se lava con agua para eliminar la sal extra. Cuando el agua dura fluye a través de ellos, los iones de calcio y magnesio quedarán atrapados por la zeolita de Na. Por cada Ca 2+ o Mg 2+ atrapado, se liberan dos iones Na + . El agua tratada contiene una concentración bastante alta de iones Na + , pero bajas concentraciones de Mg 2+ y Ca 2+ . Por lo tanto, el intercambio de iones de zeolita convierte el agua dura en agua blanda.
Agua pura por intercambio iónico
En la mayoría de los casos, las resinas son de poliestireno con grupos funcionales -SO 3 H unidos a la cadena de polímero para la resina de intercambio catiónico, y con el grupo funcional -N (CH 3 ) 3 + unido a la cadena para la resina de intercambio aniónico. Para preparar la resina para hacer agua pura o desionizada , la resina catiónica se regenera con HCl para que los grupos sean realmente -SO 3 H. La resina aniónica se regenera con NaOH, entonces que los grupos funcionales son -N (CH 3 ) 3 (OH). Cuando el agua que contiene cualquier ion metálico M + y anión A – pasa a través de las resinas de intercambio iónico en dos etapas, tienen lugar las siguientes reacciones,
[ ce {M + + -SO3H rightarrow H + + -SO3M} ]
[ ce {A ^ {-} + -N (CH3) 3 (OH) rightarrow OH ^ {-} + -N (CH3) 3A} ]
[ ce {H ^ {+} + OH- <=> H2O} ]
Por lo tanto, el intercambio iónico proporciona agua pura para cumplir con los requisitos de laboratorio.
Sistema de filtro de agua de ósmosis inversa
Este método también se puede utilizar para preparar agua para aplicaciones domésticas y de laboratorio. Este método se ha discutido en Tratamiento de aguas residuales
Tratamiento magnético de agua
La siguiente es una lista de compañías que venden dispositivos magnéticos para tratamiento magnético de agua . Todos los dispositivos se basan en los resultados de algunas investigaciones que indican que cuando el agua atraviesa un campo magnético, el carbonato de calcio precipitará como aragonita en lugar de la calcita habitual. Por ejemplo, K.J. Kronenberg ha publicado un artículo en IEEE Transactions on Magnetics , (Vol. Mag-21, No. 5, septiembre de 1985, páginas 2059-2061). y declaró lo siguiente:
Se descubrió que el modo de cristalización del contenido mineral del agua cambia de un hábito de solidificación dendrítico unido a sustrato a la forma de cristales separados en forma de disco después de que el agua se haya movido a través de varios campos magnéticos. La escasez anterior de núcleos de cristalización en el agua se había convertido en una abundancia de centros de nucleación en el agua. La reducción del número de cristales unidos al sustrato se ha utilizado como una medida cuantitativa del efecto magnético.
Muchas compañías han fabricado varios dispositivos para el acondicionamiento magnético del agua, y afirman que sus dispositivos limpiarán las tuberías y las calderas a un costo bajo o sin costo. Todavía tengo que probar uno de estos dispositivos por su reclamo, pero mis pruebas preliminares muestran que el imán permanente tiene poco efecto sobre el depósito de carbonato de calcio del agua dura temporal. El efecto de limpieza que han afirmado es probablemente demasiado exagerado.
Ejemplo ( PageIndex {1} )
Del producto de solubilidad mostrado para la disolución del carbonato de calcio,
[CaCO_3 rightleftharpoons Ca ^ {2+} + CO_3 ^ {2-} ; ; ; K_ {sp} = 5 veces 10 ^ {- 9} ]
Evalúe la solubilidad molar de Ca 2+ en solución saturada.
SOLUCIÓN
De la definición de producto de solubilidad, tenemos
[[Ca ^ {2+}] [CO_3 ^ {2-}] = 5 veces 10 ^ {- 9} ]
Por lo tanto,
[[Ca ^ {2+}] = [CO_3 ^ {2-}] = 7.1 veces 10 ^ {- 5} ; M ]
La concentración de 7.1×10 -5 M es equivalente a 7.1 mg / L (7.1 ppm de CaCO 3 en agua).
DISCUSIÓN
Puede haber otros iones presentes en el sistema y otras condiciones de equilibrio además del equilibrio mencionado aquí. Los problemas son más complejos en el mundo real.
Ejercicio ( PageIndex {1} )
La ebullición de 1,0 L de agua produjo 10 mg de CaCO3 sólido. ¿Cuál es la dureza temporal del agua?
- Respuesta
-
10 ppm