Toma papel de aluminio. Córtalo por la mitad. Ahora hay dos piezas más pequeñas de papel de aluminio. Corta una de las piezas por la mitad otra vez. Corta una de esas piezas más pequeñas por la mitad nuevamente. Continúe cortando, haciendo trozos cada vez más pequeños de papel de aluminio. Debería ser obvio que las piezas siguen siendo papel de aluminio; se están volviendo cada vez más pequeños. Pero, ¿hasta dónde puede llevarse este ejercicio, al menos en teoría? ¿Se puede seguir cortando el papel de aluminio en mitades para siempre, haciendo piezas cada vez más pequeñas? ¿O hay algún límite, alguna pieza más pequeña de papel de aluminio? Experimentos de pensamiento como este, y las conclusiones basadas en ellos, se debatieron ya en el siglo V a. C.
John Dalton (1766-1844) es el científico acreditado por proponer la teoría atómica. La teoría explica varios conceptos que son relevantes en el mundo observable: la composición de un collar de oro puro, lo que hace que el collar de oro puro sea diferente de un collar de plata pura, y lo que ocurre cuando el oro puro se mezcla con cobre puro. Esta sección explica las teorías que Dalton utilizó como base para su teoría: (1) Ley de Conservación de la Masa (2) Ley de Proporciones Definidas y (3) Ley de proporciones múltiples
Ley 1: La conservación de la misa
“Nada viene de la nada” es una idea importante en la filosofía griega antigua que argumenta que lo que existe ahora siempre existió , ya que no puede surgir ninguna materia nueva donde había ninguno antes. Antoine Lavoisier (1743-1794) reafirmó este principio para la química con la ley de conservación de la masa, que “significa que los átomos de un objeto no pueden crearse ni destruirse, sino que pueden moverse y transformarse en partículas diferentes”. Esta ley dice que cuando una reacción química reorganiza los átomos en un nuevo producto, la masa de los reactivos (químicos antes de la reacción química) es la misma que la masa de los productos (los nuevos químicos fabricados). Más simplemente, haga lo que haga, seguirá teniendo la misma cantidad de cosas (sin embargo, ciertas reacciones nucleares como la fusión y la fisión pueden convertir una pequeña parte de la masa en energía.
La ley de conservación de la masa establece que la masa total presente antes de una reacción química es la misma que la masa total presente después de la reacción química; en otras palabras, la masa se conserva . Lavoisier formuló la ley de conservación de la masa como resultado de su experimento de combustión, en el que observó que la masa de su sustancia original (un recipiente de vidrio, estaño y aire) era igual a la masa de la sustancia producida: el recipiente de vidrio, “calx de estaño”, y el aire restante.
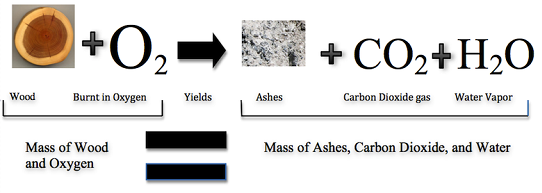
Históricamente, este fue un concepto difícil de entender para los científicos. Si esta ley fuera cierta, ¿cómo podría reducirse un gran trozo de madera a una pequeña pila de cenizas? La madera claramente tiene una mayor masa que las cenizas. De esta observación, los científicos concluyeron que se había perdido masa. Sin embargo, la Figura ( PageIndex {1} ) muestra que la quema de palabras sigue la ley de conservación de la masa. Los científicos no tomaron en cuenta los gases que juegan un papel crítico en esta reacción.
La ley de conservación de la masa establece que la masa total presente antes de una reacción química es la misma que la masa total presente después de la reacción química.
Ley 2: Proporciones definitivas
Joseph Proust (1754-1826) formuló la ley de proporciones definidas (también llamada Ley de la constante Composición o Ley de Proust [19459020 ]). Esta ley establece que si un compuesto se descompone en sus elementos constituyentes, las masas de los constituyentes siempre tendrán las mismas proporciones, independientemente de la cantidad o fuente de la sustancia original. Joseph Proust basó esta ley principalmente en sus experimentos con carbonato de cobre básico. La siguiente ilustración muestra esta ley en acción.
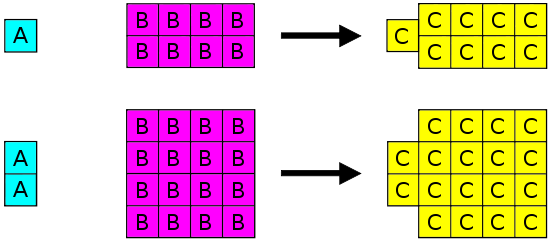
La Ley de Proporciones Definidas establece que en un tipo dado de sustancia química, los elementos siempre se combinan en las mismas proporciones en masa.
La Ley de proporciones definidas se aplica cuando los elementos reaccionan juntos para formar el mismo producto . Por lo tanto, mientras que la Ley de Proporciones Definidas puede usarse para comparar dos experimentos en los que el hidrógeno y el oxígeno reaccionan para formar agua, la Ley de Proporciones Definidas no puede usarse para comparar un experimento en el que reaccionan hidrógeno y oxígeno para formar agua, y otro experimento en el que el hidrógeno y el oxígeno reaccionan para formar peróxido de hidrógeno (el peróxido es otro material que se puede hacer de hidrógeno y oxígeno).
Ley 3: Proporciones múltiples
Muchas combinaciones de elementos pueden reaccionar para formar más de un compuesto. En tales casos, esta ley establece que los pesos de un elemento que se combinan con un peso fijo de otro de estos elementos son múltiplos enteros entre sí. Es fácil decir esto, pero asegúrese de comprender cómo funciona. El nitrógeno forma una gran cantidad de óxidos, cinco de los cuales se muestran aquí.

- La línea
muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas proporciones se calcularon simplemente tomando la masa molar de cada elemento y multiplicándola por el número de átomos de ese elemento por mol del compuesto. Por lo tanto, para NO 2 , tenemos (1 × 14): (2 × 16) = 13:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos (es decir, las masas molares) de la mayoría de los elementos no se conocían de manera confiable).
- Los números en la línea
son solo las relaciones de masa de O: N, que se encuentran dividiendo las relaciones correspondientes en la línea 1. Pero alguien que dependa únicamente del experimento resolvería esto al encontrar la masa de O que se combina con unidad de masa (1 g) de nitrógeno.
- La línea se obtiene dividiendo las cifras de la línea anterior por la relación O: N más pequeña en la línea de arriba, que es la de N 2 O. Tenga en cuenta que tal como dice la ley de las proporciones múltiples , el peso de oxígeno que se combina con la unidad de peso de nitrógeno se convierte en números enteros pequeños.
- Por supuesto, podríamos haber ilustrado la ley con la misma facilidad al considerar la masa de nitrógeno que se combina con un gramo de oxígeno; ¡funciona en ambos sentidos!
La ley de proporciones múltiples establece que si dos elementos forman más de un compuesto entre ellos, las masas de un elemento combinadas con una masa fija del segundo elemento se forman en proporciones de enteros pequeños.
La teoría atómica de Dalton
La teoría atómica moderna, propuesta alrededor de 1803 por el químico inglés John Dalton (Figura ( PageIndex {4} )), es un concepto fundamental que establece que todos los elementos están compuestos de átomos. Anteriormente, un átomo se definía como la parte más pequeña de un elemento que mantiene la identidad de ese elemento. Los átomos individuales son extremadamente pequeños; incluso el átomo más grande tiene un diámetro aproximado de solo 5.4 × 10 −10 m. Con ese tamaño, se necesitan más de 18 millones de estos átomos, alineados uno al lado del otro, para igualar el ancho del meñique humano (aproximadamente 1 cm).

Las ideas de Dalton se llaman la teoría atómica moderna porque el concepto de átomos es muy antiguo. Los filósofos griegos Leucipo y Demócrito introdujeron originalmente conceptos atómicos en el siglo V a. C. (La palabra átomo proviene de la palabra griega atomos , que significa “indivisible” o “no cortable”). Dalton tenía algo que los filósofos griegos antiguos no tenían; Tenía pruebas experimentales, como las fórmulas de productos químicos simples y el comportamiento de los gases. Aproximadamente 150 años antes de Dalton, la filosofía natural había madurado en la ciencia moderna, y el método científico se estaba utilizando para estudiar la naturaleza. Cuando Dalton anunció una teoría atómica moderna, estaba proponiendo una teoría fundamental para describir muchas observaciones previas del mundo natural; él no solo estaba participando en una discusión filosófica.
La teoría de Dalton fue un desarrollo poderoso ya que explicó las tres leyes de la combinación química (arriba) y reconoció una distinción viable entre la partícula fundamental de un elemento (átomo) y la de un compuesto (molécula). Seis postulados están involucrados en la teoría atómica de Dalton:
- Toda la materia consiste en partículas indivisibles llamadas átomos.
- Los átomos del mismo elemento son similares en forma y masa, pero difieren de los átomos de otros elementos.
- Los átomos no se pueden crear ni destruir.
- Los átomos de diferentes elementos pueden combinarse entre sí en una proporción fija, simple y de números enteros para formar átomos compuestos.
- Los átomos del mismo elemento pueden combinarse en más de una relación para formar dos o más compuestos.
- El átomo es la unidad de materia más pequeña que puede participar en una reacción química.
A la luz del estado actual del conocimiento en el campo de la Química, la teoría de Dalton tenía algunos inconvenientes. Según los postulados de Dalton,
- Se demostró que la indivisibilidad de un átomo era incorrecta: un átomo se puede subdividir en protones, neutrones y electrones. Sin embargo, un átomo es la partícula más pequeña que participa en las reacciones químicas.
- Según Dalton, los átomos del mismo elemento son similares en todos los aspectos. Sin embargo, los átomos de algunos elementos varían en sus masas y densidades. Estos átomos de diferentes masas se llaman isótopos. Por ejemplo, el cloro tiene dos isótopos con números de masa 35 y 37.
- Dalton también afirmó que los átomos de diferentes elementos son diferentes en todos los aspectos. Esto se ha demostrado incorrecto en ciertos casos: los átomos de argón y calcio tienen cada uno una misma masa atómica (40 amu).
- Según Dalton, los átomos de diferentes elementos se combinan en proporciones simples de números enteros para formar compuestos. Esto no se observa en compuestos orgánicos complejos como el azúcar ( (C_ {12} H_ {22} O_ {11} )).
- La teoría no explica la existencia de alótropos (diferentes formas de elementos puros); No tiene en cuenta las diferencias en las propiedades del carbón, grafito, diamante.
A pesar de estos inconvenientes, no se debe subestimar la importancia de la teoría de Dalton. Mostró una visión excepcional de la naturaleza de la materia. y sus ideas proporcionaron un marco que luego fue modificado y ampliado por otros. Consecuentemente, John Dalton a menudo se considera el padre de la teoría atómica moderna.
Referencias
- Petrucci, Ralph, William Harwood, Geoffrey Herring y Jeffry Madura. Química General. Novena ed. Upper Saddle River, Nueva Jersey: Pearson Prentince Hall, 2007
- Moore, John. Química para tontos. John Wiley & Sons Inc, 2002.
- Asimov, Isaac. Una breve historia de la química. , CT .: Greenwood Press, 1965.
- Patterson, Elizabeth C. John Dalton y la teoría atómica. Garden City, Nueva York: Doubleday, 1970
- Myers, Richard. Los fundamentos de la química. Greenwood, 2003
- Demtröder, Wolfgang. Átomos, moléculas y fotones: una introducción a la física atómica, molecular y cuántica. 1ª ed. Saltador. 2002
Resumen
Este artículo explica las teorías que Dalton utilizó como base para su teoría: (1) la Ley de Conservación de la Masa, (2) la Ley de Composición Constante, (3) la Ley de Proporciones Múltiples.
 muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas proporciones se calcularon simplemente tomando la masa molar de cada elemento y multiplicándola por el número de átomos de ese elemento por mol del compuesto. Por lo tanto, para NO 2 , tenemos (1 × 14): (2 × 16) = 13:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos (es decir, las masas molares) de la mayoría de los elementos no se conocían de manera confiable).
muestra la relación de los pesos relativos de los dos elementos en cada compuesto. Estas proporciones se calcularon simplemente tomando la masa molar de cada elemento y multiplicándola por el número de átomos de ese elemento por mol del compuesto. Por lo tanto, para NO 2 , tenemos (1 × 14): (2 × 16) = 13:32. (Estos números no se conocían en los primeros días de la Química porque los pesos atómicos (es decir, las masas molares) de la mayoría de los elementos no se conocían de manera confiable).  son solo las relaciones de masa de O: N, que se encuentran dividiendo las relaciones correspondientes en la línea 1. Pero alguien que dependa únicamente del experimento resolvería esto al encontrar la masa de O que se combina con unidad de masa (1 g) de nitrógeno.
son solo las relaciones de masa de O: N, que se encuentran dividiendo las relaciones correspondientes en la línea 1. Pero alguien que dependa únicamente del experimento resolvería esto al encontrar la masa de O que se combina con unidad de masa (1 g) de nitrógeno.