Los átomos en todas las sustancias que contienen átomos múltiples se mantienen unidos por interacciones electrostáticas, interacciones entre partículas cargadas eléctricamente como protones y electrones. La atracción electrostática entre especies con carga opuesta (positiva y negativa) da como resultado una fuerza que hace que se muevan una hacia la otra, como la atracción entre polos opuestos de dos imanes. Por el contrario, la repulsión electrostática entre dos especies con la misma carga (tanto positiva como negativa) da como resultado una fuerza que hace que se repelen entre sí, al igual que los mismos polos de dos imanes. Los átomos forman compuestos químicos cuando las interacciones electrostáticas atractivas entre ellos son más fuertes que las interacciones repulsivas. Colectivamente, las interacciones atractivas entre los átomos se llaman enlaces químicos.
Los enlaces químicos generalmente se dividen en dos tipos fundamentalmente diferentes: iónico y covalente. Sin embargo, en realidad, los enlaces en la mayoría de las sustancias no son puramente iónicos ni puramente covalentes, sino que se encuentran en un espectro entre estos extremos. Aunque los enlaces puramente iónicos y puramente covalentes representan casos extremos que rara vez se encuentran en sustancias muy simples, una breve discusión de estos dos extremos ayuda a explicar por qué las sustancias con diferentes tipos de enlaces químicos tienen propiedades muy diferentes. Los compuestos iónicos consisten en iones cargados positiva y negativamente unidos por fuertes fuerzas electrostáticas, mientras que los compuestos covalentes generalmente consisten en moléculas, que son grupos de átomos en los que uno o más pares de electrones se comparten entre los átomos unidos. En un enlace covalente, los átomos se mantienen unidos por la atracción electrostática entre los núcleos cargados positivamente de los átomos unidos y los electrones cargados negativamente que comparten. Esta discusión de estructuras y fórmulas comienza describiendo compuestos covalentes. Los factores energéticos involucrados en la formación de enlaces se describen con más detalle cuantitativo más adelante.
Moléculas y compuestos covalentes
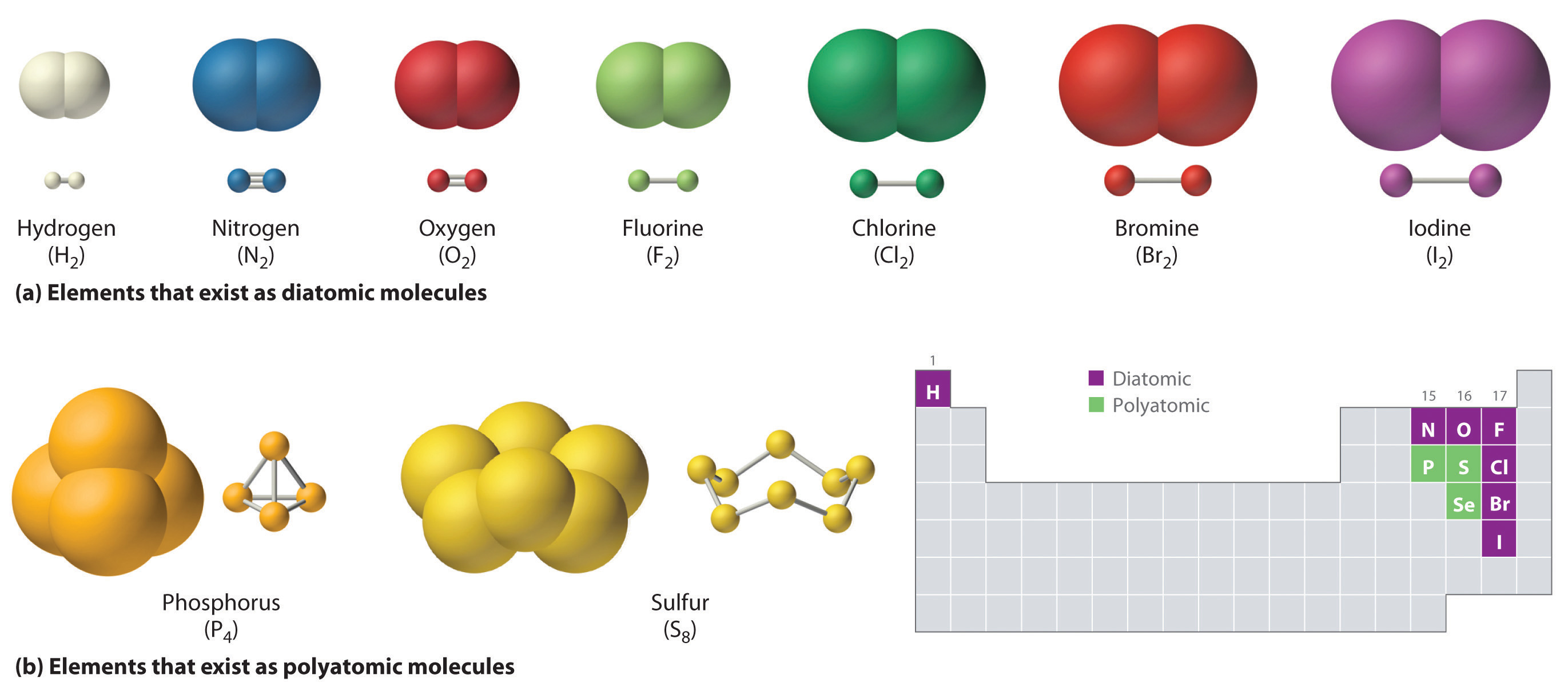
Así como un átomo es la unidad más simple que tiene las propiedades químicas fundamentales de un elemento, una molécula es la unidad más simple que tiene las propiedades químicas fundamentales de un compuesto covalente. Algunos elementos puros existen como moléculas covalentes. El hidrógeno, el nitrógeno, el oxígeno y los halógenos se presentan naturalmente como moléculas diatómicas (“dos átomos”) H 2 , N 2 , O 2 , F [ 19459017] 2 , Cl 2 , Br 2 e I 2 (parte (a) en la Figura ( PageIndex {1} ) ) Del mismo modo, existen algunos elementos puros como moléculas poliatómicas (“muchos átomos”), como el fósforo y el azufre elementales, que se presentan como P 4 y S 8 (parte (b) en Figura ( PageIndex {1} )).
Cada compuesto covalente está representado por una fórmula molecular, que proporciona el símbolo atómico de cada elemento componente, en un orden prescrito, acompañado de un subíndice que indica el número de átomos de ese elemento en la molécula. El subíndice se escribe solo si el número de átomos es mayor que 1. Por ejemplo, el agua, con dos átomos de hidrógeno y un átomo de oxígeno por molécula, se escribe como (H_2O ). Del mismo modo, el dióxido de carbono, que contiene un átomo de carbono y dos átomos de oxígeno en cada molécula, se escribe como (CO_2 ).
Los compuestos covalentes que predominantemente contienen carbono e hidrógeno se denominan compuestos orgánicos . La convención para representar las fórmulas de los compuestos orgánicos es escribir primero carbono, seguido de hidrógeno y luego cualquier otro elemento en orden alfabético (p. Ej., CH 4 O es alcohol metílico, un combustible ) Los compuestos que consisten principalmente en elementos distintos del carbono y el hidrógeno se denominan compuestos inorgánicos ; incluyen tanto compuestos covalentes como iónicos. En los compuestos inorgánicos, los elementos componentes se enumeran comenzando con el más alejado a la izquierda en la tabla periódica , como en CO 2 o SF 6 . Los del mismo grupo se enumeran comenzando con el elemento inferior y subiendo, como en ClF . Sin embargo, por convención, cuando un compuesto inorgánico contiene tanto hidrógeno como un elemento de los grupos 13-15, el hidrógeno generalmente aparece en último lugar en la fórmula. Los ejemplos son amoniaco ( NH 3 ) y silano ( SiH 4 ). Los compuestos como el agua, cuyas composiciones se establecieron mucho antes de que se adoptara esta convención, siempre se escriben primero con hidrógeno: el agua siempre se escribe como H 2 O , no OH [ 19459017] 2 . Las convenciones para los ácidos inorgánicos, como el ácido clorhídrico ( HCl ) y el ácido sulfúrico ( H 2 SO 4 ), se describen en Sección 2.8 .
Representaciones de estructuras moleculares
Las fórmulas moleculares solo dan la composición elemental de las moléculas. En contraste, las fórmulas estructurales muestran qué átomos están unidos entre sí y, en algunos casos, la disposición aproximada de los átomos en el espacio. Conocer la fórmula estructural de un compuesto permite a los químicos crear un modelo tridimensional, que proporciona información sobre cómo se comportará ese compuesto física y químicamente.
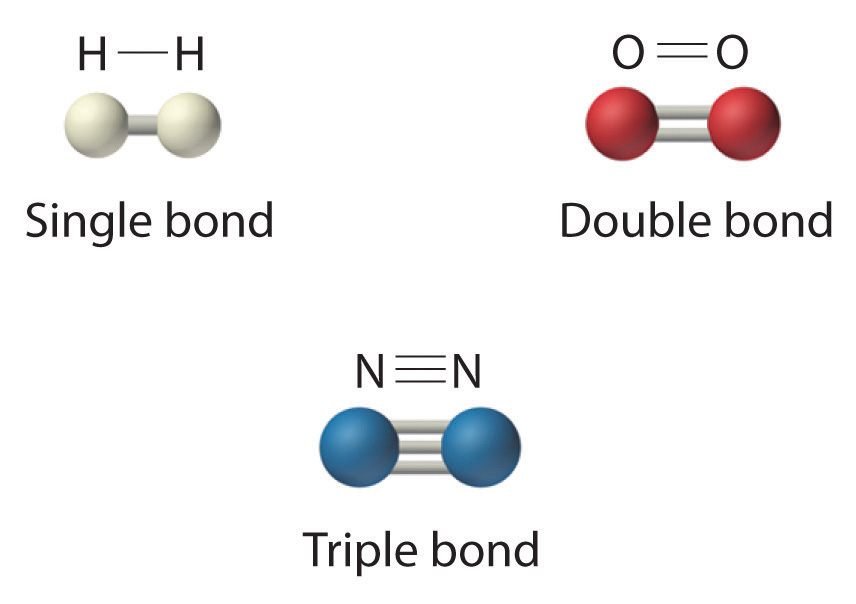
La fórmula estructural para H 2 se puede dibujar como H – H y eso para I 2 como I – I, donde la línea indica un solo par de electrones compartidos, un enlace sencillo. Dos pares de electrones se comparten en un doble enlace, que se indica mediante dos líneas, por ejemplo, O 2 es O = O. Tres pares de electrones se comparten en un enlace triple, que se indica mediante tres líneas, por ejemplo, N 2 es N≡N (consulte Figura ( PageIndex {2} ) ) El carbono es único en la medida en que forma enlaces simples, dobles y triples consigo mismo y con otros elementos. El número de enlaces formados por un átomo en sus compuestos covalentes no es arbitrario. El hidrógeno, el oxígeno, el nitrógeno y el carbono tienen una tendencia muy fuerte a formar sustancias en las que tienen uno, dos, tres y cuatro enlaces con otros átomos, respectivamente ( Tabla ( PageIndex {1} ) )
| Átomo | Número de Bonos |
|---|---|
| H (grupo 1) | 1 |
| O (grupo 16) | 2 |
| N (grupo 15) | 3 |
| C (grupo 14) | 4 |
La fórmula estructural para el agua se puede dibujar de la siguiente manera:

Debido a que este último se aproxima a la forma experimentalmente determinada de la molécula de agua, es más informativo. Del mismo modo, el amoníaco (NH 3 ) y el metano (CH 4 ) a menudo se escriben como moléculas planas:

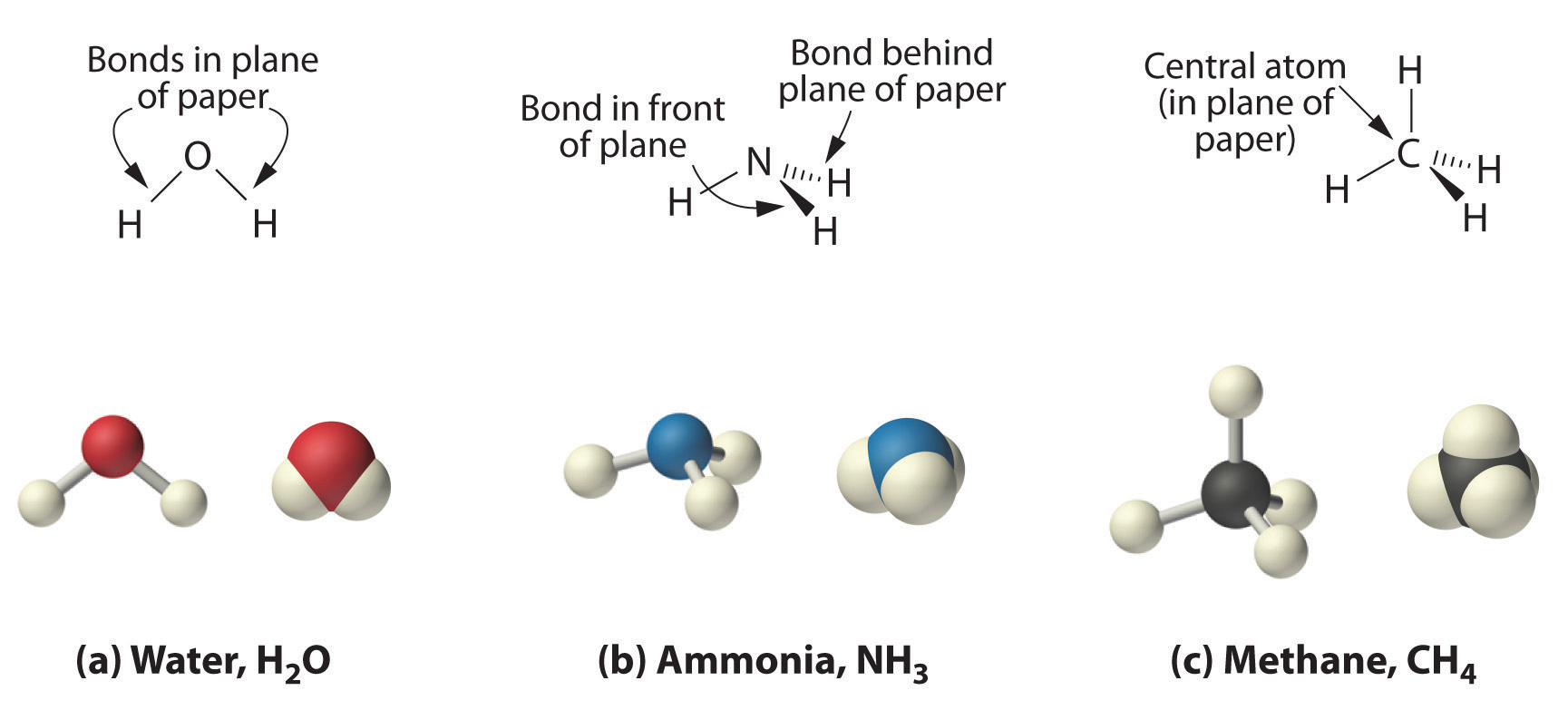
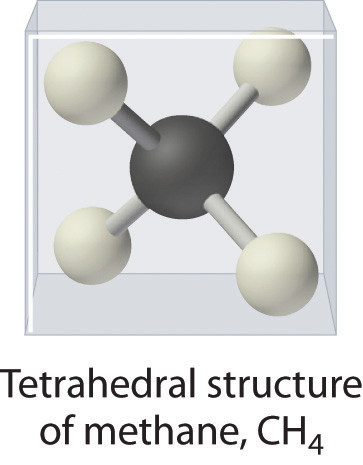
Las figuras ( PageIndex {1} ), ( PageIndex {2} ), y ( PageIndex {3} ) ilustran diferentes formas de representan las estructuras de las moléculas. Debe quedar claro que no existe una única “mejor” forma de dibujar la estructura de una molécula; El método utilizado depende de qué aspecto de la estructura se debe enfatizar y cuánto tiempo y esfuerzo se requiere. La figura ( PageIndex {4} ) muestra algunas de las diferentes formas de representar la estructura de una molécula ligeramente más compleja: el metanol. Estas representaciones difieren mucho en el contenido de su información. Por ejemplo, la fórmula molecular para metanol ( Figura ( PageIndex {4a} ) ) da solo el número de cada tipo de átomo; escribiendo metanol como CH 4 O no dice nada sobre su estructura. En contraste, la fórmula estructural ( Figura ( PageIndex {4b} ) ) indica cómo están conectados los átomos, pero hace que el metanol parezca plano (que no lo es). Tanto el modelo de bola y palo (parte (c) en Figura ( PageIndex {4} ) ) como el dibujo en perspectiva ( Figura ( PageIndex {4d} ) [ 19459025]) muestran la estructura tridimensional de la molécula. La última (también llamada representación de cuña y guión) es la forma más fácil de esbozar la estructura de una molécula en tres dimensiones. Muestra qué átomos están por encima y por debajo del plano del papel mediante el uso de cuñas y guiones, respectivamente; siempre se supone que el átomo central está en el plano del papel. El modelo de relleno de espacio (parte (e) en Figura ( PageIndex {4} )) ilustra los tamaños relativos aproximados de los átomos en la molécula, pero no muestra los enlaces entre los átomos . Además, en un modelo de relleno de espacio, los átomos en el “frente” de la molécula pueden oscurecer los átomos en la “parte posterior”.
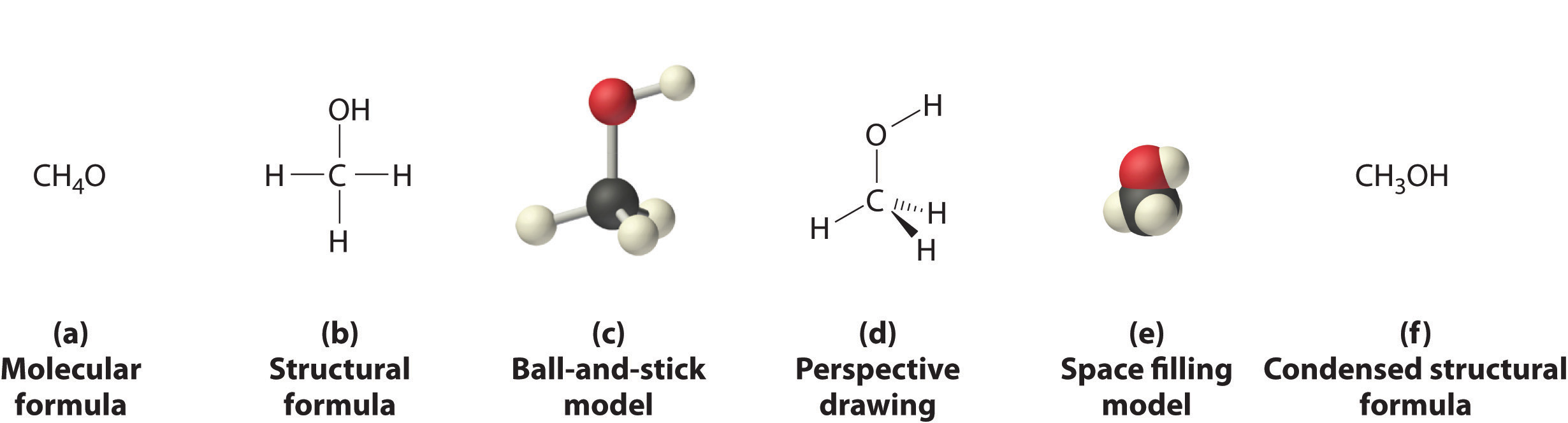
Aunque una fórmula estructural, un modelo de bola y palo, un dibujo en perspectiva y un modelo de relleno de espacio proporcionan una cantidad significativa de información sobre la estructura de una molécula, cada uno requiere tiempo y esfuerzo. En consecuencia, los químicos a menudo usan una fórmula estructural condensada (parte (f) en Figura ( PageIndex {4} ) ), que omite las líneas que representan enlaces entre átomos y simplemente enumera los átomos unidos a un determinado átomo a su lado. Múltiples grupos unidos al mismo átomo se muestran entre paréntesis, seguidos de un subíndice que indica el número de dichos grupos. Por ejemplo, la fórmula estructural condensada para metanol es CH 3 OH, lo que indica que la molécula contiene una unidad CH 3 que parece un fragmento de metano (CH 4 [ 19459018]). Por lo tanto, el metanol puede verse como una molécula de metano en la que un átomo de hidrógeno ha sido reemplazado por un grupo –OH o como una molécula de agua en la que un átomo de hidrógeno ha sido reemplazado por un fragmento –CH 3 . Debido a su facilidad de uso y contenido de información, utilizamos fórmulas estructurales condensadas para moléculas a lo largo de este texto. Los modelos de bola y palo se usan cuando es necesario para ilustrar la estructura tridimensional de las moléculas, y los modelos de relleno de espacio se usan solo cuando es necesario visualizar los tamaños relativos de átomos o moléculas para comprender un punto importante.
Resumen
Hay dos tipos fundamentalmente diferentes de enlaces químicos (covalente e iónico) que hacen que las sustancias tengan propiedades muy diferentes. Los átomos en los compuestos químicos se mantienen unidos por interacciones electrostáticas atractivas conocidas como enlaces químicos. La fórmula molecular de un compuesto covalente da los tipos y números de átomos presentes. Los compuestos que contienen predominantemente carbono e hidrógeno se denominan compuestos orgánicos, mientras que los compuestos que consisten principalmente en elementos distintos del carbono y el hidrógeno son compuestos inorgánicos. Las moléculas diatómicas contienen dos átomos, y las moléculas poliatómicas contienen más de dos. Una fórmula estructural indica la composición y la estructura y forma aproximadas de una molécula. Los compuestos moleculares covalentes, en contraste, consisten en moléculas discretas unidas por fuerzas intermoleculares débiles y pueden ser gases, líquidos o sólidos a temperatura y presión ambiente.