Este capítulo introdujo algunos de los conceptos fundamentales de la química, con especial atención a las propiedades básicas de los átomos y elementos. Estas entidades son los bloques de construcción de todas las sustancias que encontramos, sin embargo, las sustancias más comunes no consisten solo en elementos puros o átomos individuales. En cambio, casi todas las sustancias son compuestos químicos o mezclas de compuestos químicos. Aunque solo hay alrededor de 115 elementos (de los cuales alrededor de 86 ocurren naturalmente), se conocen millones de compuestos químicos, con una tremenda gama de propiedades físicas y químicas. En consecuencia, el énfasis principal de la química moderna se centra en comprender la relación entre las estructuras y las propiedades de los compuestos químicos.
2.1: La teoría atómica de la materia
- La teoría atómica de la materia de Dalton:
- Cada elemento está compuesto de partículas extremadamente pequeñas llamadas átomos
- Todos los átomos de un elemento dado son idénticos; los átomos de diferentes elementos son diferentes y tienen diferentes propiedades
- Los átomos de un elemento no se transforman en diferentes tipos de átomos mediante reacciones químicas
- Los compuestos se forman cuando los átomos de más de un elemento se combinan
- explica la ley de composición constante, ley de conservación de la masa
2.2: El descubrimiento de la estructura atómica
- partículas subatómicas: de qué átomos están compuestos
- Los cargos similares se repelen entre sí; a diferencia de los cargos atraen
Rayos catódicos y electrones
- rayos catódicos: radiación resultante de un alto voltaje
- hace que ciertos materiales emitan luz (fluorescencia)
- masa de un electrón 9.10939 * 10 -28 g
- 2000 veces más pequeño que el hidrógeno
1.2.2 Radiactividad
- radiactividad – emisión espontánea de radiación
- tres tipos de radiación: alfa ( a ), beta ( b ), gamma ( g )
- la radiación alfa y beta se ven afectadas por un campo eléctrico
- las partículas beta tienen una carga de 1-
- las partículas alfa tienen una carga de 2+
- la radiación gamma no tiene partículas ni carga
1.2.3 El átomo nuclear
- Rutherford determinó que había un núcleo en cada átomo
- Protones descubiertos por Rutherford en 1919
- Neutrones descubiertos por James Chadwich en 1932
2.3: La visión moderna de la estructura atómica
- la carga de un electrón es –1.602 * 10 -19
- la carga de un protón es + 1.602 * 10 -19
- 1.602 * 10 -19 se llama a carga electrónica
| Partícula | Cargo | Misa (amu) |
|---|---|---|
| Protón | Positivo | 1.0073 |
| Neutron | Ninguno | 1.0087 |
| Electrón | Negativo | 5,486 * 10 -4 |
- unidad de masa atómica (amu) – es igual a 1.66054 * 10 -24 gramos
- angstrom (Å) – unidad de longitud para medir dimensiones atómicas
- 1 angstrom = 10 -10 m
- los átomos tienen diámetros de 1-5 Å
- núcleo – diámetro de 10 -4 Å
2.4: Masa atómica
- todos los átomos de un elemento tienen el mismo número de protones en el núcleo
- isótopos: átomos del mismo elemento que tienen un número diferente de neutrones
- número atómico – el número de protones en un átomo
- número de masa – número de protones + número de neutrones
- nucleido – átomo de un isótopo específico
2.5: La tabla periódica
- tabla periódica: la disposición de todos los elementos por número atómico y similitudes en una tabla
- columnas = grupos
- elementos metálicos: todos los elementos en el lado izquierdo y en el medio de la tabla periódica
- elementos no metálicos: elementos en la tabla periódica que se dividen por una línea diagonal en forma de escalón desde el boro hasta el astato
- metaloides – propiedades de metales y no metales
2.6: Moléculas y compuestos moleculares
- molécula: dos o más átomos unidos entre sí
- Moléculas y fórmulas químicas
-
- fórmula química – forma de representar moléculas
- molécula diatómica: cualquier molécula formada por dos átomos
- compuestos moleculares: contiene más de un tipo de átomo
- Fórmulas moleculares y empíricas
-
- fórmulas moleculares: fórmulas químicas que indican el número real de átomos


-
- fórmula empírica: fórmulas químicas que solo dan el número relativo de átomos
-
-
- Moléculas de imágenes
-
-
-
fórmulas estructurales: muestra qué átomos están unidos a otros átomos
-
-
-
dibujo en perspectiva: da una idea de la forma tridimensional de una molécula
-
-
-
modelos de bola y palo: muestra los átomos como bolas unidas por palos
-
-
- modelo de relleno de espacio: representación precisa de cómo se verían los átomos

2.7: Iones y compuestos iónicos
- partícula cargada de iones formada por la eliminación o adición de un electrón
- catión – ion con carga positiva
- anión – ion con carga negativa
- los átomos metálicos tienden a perder electrones
- los átomos no metálicos tienden a ganar electrones
- iones poliatómicos: átomos unidos que tienen una carga neta positiva o negativa
- Predicción de cargas iónicas
-
- los metales alcalinos forman 1+ iones
- tierra alcalina de 2+ iones
- los halógenos forman 1- iones
- grupo 6A de 2 iones
- Compuestos iónicos
-
- compuesto iónico: un compuesto que contiene iones cargados positiva y negativamente
- Los compuestos iónicos son generalmente combinaciones de metales y no metales
- los compuestos moleculares son generalmente no metales solamente
2.8: Nombramiento de compuestos inorgánicos
- nomenclatura química – la denominación de sustancias
- más de 10 millones de sustancias químicas conocidas
- compuestos orgánicos – contienen carbono
- compuestos inorgánicos – todo lo demás
- iones positivos
-
- los cationes formados a partir de átomos tienen el mismo nombre que el metal
- si un metal puede formar cationes de diferentes cargas, la carga positiva viene dada por un número romano entre paréntesis después del nombre del metal
- los cationes formados a partir de átomos no metálicos tienen nombres que terminan en –ium
- Iones negativos
- Los aniones monoatómicos tienen nombres formados al soltar el final del nombre del elemento y agregar el final –ide
- Los aniones poliatómicos que contienen oxígeno tienen nombres que terminan en –ate o –ite
- llamados oxianiones
-
- los aniones derivados de la adición de H + a un oxianión se nombran agregando como prefijo la palabra hidrógeno o dihidrógeno, según corresponda
-
- Compuestos iónicos
-
- los nombres de los compuestos iónicos son el nombre del catión seguido del nombre del anión
-
-
- Nombres y fórmulas de ácidos
-
-
- los ácidos se basan en aniones cuyos nombres terminan en –ide tienen ácidos asociados que tienen el prefijo hidro- y una terminación –ic
- ácidos basados en aniones cuyos nombres terminan en –ate o -ite
| Anión | Ácido |
|---|---|
| ____ide | Ácido hidro____ico |
| ____ate | Ácido _____ic |
| ____ite | Ácido _____ous |
- Nombres y fórmulas de compuestos moleculares binarios
- el nombre del elemento más alejado a la izquierda en la tabla periódica generalmente se escribe primero
- si los elementos en el mismo grupo bajan uno escrito primero
- el nombre del segundo elemento recibe un –ide final
- prefijos griegos utilizados para indicar el número de átomos de cada elemento
- si el prefijo termina en a o o y el nombre del anión comienza con una vocal, el a o o se descarta
| Prefijo | Significado |
|---|---|
| Mono- | 1 |
| Di- | 2 |
| Tri- | 3 |
| Tetra- | 4 |
| Penta- | 5 |
| Hexa- | 6 |
| Hepta- | 7 |
| Octa- | 8 |
| Nona- | 9 |
| Deca- | 10 |
 fórmulas estructurales: muestra qué átomos están unidos a otros átomos
fórmulas estructurales: muestra qué átomos están unidos a otros átomos  dibujo en perspectiva: da una idea de la forma tridimensional de una molécula
dibujo en perspectiva: da una idea de la forma tridimensional de una molécula 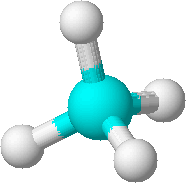 modelos de bola y palo: muestra los átomos como bolas unidas por palos
modelos de bola y palo: muestra los átomos como bolas unidas por palos