En cualquier proceso electroquímico, los electrones fluyen de una sustancia química a otra, impulsados por una reacción de oxidación-reducción (redox). Una reacción redox ocurre cuando los electrones se transfieren de una sustancia que se oxida a una que se está reduciendo. El reductor es la sustancia que pierde electrones y se oxida en el proceso; el oxidante es la especie que gana electrones y se reduce en el proceso. La energía potencial asociada está determinada por la diferencia de potencial entre los electrones de valencia en átomos de diferentes elementos.
Debido a que es imposible tener una reducción sin una oxidación y viceversa, una reacción redox puede describirse como dos medias reacciones , una que representa el proceso de oxidación y otra el proceso de reducción. Para la reacción de zinc con bromo, la reacción química general es la siguiente:
[ ce {Zn (s) + Br2 (aq) rightarrow Zn ^ {2+} (aq) + 2Br ^ {-} (aq)} label {20.3.1} ]
Las semirreacciones son las siguientes:
semirreacción de reducción:
[ ce {Br2 (aq) + 2e ^ {-} rightarrow 2Br ^ {-} (aq)} label {20.3.2} ]
semirreacción de oxidación:
[ ce {Zn (s) rightarrow Zn ^ {2+} (aq) + 2e ^ {-}} label {20.3.3} ]
Cada media reacción se escribe para mostrar lo que realmente está ocurriendo en el sistema; ( ce {Zn} ) es el reductor en esta reacción (pierde electrones), y ( ce {Br2} ) es el oxidante (gana electrones ) Agregar las dos medias reacciones da la reacción química general (Ecuación ( PageIndex {1} )). Una reacción redox se equilibra cuando el número de electrones perdidos por el reductor es igual al número de electrones ganados por el oxidante. Como cualquier ecuación química equilibrada, el proceso general es eléctricamente neutro; es decir, la carga neta es la misma en ambos lados de la ecuación.
En cualquier reacción redox, el número de electrones perdidos por el reductor es igual al número de electrones ganados por el oxidante.
En la mayoría de nuestras discusiones sobre reacciones químicas, hemos asumido que los reactivos están en contacto físico íntimo entre sí. Las reacciones ácido-base, por ejemplo, generalmente se llevan a cabo con el ácido y la base dispersa en una sola fase, como una solución líquida. Sin embargo, con las reacciones redox, es posible separar físicamente las medias reacciones de oxidación y reducción en el espacio, siempre que haya un circuito completo, que incluya una conexión eléctrica externa, como un cable, entre las dos medias reacciones. A medida que avanza la reacción, los electrones fluyen del reductor al oxidante a través de esta conexión eléctrica, produciendo una corriente eléctrica que puede usarse para hacer el trabajo. Un aparato que se usa para generar electricidad a partir de una reacción redox espontánea o, por el contrario, que usa electricidad para impulsar una reacción redox no espontánea se llama célula electroquímica .
Hay dos tipos de celdas electroquímicas: celdas galvánicas y celdas electrolíticas. Las células galvánicas llevan el nombre del físico y médico italiano Luigi Galvani (1737-1798), quien observó que los músculos disecados de las ancas de rana se contraían cuando se aplicaba una pequeña descarga eléctrica, lo que demuestra la naturaleza eléctrica de los impulsos nerviosos. Una célula galvánica (voltaica) usa la energía liberada durante una reacción redox espontánea ( (ΔG <0 )) para generar electricidad. Este tipo de célula electroquímica a menudo se denomina célula voltaica después de su inventor, el físico italiano Alessandro Volta (1745-1827). En contraste, una célula electrolítica consume energía eléctrica de una fuente externa, usándola para provocar una reacción redox no espontánea (ΔG> 0). Ambos tipos contienen dos electrodos , que son metales sólidos conectados a un circuito externo que proporciona una conexión eléctrica entre las dos partes del sistema (Figura ( PageIndex {1} )). La semirreacción de oxidación ocurre en un electrodo (el ánodo ), y la semirreacción de reducción ocurre en el otro (el cátodo ). Cuando el circuito está cerrado, los electrones fluyen desde el ánodo al cátodo. Los electrodos también están conectados por un electrolito, una sustancia iónica o solución que permite que los iones se transfieran entre los compartimentos del electrodo, manteniendo así la neutralidad eléctrica del sistema. En esta sección, nos enfocamos en las reacciones que ocurren en las células galvánicas.
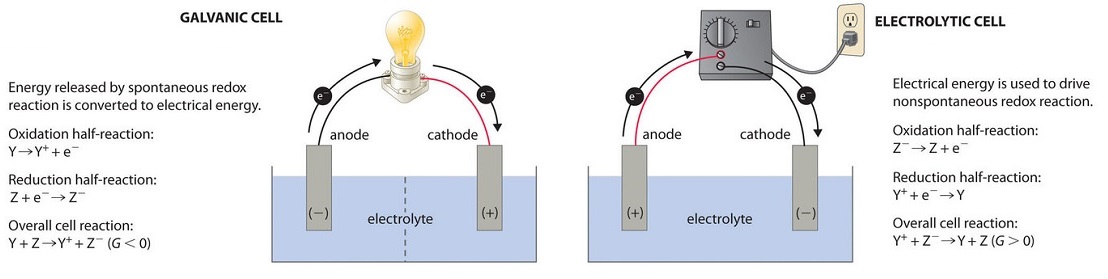
Células voltaicas (galvánicas)
Para ilustrar los principios básicos de una celda galvánica, consideremos la reacción del zinc metálico con ión cúprico (Cu 2 + ) para dar cobre metálico y Zn 2 + ion. La ecuación química equilibrada es la siguiente:
[ ce {Zn (s) + Cu ^ {2+} (aq) rightarrow Zn ^ {2+} (aq) + Cu (s)} label {20.3.4} ] [19459012 ]
Podemos hacer que esta reacción ocurra insertando una varilla de zinc en una solución acuosa de sulfato de cobre (II). A medida que avanza la reacción, la barra de zinc se disuelve y se forma una masa de cobre metálico. Estos cambios ocurren espontáneamente, pero toda la energía liberada es en forma de calor en lugar de una forma que se puede utilizar para hacer el trabajo.
Esta misma reacción puede llevarse a cabo utilizando la celda galvánica ilustrada en la Figura ( PageIndex {3a} ). Para ensamblar la celda, se inserta una tira de cobre en un vaso de precipitados que contiene una solución 1 M de iones Cu 2 + , y se inserta una tira de zinc en un vaso de precipitados diferente que contiene un Solución 1 M de Zn 2 + iones. Las dos tiras de metal, que sirven como electrodos, están conectadas por un cable, y los compartimentos están conectados por un puente de sal , un tubo en forma de U insertado en ambas soluciones que contiene un líquido concentrado o un electrolito gelificado. Los iones en el puente de sal se seleccionan para que no interfieran con la reacción electroquímica al oxidarse o reducirse o al formar un precipitado o complejo; los cationes y aniones comúnmente utilizados son Na + o K + y NO 3 – o SO 4 ] 2− , respectivamente. (Los iones en el puente de sal no tienen que ser los mismos que los de la pareja redox en ninguno de los compartimentos.) Cuando se cierra el circuito, se produce una reacción espontánea: el zinc metálico se oxida a Zn 2 [ 19459027] + iones en el electrodo de zinc (el ánodo) y Cu 2 + los iones se reducen a Cu metal en el electrodo de cobre (el cátodo). A medida que avanza la reacción, la tira de zinc se disuelve y la concentración de iones Zn 2 + en los zn 2 + aumenta; simultáneamente, la tira de cobre gana masa y la concentración de iones Cu 2 + en la solución de Cu 2 + disminuye (Figura ( PageIndex {3b} )). Por lo tanto, hemos llevado a cabo la misma reacción que con un vaso de precipitados único, pero esta vez las semirreacciones oxidativas y reductoras están físicamente separadas entre sí. Los electrones que se liberan en el ánodo fluyen a través del cable, produciendo una corriente eléctrica. Por lo tanto, las células galvánicas transforman la energía química en energía eléctrica que luego se puede utilizar para hacer el trabajo.
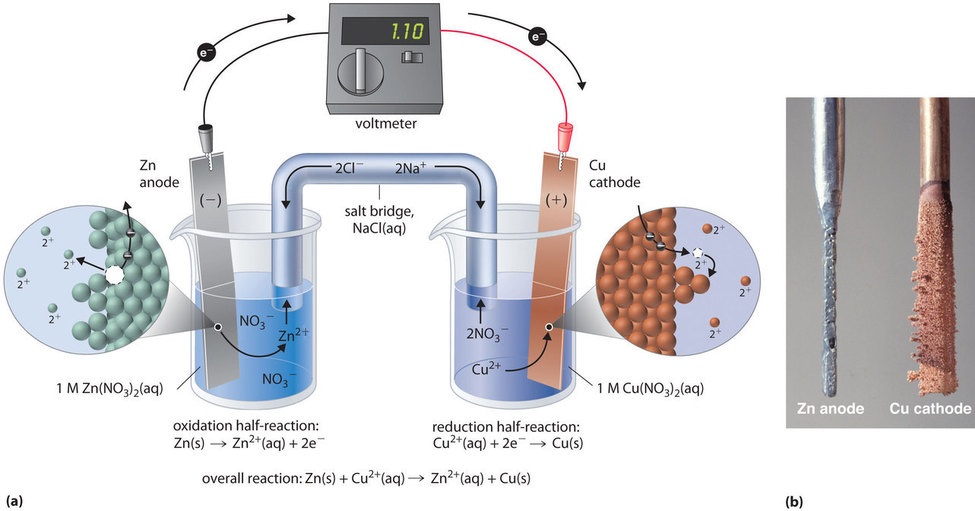
El electrolito en el puente de sal tiene dos propósitos: completa el circuito llevando carga eléctrica y mantiene la neutralidad eléctrica en ambas soluciones al permitir que los iones migren entre ellas. La identidad de la sal en un puente de sal no es importante, siempre que los iones componentes no reaccionen o experimenten una reacción redox en las condiciones de funcionamiento de la célula. Sin dicha conexión, la carga positiva total en la solución Zn 2 + aumentaría a medida que el zinc metálico se disuelve, y la carga positiva total en el Cu 2 La solución + disminuiría. El puente de sal permite que las cargas sean neutralizadas por un flujo de aniones en la solución Zn 2 + y un flujo de cationes en el Cu 2 + solución. En ausencia de un puente de sal u otra conexión similar, la reacción cesaría rápidamente porque no se podía mantener la neutralidad eléctrica.
Se puede usar un voltímetro para medir la diferencia en el potencial eléctrico entre los dos compartimentos. Abrir el interruptor que conecta los cables al ánodo y al cátodo evita que fluya una corriente, por lo que no se produce reacción química. Sin embargo, con el interruptor cerrado, el circuito externo está cerrado y una corriente eléctrica puede fluir desde el ánodo al cátodo. El potencial ( (E_ {cell} )) de la celda, medido en voltios, es la diferencia en el potencial eléctrico entre las dos medias reacciones y está relacionado con la energía necesaria para mover una partícula cargada En un campo eléctrico. En la celda que hemos descrito, el voltímetro indica un potencial de 1.10 V (Figura ( PageIndex {3a} )). Debido a que los electrones de la semirreacción de oxidación se liberan en el ánodo, el ánodo en una celda galvánica está cargado negativamente. El cátodo, que atrae electrones, tiene carga positiva.
No todos los electrodos experimentan una transformación química durante una reacción redox. El electrodo puede estar hecho de un metal inerte y altamente conductor como el platino para evitar que reaccione durante un proceso redox, donde no aparece en la reacción electroquímica general. Este fenómeno se ilustra en el Ejemplo ( PageIndex {1} ).
Una célula galvánica (voltaica) convierte la energía liberada por una reacción química espontánea en energía eléctrica. Una célula electrolítica consume energía eléctrica de una fuente externa para conducir una reacción química no espontánea .
Construcción de diagramas celulares (notación celular)
Debido a que es algo engorroso describir cualquier celda galvánica dada en palabras, se ha desarrollado una notación más conveniente. En esta notación de línea, llamada diagrama de celda, la identidad de los electrodos y el contenido químico de los compartimentos están indicados por sus fórmulas químicas, con el ánodo escrito en el extremo izquierdo y el cátodo en el extremo derecho. Los límites de fase se muestran mediante líneas verticales simples, y el puente de sal, que tiene dos límites de fase, mediante una línea vertical doble. Por lo tanto, el diagrama de celda para la celda ( ce {Zn / Cu} ) que se muestra en la Figura ( PageIndex {3a} ) se escribe de la siguiente manera:
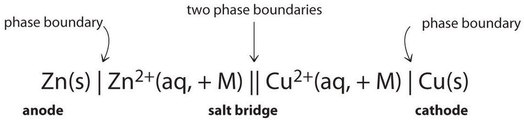
Las células galvánicas pueden tener arreglos distintos a los ejemplos que hemos visto hasta ahora. Por ejemplo, el voltaje producido por una reacción redox se puede medir con mayor precisión utilizando dos electrodos sumergidos en un vaso de precipitados único que contiene un electrolito que completa el circuito. Esta disposición reduce los errores causados por la resistencia al flujo de carga en un límite, llamado potencial de unión . Un ejemplo de este tipo de celda galvánica es el siguiente:
[ ce {Pt (s) , | , H2 (g) | HCl (aq) , | , AgCl (s) , Ag (s)} label {20.3.5} ]
Este diagrama de celda no incluye una línea vertical doble que represente un puente de sal porque no hay un puente de sal que proporcione una unión entre dos soluciones diferentes. Además, las concentraciones de la solución no se han especificado, por lo que no se incluyen en el diagrama celular. Las medias reacciones y la reacción general para esta célula son las siguientes:
reacción catódica:
[ ce {AgCl (s) + e ^ {-} rightarrow Ag (s) + Cl ^ {-} (aq)} label {20.3.6} ]
reacción anódica:
[ dfrac {1} {2} , mathrm {H_ {2 (g)}} rightarrow mathrm {H ^ + _ {(aq)}} + mathrm {e ^ -} etiqueta {20.3.7} ]
en general:
[ mathrm {AgCl _ {(s)}} + dfrac {1} {2} mathrm {H_ {2 (g)}} rightarrow mathrm {Ag _ {(s)}} + mathrm {Cl ^ -_ {(aq)}} + mathrm {H ^ + _ {(aq)}} label {20.3.8} ]
Una celda galvánica de un solo compartimiento exhibirá inicialmente el mismo voltaje que una celda galvánica construida usando compartimentos separados, pero se descargará rápidamente debido a la reacción directa del reactivo en el ánodo con el miembro oxidado de la pareja redox catódica. En consecuencia, las células de este tipo no son particularmente útiles para producir electricidad.
Resumen
Una célula galvánica (voltaica) utiliza la energía liberada durante una reacción redox espontánea para generar electricidad, mientras que una célula electrolítica consume energía eléctrica de una fuente externa para forzar una reacción. La electroquímica es el estudio de la relación entre la electricidad y las reacciones químicas. La reacción de oxidación-reducción que ocurre durante un proceso electroquímico consiste en dos medias reacciones, una que representa el proceso de oxidación y otra el proceso de reducción. La suma de las medias reacciones da la reacción química general. La reacción redox general se equilibra cuando el número de electrones perdidos por el reductor es igual al número de electrones ganados por el oxidante. Se produce una corriente eléctrica a partir del flujo de electrones del reductor al oxidante. Una célula electroquímica puede generar electricidad a partir de una reacción redox espontánea o consumir electricidad para generar una reacción no espontánea. En una célula galvánica (voltaica), la energía de una reacción espontánea genera electricidad, mientras que en una célula electrolítica, la energía eléctrica se consume para impulsar una reacción redox no espontánea. Ambos tipos de celdas usan dos electrodos que proporcionan una conexión eléctrica entre sistemas que están separados en el espacio. La semirreacción oxidativa se produce en el ánodo, y la semirreacción reductora se produce en el cátodo. Un puente de sal conecta las soluciones separadas, permitiendo que los iones migren a cualquiera de las soluciones para garantizar la neutralidad eléctrica del sistema. Un voltímetro es un dispositivo que mide el flujo de corriente eléctrica entre dos medias reacciones. El potencial de una celda, medido en voltios, es la energía necesaria para mover una partícula cargada en un campo eléctrico. Se puede describir una celda electroquímica usando una notación de línea llamada diagrama de celda, en la cual las líneas verticales indican los límites de fase y la ubicación del puente de sal. La resistencia al flujo de carga en un límite se llama potencial de unión.