Química nuclear es el estudio de reacciones que implican cambios en la estructura nuclear. El capítulo sobre átomos, moléculas e iones introdujo la idea básica de la estructura nuclear, que el núcleo de un átomo está compuesto de protones y, con la excepción de ( ce {^ 1_1H} ), neutrones. Recuerde que el número de protones en el núcleo se llama número atómico ( (Z )) del elemento, y la suma del número de protones y el número de neutrones es el número de masa ( (A )). Los átomos con el mismo número atómico pero diferentes números de masa son isótopos del mismo elemento. Cuando nos referimos a un solo tipo de núcleo, a menudo usamos el término nucleido y lo identificamos por la notación:
[ large ce {^ {A} _ {Z} X} label {Eq1a} ]
donde
- (X ) es el símbolo del elemento,
- (A ) es el número de masa y
- (Z ) es el número atómico.
A menudo se hace referencia a un nucleido por el nombre del elemento seguido de un guión y el número de masa. Por ejemplo, ( ce {^ {14} _6C} ) se llama “carbono-14”.
Los protones y neutrones, denominados colectivamente nucleones , se agrupan estrechamente en un núcleo. Con un radio de aproximadamente 10 −15 metros, un núcleo es bastante pequeño en comparación con el radio de todo el átomo, que es de aproximadamente 10 −10 metros. Los núcleos son extremadamente densos en comparación con la materia a granel, con un promedio de (1,8 veces 10 ^ {14} ) gramos por centímetro cúbico. Por ejemplo, el agua tiene una densidad de 1 gramo por centímetro cúbico, y el iridio, uno de los elementos más densos conocidos, tiene una densidad de 22,6 g / cm 3 . Si la densidad de la Tierra fuera igual a la densidad nuclear promedio, el radio de la Tierra sería de solo unos 200 metros (el radio real de la Tierra es aproximadamente (6.4 veces 10 ^ 6 ) metros, 30,000 veces más grande).
Los cambios en los núcleos que resultan en cambios en sus números atómicos, números de masa o estados de energía son reacciones nucleares . Para describir una reacción nuclear, utilizamos una ecuación que identifica los nucleidos involucrados en la reacción, sus números de masa y números atómicos, y las otras partículas involucradas en la reacción.
Ecuaciones nucleares
Una ecuación de reacción química equilibrada refleja el hecho de que durante una reacción química, los enlaces se rompen y se forman, y los átomos se reorganizan, pero el número total de átomos de cada elemento se conserva y no cambia. Una ecuación de reacción nuclear equilibrada indica que hay una reorganización durante una reacción nuclear, pero de partículas subatómicas en lugar de átomos. Las reacciones nucleares también siguen las leyes de conservación, y se equilibran de dos maneras:
- La suma de los números de masa de los reactivos es igual a la suma de los números de masa de los productos.
- La suma de las cargas de los reactivos es igual a la suma de las cargas de los productos.
Si se conoce el número atómico y el número de masa de todas menos una de las partículas en una reacción nuclear, podemos identificar la partícula equilibrando la reacción. Por ejemplo, podríamos determinar que ( ce {^ {17} _8O} ) es un producto de la reacción nuclear de ( ce {^ {14} _7N} ) y ( ce {^ 4_2He} ) si supiéramos que un protón, ( ce {^ 1_1H} ), era uno de los dos productos. El ejemplo ( PageIndex {1} ) muestra cómo podemos identificar un nucleido equilibrando la reacción nuclear.
Los dos tipos generales de reacciones nucleares son las reacciones de desintegración nuclear y las reacciones de transmutación nuclear . En una reacción de desintegración nuclear , también llamada desintegración radiactiva, un núcleo inestable emite radiación y se transforma en el núcleo de uno o más elementos. Los núcleos hijos resultantes tienen una masa más baja y son más bajos en energía (más estables) que el núcleo padre que se descompuso. En contraste, en una reacción de transmutación nuclear , un núcleo reacciona con una partícula subatómica u otro núcleo para formar un núcleo de producto que es más masivo que el material de partida. Como veremos, las reacciones de desintegración nuclear ocurren espontáneamente en todas las condiciones, pero las reacciones de transmutación nuclear ocurren solo en condiciones muy especiales, como la colisión de un haz de partículas altamente energéticas con un núcleo objetivo o en el interior de las estrellas. Comenzamos esta sección considerando las diferentes clases de núcleos radiactivos, junto con sus reacciones de desintegración nuclear características y la radiación que emiten.
Las reacciones de desintegración nuclear ocurren espontáneamente en todas las condiciones, mientras que se inducen reacciones de transmutación nuclear.
Reacciones de descomposición nuclear
Así como usamos el número y tipo de átomos presentes para equilibrar una ecuación química, podemos usar el número y tipo de nucleones presentes para escribir una ecuación nuclear equilibrada para una reacción de desintegración nuclear. Este procedimiento también nos permite predecir la identidad del núcleo principal o secundario si se conoce la identidad de uno solo. Independientemente del modo de descomposición, el número total de nucleones se conserva en todas las reacciones nucleares.
Para describir las reacciones de desintegración nuclear, los químicos han extendido la notación (^ A _Z textrm {X} ) para que los nucleidos incluyan emisiones radiactivas. La tabla ( PageIndex {1} ) enumera el nombre y el símbolo de cada tipo de radiación emitida. La adición más notable es el positrón , una partícula que tiene la misma masa que un electrón pero una carga positiva en lugar de una carga negativa.
| Identidad | Símbolo | Cargo | Misa (amu) |
|---|---|---|---|
| núcleo de helio | (^ 4_2 alpha ) | +2 | 4.001506 |
| electrón | (^ 0 _ {- 1} beta ) o ( beta ^ – ) | −1 | 0,000549 |
| fotón | (_ 0 ^ 0 gamma ) | – | – |
| neutrones | (^ 1_0 textrm n ) | 0 | 1.008665 |
| protón | (^ 1_1 textrm p ) | +1 | 1.007276 |
| positrón | (^ 0 _ {+ 1} beta ) o ( beta ^ + ) | +1 | 0,000549 |
Al igual que la notación utilizada para indicar isótopos, el superíndice superior izquierdo en el símbolo de una partícula da el número de masa, que es el número total de protones y neutrones. Para un protón o un neutrón, A = 1. Debido a que ni un electrón ni un positrón contienen protones o neutrones, su número de masa es 0. Sin embargo, los números no deben tomarse literalmente, ya que significa que estas partículas tener masa cero; La eyección de una partícula beta (un electrón) simplemente tiene un efecto insignificante sobre la masa de un núcleo.
Del mismo modo, el subíndice inferior izquierdo da la carga de la partícula. Como los protones tienen una carga positiva, Z = +1 para un protón. En contraste, un neutrón no contiene protones y es eléctricamente neutro, entonces Z = 0. En el caso de un electrón, Z = −1, y para un positrón, Z = +1. Debido a que los rayos γ son fotones de alta energía, tanto A como Z son 0. En algunos casos, se usan dos símbolos diferentes para partículas que son idénticas pero producidas de diferentes maneras. Por ejemplo, el símbolo (^ 0 _ {- 1} textrm e ), que generalmente se simplifica a e – , representa un electrón libre o un electrón asociado con un átomo, mientras que el símbolo ( ^ 0 _ {- 1} beta ), que a menudo se simplifica a β – , denota un electrón que se origina dentro del núcleo, que es una partícula β. De manera similar, (^ 4_ {2} textrm {He} ^ {2 +} ) se refiere al núcleo de un átomo de helio, y (^ 4_ {2} alpha ) denota una partícula idéntica que ha sido expulsada de un núcleo más pesado.
Hay seis tipos fundamentalmente diferentes de reacciones de desintegración nuclear, y cada uno libera un tipo diferente de partícula o energía. Las características esenciales de cada reacción se muestran en Figura ( PageIndex {1} ) . Los más comunes son la desintegración alfa y beta y la emisión gamma, pero los otros son esenciales para comprender las reacciones de desintegración nuclear.
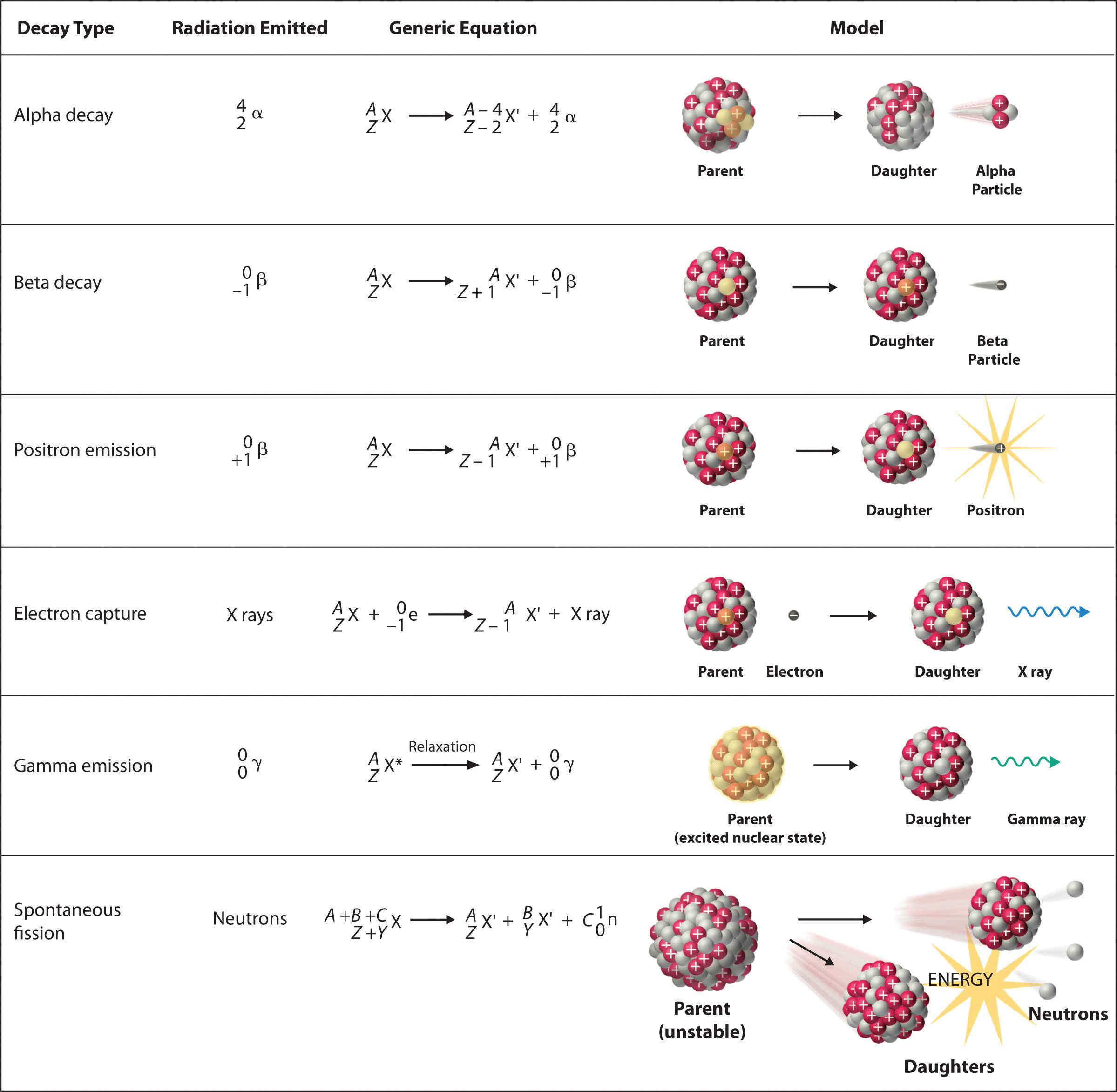
Decadencia alfa ( alpha )
Muchos núcleos con números de masa superiores a 200 experimentan desintegración alfa (α) , lo que da como resultado la emisión de un núcleo de helio-4 como una partícula alfa (α) , (^ 4_ {2} alpha ). La reacción general es la siguiente:
[ underset { textrm {parent}} {^ A_Z textrm X} rightarrow underset { textrm {daughter}} {^ {A-4} _ {Z-2} textrm X ‘} + underset { textrm {alpha} \ textrm {partícula}} {^ 4_2 alpha} label {Eq1} ]
El nucleido hijo contiene dos protones menos y dos neutrones menos que el padre. Por lo tanto, la emisión de partículas α produce un núcleo hijo con un número de masa A – 4 y una carga nuclear Z – 2 en comparación con el núcleo original. El radio-226, por ejemplo, sufre desintegración alfa para formar radón-222:
[^ {226} _ {88} textrm {Ra} rightarrow ^ {222} _ {86} textrm {Rn} + ^ {4} _ {2} alpha label {Eq2} ]
Debido a que los nucleones se conservan en esta y todas las demás reacciones nucleares, la suma de los números de masa de los productos, 222 + 4 = 226, es igual al número de masa del progenitor. Del mismo modo, la suma de los números atómicos de los productos, 86 + 2 = 88, es igual al número atómico del padre. Así, la ecuación nuclear es equilibrada.
Así como el número total de átomos se conserva en una reacción química, el número total de nucleones se conserva en una reacción nuclear.
Beta ( beta ^ – ) Decaimiento
Los núcleos que contienen demasiados neutrones a menudo sufren desintegración beta (β) , en la que un neutrón se convierte en un protón y un electrón de alta energía que se expulsa del núcleo como una partícula β: [ 19459013]
[ underset { textrm {inestable} \ textrm {neutron in} \ textrm {nucleus}} {^ 1_0 textrm n} rightarrow underset { textrm {proton} \ textrm {retenido} \ textrm {por núcleo}} {^ {1} _ {1} textrm p} + underset { textrm {partícula beta} \ textrm {emitido por} \ textrm {núcleo} } {^ 0 _ {- 1} beta} label {Eq3} ]
La reacción general para la desintegración beta es, por lo tanto,
[ underset { textrm {parent}} {^ A_Z textrm X} rightarrow underset { textrm {daughter}} {^ {A} _ {Z + 1} textrm X ‘} + subrayado { textrm {partícula beta}} {^ 0 _ {- 1} beta} label {Eq4} ]
Aunque la desintegración beta no cambia el número de masa del núcleo, sí produce un aumento de +1 en el número atómico debido a la adición de un protón en el núcleo hijo. Por lo tanto, la desintegración beta disminuye la relación de neutrones a protones, moviendo el núcleo hacia la banda de núcleos estables. Por ejemplo, el carbono 14 sufre desintegración beta para formar nitrógeno 14:
[^ {14} _ {6} textrm {C} rightarrow ^ {14} _ {7} textrm {N} + , ^ {0} _ {- 1} beta nonumber ]
Una vez más, se conserva el número de nucleones y se equilibran las cargas. Los núcleos padre e hija tienen el mismo número de masa, 14, y la suma de los números atómicos de los productos es 6, que es el mismo que el número atómico del padre carbono-14.
Emisión de positrones ( beta ^ + )
Debido a que un positrón tiene la misma masa que un electrón pero carga opuesta, la emisión de positrones es lo opuesto a la desintegración beta. Por lo tanto, la emisión de positrones es característica de los núcleos pobres en neutrones, que se descomponen al transformar un protón en un neutrón y emitir un positrón de alta energía:
[^ {1} _ {1} textrm {p} ^ + rightarrow ^ {1} _ {0} textrm {n} + , ^ {0} _ {+ 1} beta ^ + label {Eq6} ]
La reacción general para la emisión de positrones es por lo tanto
[ underset { textrm {parent}} {^ A_Z textrm X} rightarrow underset { textrm {daughter}} {^ {A} _ {Z-1} textrm X ‘} + subrayado { textrm {positron}} {^ 0 _ {+ 1} beta ^ +} nonumber ]
Al igual que la desintegración beta, la emisión de positrones no cambia el número de masa del núcleo. En este caso, sin embargo, el número atómico del núcleo hijo es menor en 1 que el del padre. Por lo tanto, la relación de neutrones a protones ha aumentado, nuevamente acercando el núcleo a la banda de núcleos estables. Por ejemplo, el carbono-11 sufre emisión de positrones para formar boro-11:
[^ {11} _ {6} textrm {C} rightarrow ^ {11} _ {5} textrm {B} + , ^ {0} _ {+ 1} beta ^ + no número ]
Los nucleones se conservan y el saldo de las cargas. El número de masa, 11, no cambia, y la suma de los números atómicos de los productos es 6, lo mismo que el número atómico del nucleido de carbono-11 original.
Captura de electrones
Un núcleo pobre en neutrones puede decaer ya sea por emisión de positrones o captura de electrones (CE) , en el que un electrón en una capa interna reacciona con un protón para producir un neutrón:
[^ {1} _ {1} textrm {p} + ; ^ {0} _ {- 1} textrm {e} rightarrow , ^ {1} _ {0} textrm n label {Eq9} ]
Cuando un segundo electrón se mueve desde una capa externa para tomar el lugar del electrón de menor energía que fue absorbido por el núcleo, se emite una radiografía. La reacción general para la captura de electrones es, por lo tanto,
[ underset { textrm {parent}} {^ A_Z textrm X} + underset { textrm {electron}} {^ 0 _ {- 1} textrm e} rightarrow underset { textrm { hija}} {^ {A} _ {Z-1} textrm X ‘} + textrm {rayos x} nonumber ]
La captura de electrones no cambia el número de masa del núcleo porque tanto el protón que se pierde como el neutrón que se forma tienen un número de masa de 1. Sin embargo, al igual que con la emisión de positrones, el número atómico del núcleo hijo es menor por 1 que el de los padres. Una vez más, la relación de neutrones a protones ha aumentado, moviendo el núcleo hacia la banda de núcleos estables. Por ejemplo, el hierro-55 se desintegra por captura de electrones para formar manganeso-55, que a menudo se escribe de la siguiente manera:
[^ {55} _ {26} textrm {Fe} overset { textrm {EC}} { rightarrow} , ^ {55} _ {25} textrm {Mn} + textrm { rayos x} nonumber ]
Los números atómicos de los nucleidos padre e hija difieren en Ecuación 20.2.11 , aunque los números de masa son los mismos. Para escribir una ecuación nuclear equilibrada para esta reacción, debemos incluir explícitamente el electrón capturado en la ecuación:
[^ {55} _ {26} textrm {Fe} + , ^ {0} _ {- 1} textrm {e} rightarrow , ^ {55} _ {25} textrm { Mn} + textrm {rayos x} nonumber ]
Tanto la emisión de positrones como la captura de electrones se observan generalmente para los nucleidos con bajas relaciones de neutrones a protones, pero las tasas de descomposición de los dos procesos pueden ser muy diferentes.
Emisión Gamma ( gamma )
Muchas reacciones de desintegración nuclear producen núcleos hijos que están en un estado nuclear excitado, que es similar a un átomo en el que un electrón ha sido excitado a un orbital de mayor energía para dar un estado electrónico excitado. Así como un electrón en un estado excitado electrónico emite energía en forma de fotón cuando regresa al estado fundamental, un núcleo en un estado excitado libera energía en forma de fotón cuando regresa al estado fundamental. Estos fotones de alta energía son rayos γ. La emisión Gamma ( ( gamma )) puede ocurrir virtualmente instantáneamente, como ocurre en la desintegración alfa del uranio-238 al torio-234, donde el asterisco denota un estado excitado :
[^ {238} _ {92} textrm {U} rightarrow , underset { textrm {excitado} \ textrm {nuclear} \ textrm {estado}} {^ {234} _ {90} textrm {Th *}} + ^ {4} _ {2} alpha xrightarrow { textrm {relajación} ,} , ^ {234} _ {90} textrm {Th} + ce {^ 0_0 gamma} nonumber ]
Si ignoramos el evento de descomposición que creó el núcleo excitado, entonces
[^ {234} _ {88} textrm {Th *} rightarrow , ^ {234} _ {88} textrm {Th} + ^ {0} _ {0} gamma nonumber ]
o más generalmente,
[^ {A} _ {Z} textrm {X *} rightarrow , ^ {A} _ {Z} textrm {X} + ^ {0} _ {0} gamma ] [ 19459013]
La emisión de rayos gamma también puede ocurrir después de un retraso significativo. Por ejemplo, el tecnecio-99 m tiene una vida media de aproximadamente 6 horas antes de emitir un rayo (γ ) para formar tecnecio-99 (el m es para metaestable). Debido a que los rayos γ son energía, su emisión no afecta ni al número de masa ni al número atómico del nucleido hijo. Por lo tanto, la emisión de rayos gamma es el único tipo de radiación que no implica necesariamente la conversión de un elemento a otro, aunque casi siempre se observa junto con alguna otra reacción de desintegración nuclear.
Fisión espontánea
Solo los núcleos muy masivos con altas relaciones de neutrones a protones pueden someterse a fisión espontánea , en la cual el núcleo se rompe en dos piezas que tienen diferentes números atómicos y masas atómicas. Este proceso es más importante para los elementos de transactinida, con Z ≥ 104. La fisión espontánea está invariablemente acompañada por la liberación de grandes cantidades de energía, y generalmente también se acompaña de la emisión de varios neutrones. Un ejemplo es la fisión espontánea de (^ {254} _ {98} textrm {Cf} ), que proporciona una distribución de productos de fisión; un posible conjunto de productos se muestra en la siguiente ecuación:
[^ {254} _ {98} textrm {Cf} rightarrow , ^ {118} _ {46} textrm {Pd} + , ^ {132} _ {52} textrm {Te } + 4 ^ {1} _ {0} textrm {n} nonumber ]
Una vez más, se conserva el número de nucleones. Así, la suma de los números de masa de los productos (118 + 132 + 4 = 254) es igual al número de masa del reactivo. Del mismo modo, la suma de los números atómicos de los productos [46 + 52 + (4 × 0) = 98] es la misma que el número atómico del nucleido original.
Serie de desintegración radiactiva
Los núcleos de todos los elementos con números atómicos mayores que 83 son inestables. Por lo tanto, todos los isótopos de todos los elementos más allá del bismuto en la tabla periódica son radiactivos. Debido a que la desintegración alfa disminuye Z en solo 2, y la emisión de positrones o la captura de electrones disminuye Z en solo 1, es imposible que cualquier nucleido con Z > 85 a decaer a un nucleido hijo estable en un solo paso, excepto por fisión nuclear. En consecuencia, los isótopos radiactivos con Z > 85 generalmente se descomponen en un núcleo hijo que es radiactivo, que a su vez se descompone en un segundo núcleo hijo radiactivo, y así sucesivamente, hasta que finalmente se produce un núcleo estable. Esta serie de reacciones secuenciales de desintegración alfa y beta se denomina serie de desintegración radiactiva . La más común es la serie de descomposición de uranio-238, que produce plomo-206 en una serie de 14 reacciones secuenciales de descomposición alfa y beta ( Figura ( PageIndex {2} ) ). Aunque se puede escribir una serie de desintegración radiactiva para casi cualquier isótopo con Z > 85, solo otras dos ocurren naturalmente: la desintegración de uranio-235 en plomo-207 (en 11 pasos) y torio-232 en plomo -208 (en 10 pasos). Se sabe que una cuarta serie, la descomposición del neptunio-237 a bismuto-209 en 11 pasos, ocurrió en la Tierra primitiva. Con una vida media de “solo” 2,14 millones de años, todo el neptunio-237 presente cuando se formó la Tierra se descompuso hace mucho tiempo, y hoy todo el neptunio en la Tierra es sintético.
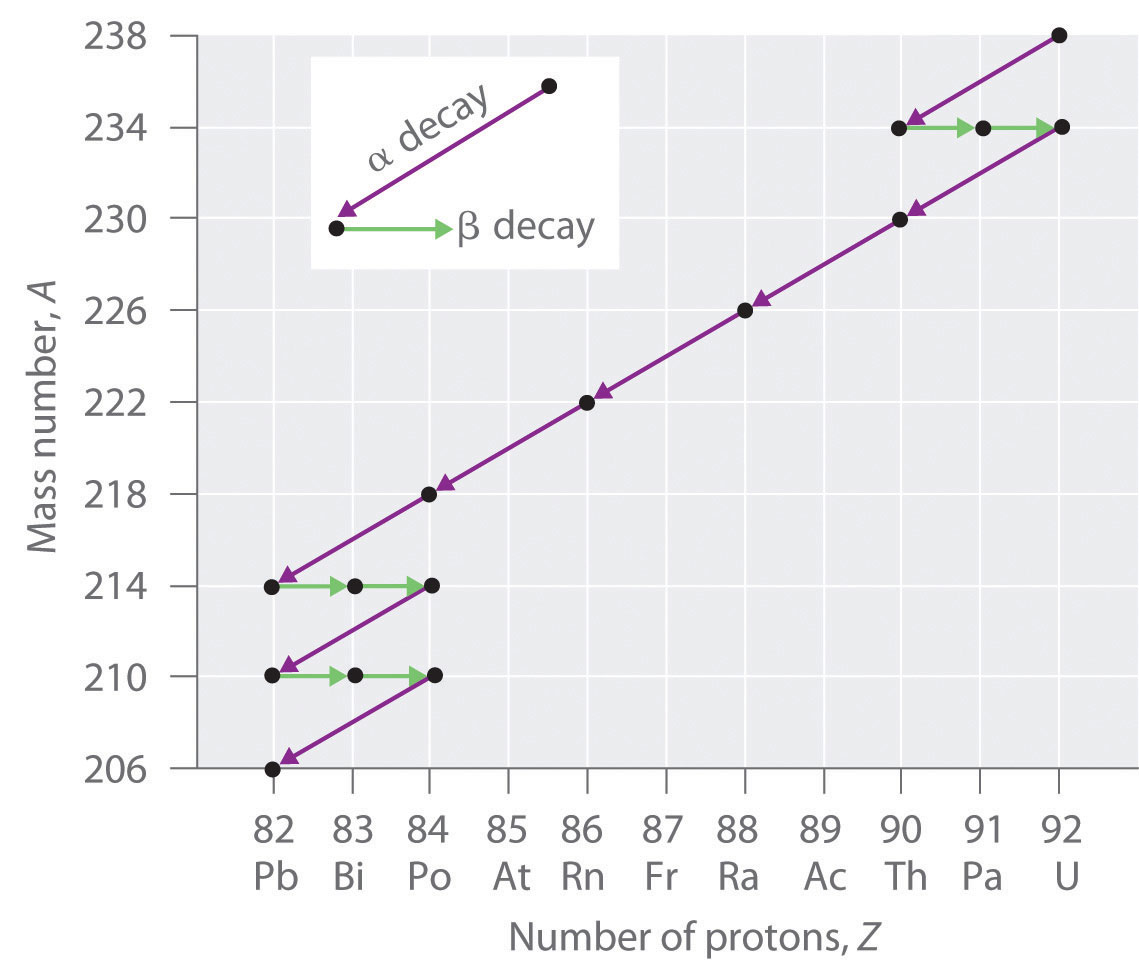
Debido a estas series de desintegración radiactiva, se encuentran pequeñas cantidades de isótopos muy inestables en minerales que contienen uranio o torio. Estos isótopos raros e inestables deberían haberse descompuesto hace mucho tiempo en núcleos estables con un número atómico más bajo, y ya no se encontrarían en la Tierra. Sin embargo, debido a que se generan continuamente por la descomposición del uranio o el torio, sus cantidades han alcanzado un estado estable, en el que su velocidad de formación es igual a su velocidad de descomposición. En algunos casos, la abundancia de los isótopos hijos se puede usar para fechar un material o identificar su origen.
Reacciones nucleares inducidas
El descubrimiento de la radioactividad a fines del siglo XIX mostró que algunos núcleos se transforman espontáneamente en núcleos con un número diferente de protones, produciendo así un elemento diferente. Cuando los científicos se dieron cuenta de que estos isótopos radiactivos naturales se descomponían al emitir partículas subatómicas, se dieron cuenta de que, en principio, debería ser posible llevar a cabo la reacción inversa, convirtiendo un núcleo estable en otro núcleo más masivo bombardeándolo con partículas subatómicas en un reacción de transmutación nuclear.
The first successful nuclear transmutation reaction was carried out in 1919 by Ernest Rutherford, who showed that α particles emitted by radium could react with nitrogen nuclei to form oxygen nuclei. As shown in the following equation, a proton is emitted in the process:
(^{4}_{2}alpha + , ^{14}_{7}textrm{N} rightarrow ,^{17}_{8}textrm{O}+,^{1}_{1}textrm{p}label{Eq17})
Rutherford’s nuclear transmutation experiments led to the discovery of the neutron. He found that bombarding the nucleus of a light target element with an α particle usually converted the target nucleus to a product that had an atomic number higher by 1 and a mass number higher by 3 than the target nucleus. Such behavior is consistent with the emission of a proton after reaction with the α particle. Very light targets such as Li, Be, and B reacted differently, however, emitting a new kind of highly penetrating radiation rather than a proton. Because neither a magnetic field nor an electrical field could deflect these high-energy particles, Rutherford concluded that they were electrically neutral. Other observations suggested that the mass of the neutral particle was similar to the mass of the proton. In 1932, James Chadwick (Nobel Prize in Physics, 1935), who was a student of Rutherford’s at the time, named these neutral particles neutrons and proposed that they were fundamental building blocks of the atom. The reaction that Chadwick initially used to explain the production of neutrons was as follows:
[^{4}_{2}alpha + , ^{9}_{4}textrm{Be} rightarrow ,^{12}_{6}textrm{C}+,^{1}_{0}textrm{n}label{Eq18}]
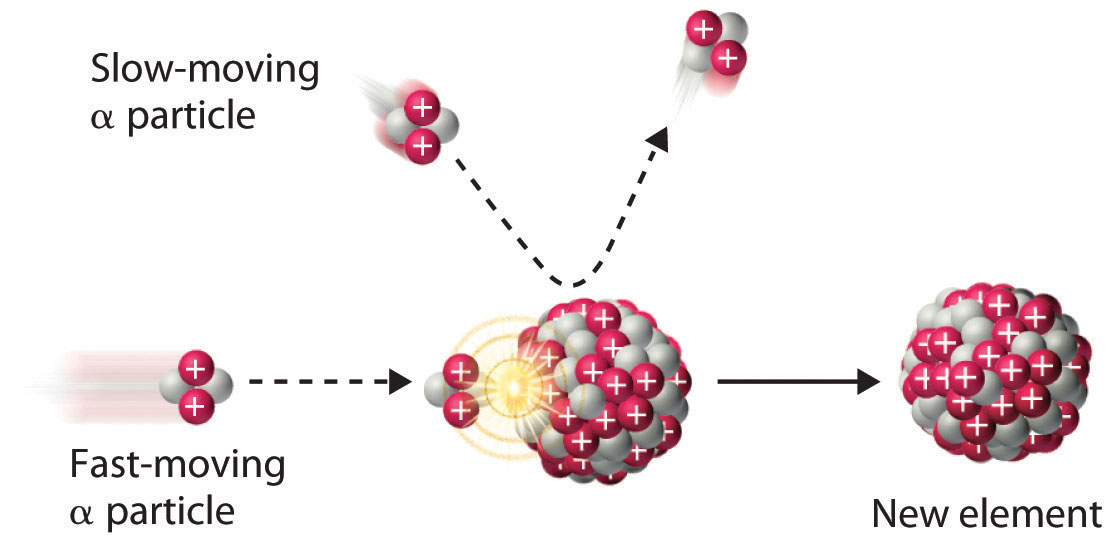
Because α particles and atomic nuclei are both positively charged, electrostatic forces cause them to repel each other. Only α particles with very high kinetic energy can overcome this repulsion and collide with a nucleus ( Figure (PageIndex{3}) ). Neutrons have no electrical charge, however, so they are not repelled by the nucleus. Hence bombardment with neutrons is a much easier way to prepare new isotopes of the lighter elements. In fact, carbon-14 is formed naturally in the atmosphere by bombarding nitrogen-14 with neutrons generated by cosmic rays:
[^{1}_{0}textrm{n} + , ^{14}_{7}textrm{N} rightarrow ,^{14}_{6}textrm{C}+,^{1}_{1}textrm{p}label{Eq19}]
We noted earlier in this section that very heavy nuclides, corresponding to Z ≥ 104, tend to decay by spontaneous fission. Nuclides with slightly lower values of Z , such as the isotopes of uranium ( Z = 92) and plutonium ( Z = 94), do not undergo spontaneous fission at any significant rate. Some isotopes of these elements, however, such as (^{235}_{92}textrm{U}) and (^{239}_{94}textrm{Pu}) undergo induced nuclear fission when they are bombarded with relatively low-energy neutrons, as shown in the following equation for uranium-235 and in Figure (PageIndex{4}) :
[^{235}_{92}textrm{U} + , ^{1}_{0}textrm{n} rightarrow ,^{236}_{92}textrm{U}rightarrow ,^{141}_{56}textrm{Ba}+,^{92}_{36}textrm{Kr}+3^{1}_{0}textrm{n}label{Eq20}]
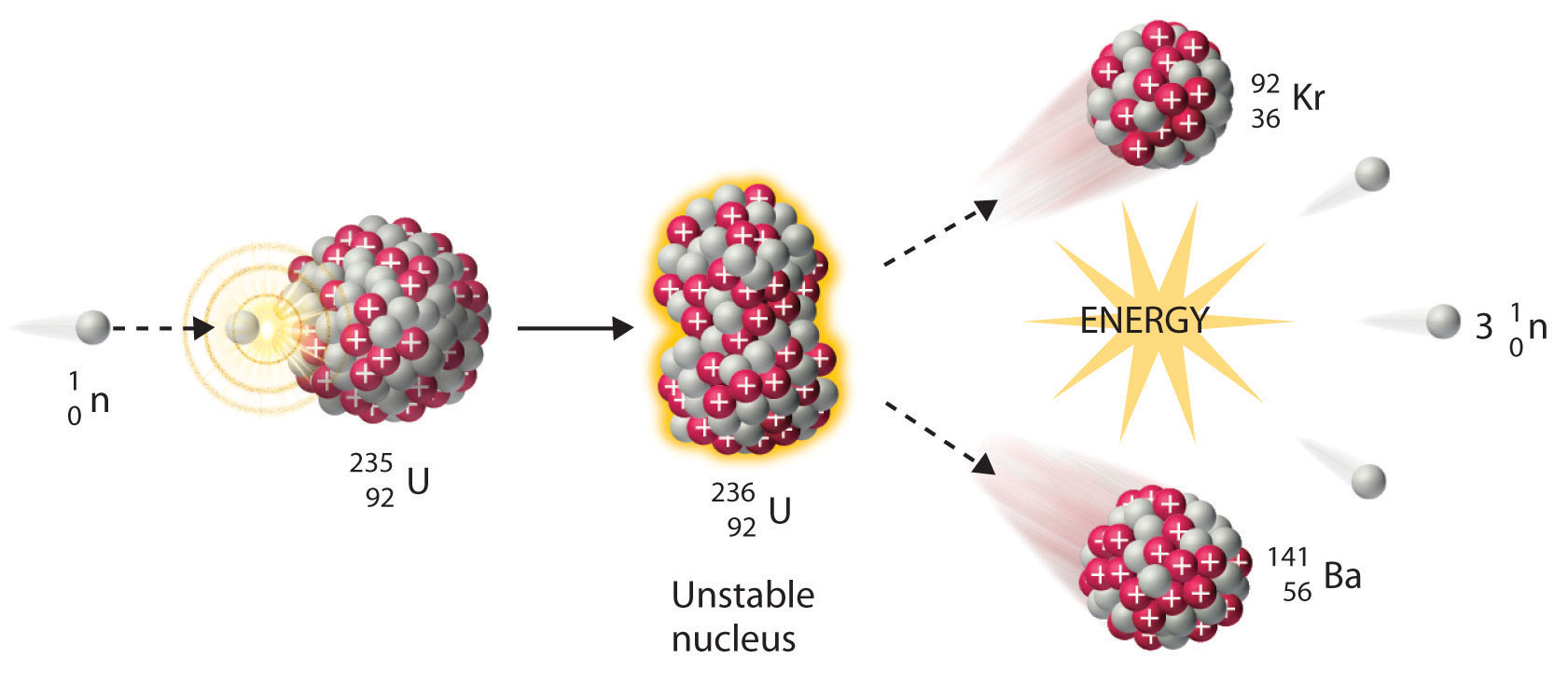
Any isotope that can undergo a nuclear fission reaction when bombarded with neutrons is called a fissile isotope .
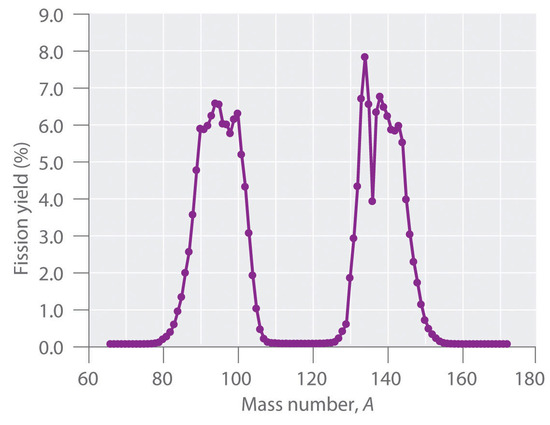
During nuclear fission, the nucleus usually divides asymmetrically rather than into two equal parts, as shown in Figure (PageIndex{4}) . Moreover, every fission event of a given nuclide does not give the same products; more than 50 different fission modes have been identified for uranium-235, for example. Consequently, nuclear fission of a fissile nuclide can never be described by a single equation. Instead, as shown in Figure (PageIndex{5}) , a distribution of many pairs of fission products with different yields is obtained, but the mass ratio of each pair of fission products produced by a single fission event is always roughly 3:2.
Synthesis of Transuranium Elements
Uranium ( Z = 92) is the heaviest naturally occurring element. Consequently, all the elements with Z > 92, the transuranium elements , are artificial and have been prepared by bombarding suitable target nuclei with smaller particles. The first of the transuranium elements to be prepared was neptunium ( Z = 93), which was synthesized in 1940 by bombarding a 238 U target with neutrons. As shown in Equation 20.21 , this reaction occurs in two steps. Initially, a neutron combines with a 238 U nucleus to form 239 U, which is unstable and undergoes beta decay to produce 239 Np:
(^{238}_{92}textrm{U} + , ^{1}_{0}textrm{n} rightarrow ,^{239}_{92}textrm{U}rightarrow ,^{239}_{93}textrm{Np}+,^{0}_{-1}betalabel{Eq21})
Subsequent beta decay of 239 Np produces the second transuranium element, plutonium ( Z = 94):
(^{239}_{93}textrm{Np} rightarrow ,^{239}_{94}textrm{Pu}+,^{0}_{-1}betalabel{Eq22})
Bombarding the target with more massive nuclei creates elements that have atomic numbers significantly greater than that of the target nucleus ( Table (PageIndex{2}) ). Such techniques have resulted in the creation of the superheavy elements 114 and 116, both of which lie in or near the “island of stability.”
|
(^{239}_{94}textrm{Pu}+,^{4}_{2}alpha rightarrow ,^{242}_{96}textrm{Cm}+,^{1}_{0}textrm{n})
|
|
(^{239}_{94}textrm{Pu}+,^{4}_{2}alpha rightarrow ,^{241}_{95}textrm{Am}+,^{1}_{1}textrm{p}+,^{1}_{0}textrm{n})
|
|
(^{242}_{96}textrm{Cm}+,^{4}_{2}alpha rightarrow ,^{243}_{97}textrm{Bk}+,^{1}_{1}textrm{p}+2^{1}_{0}textrm{n})
|
|
(^{253}_{99}textrm{Es}+,^{4}_{2}alpha rightarrow ,^{256}_{101}textrm{Md}+,^{1}_{0}textrm{n})
|
|
(^{238}_{92}textrm{U}+,^{12}_{6}textrm{C} rightarrow ,^{246}_{98}textrm{Cf}+4^{1}_{0}textrm{n})
|
|
(^{252}_{98}textrm{Cf}+,^{10}_{5}textrm{B} rightarrow ,^{256}_{103}textrm{Lr}+6^{1}_{0}textrm{n})
|
A device called a particle accelerator is used to accelerate positively charged particles to the speeds needed to overcome the electrostatic repulsions between them and the target nuclei by using electrical and magnetic fields. Operationally, the simplest particle accelerator is the linear accelerator ( Figure (PageIndex{6}) ), in which a beam of particles is injected at one end of a long evacuated tube. Rapid alternation of the polarity of the electrodes along the tube causes the particles to be alternately accelerated toward a region of opposite charge and repelled by a region with the same charge, resulting in a tremendous acceleration as the particle travels down the tube. A modern linear accelerator such as the Stanford Linear Accelerator (SLAC) at Stanford University is about 2 miles long.
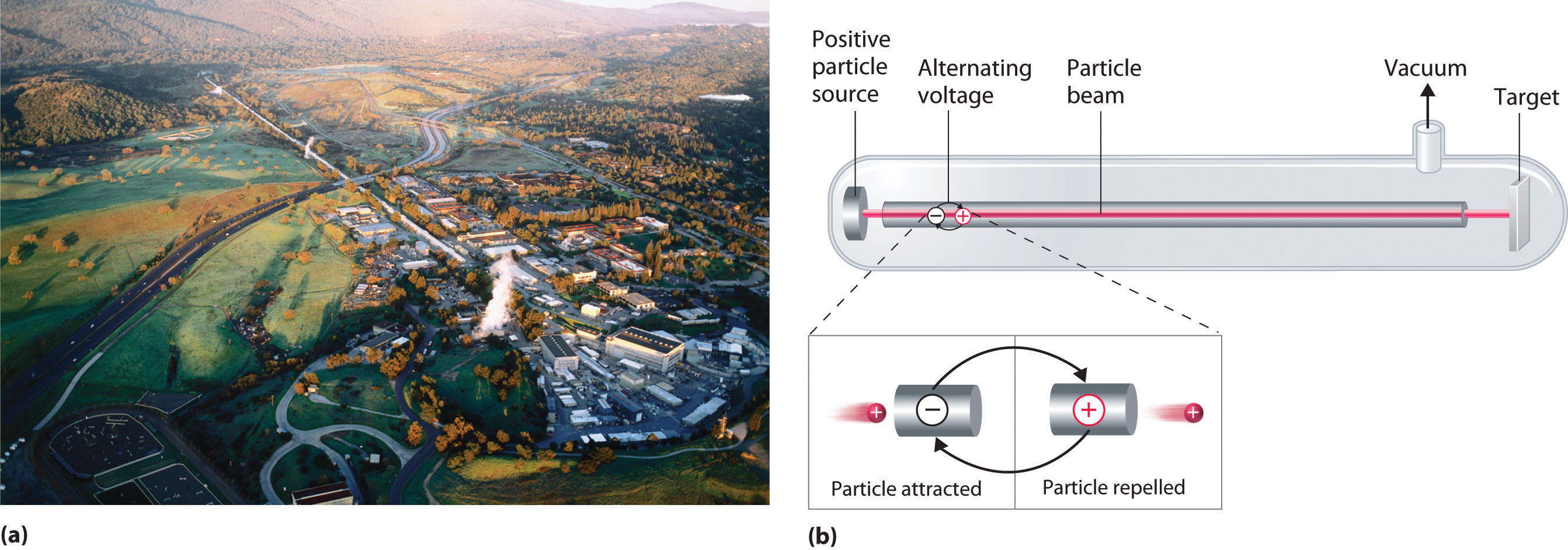
To achieve the same outcome in less space, a particle accelerator called a cyclotron forces the charged particles to travel in a circular path rather than a linear one. The particles are injected into the center of a ring and accelerated by rapidly alternating the polarity of two large D-shaped electrodes above and below the ring, which accelerates the particles outward along a spiral path toward the target.
The length of a linear accelerator and the size of the D-shaped electrodes in a cyclotron severely limit the kinetic energy that particles can attain in these devices. These limitations can be overcome by using a synchrotron, a hybrid of the two designs. A synchrotron contains an evacuated tube similar to that of a linear accelerator, but the tube is circular and can be more than a mile in diameter. Charged particles are accelerated around the circle by a series of magnets whose polarities rapidly alternate.
Summary and Key Takeaway
- Nuclear decay reactions occur spontaneously under all conditions and produce more stable daughter nuclei, whereas nuclear transmutation reactions are induced and form a product nucleus that is more massive than the starting material.
In nuclear decay reactions (or radioactive decay) , the parent nucleus is converted to a more stable daughter nucleus. Nuclei with too many neutrons decay by converting a neutron to a proton, whereas nuclei with too few neutrons decay by converting a proton to a neutron. Very heavy nuclei (with A ≥ 200 and Z > 83) are unstable and tend to decay by emitting an α particle . When an unstable nuclide undergoes radioactive decay, the total number of nucleons is conserved, as is the total positive charge. Six different kinds of nuclear decay reactions are known. Alpha decay results in the emission of an α particle, (^4 _2 alpha), and produces a daughter nucleus with a mass number that is lower by 4 and an atomic number that is lower by 2 than the parent nucleus. Beta decay converts a neutron to a proton and emits a high-energy electron, producing a daughter nucleus with the same mass number as the parent and an atomic number that is higher by 1. Positron emission is the opposite of beta decay and converts a proton to a neutron plus a positron. Positron emission does not change the mass number of the nucleus, but the atomic number of the daughter nucleus is lower by 1 than the parent. In electron capture (EC) , an electron in an inner shell reacts with a proton to produce a neutron, with emission of an x-ray. The mass number does not change, but the atomic number of the daughter is lower by 1 than the parent. In gamma emission , a daughter nucleus in a nuclear excited state undergoes a transition to a lower-energy state by emitting a γ ray. Very heavy nuclei with high neutron-to-proton ratios can undergo spontaneous fission , in which the nucleus breaks into two pieces that can have different atomic numbers and atomic masses with the release of neutrons. Many very heavy nuclei decay via a radioactive decay series —a succession of some combination of alpha- and beta-decay reactions. In nuclear transmutation reactions , a target nucleus is bombarded with energetic subatomic particles to give a product nucleus that is more massive than the original. All transuranium elements —elements with Z > 92—are artificial and must be prepared by nuclear transmutation reactions. These reactions are carried out in particle accelerators such as linear accelerators, cyclotrons, and synchrotrons.
Key Equations
alpha decay
[^A_Z textrm Xrightarrow , ^{A-4}_{Z-2} textrm X’+,^4_2 alpha nonumber ]
beta decay
[^A_Z textrm Xrightarrow , ^{A}_{Z+1} textrm X’+,^0_{-1} beta nonumber ]
positron emission
[^A_Z textrm Xrightarrow , ^{A}_{Z-1} textrm X’+,^0_{+1} beta nonumber ]
electron capture
[^A_Z textrm X+,^{0}_{-1} textrm erightarrow , ^{A}_{Z-1} textrm X’+textrm{x-ray} nonumber ]
gamma emission
[^A_Z textrm{X*}rightarrow , ^{A}_{Z} textrm X+,^0_{0} gamma nonumber ]