Las reacciones nucleares, como las reacciones químicas, se acompañan de cambios en la energía. Sin embargo, los cambios de energía en las reacciones nucleares son enormes en comparación con los de incluso las reacciones químicas más enérgicas. De hecho, los cambios de energía en una reacción nuclear típica son tan grandes que resultan en un cambio de masa medible. En esta sección, describimos la relación entre masa y energía en las reacciones nucleares y mostramos cómo los cambios aparentemente pequeños en la masa que acompañan a las reacciones nucleares resultan en la liberación de enormes cantidades de energía.
Balance de masa y energía
La relación entre masa (m) y energía (E) se expresa en la siguiente ecuación:
[E = mc ^ 2 label {Eq1} ]
donde
- (c ) es la velocidad de la luz ( (2.998 times 10 ^ 8 ; m / s )), y
- (E ) y (m ) se expresan en unidades de julios y kilogramos, respectivamente.
Albert Einstein obtuvo esta relación por primera vez en 1905 como parte de su teoría especial de la relatividad: la masa de una partícula es directamente proporcional a su energía. Por lo tanto, de acuerdo con la [Ecuación ( ref {Eq1} ) , cada masa tiene una energía asociada, y de manera similar, cualquier reacción que implique un cambio en la energía debe ir acompañada de un cambio en la masa. Esto implica que todas las reacciones exotérmicas deben ir acompañadas de una disminución de la masa, y todas las reacciones endotérmicas deben ir acompañadas de un aumento de la masa. Dada la ley de conservación de la masa, ¿cómo puede ser esto cierto? La solución a esta aparente contradicción es que las reacciones químicas de hecho están acompañadas por cambios en la masa, pero estos cambios son simplemente demasiado pequeños para ser detectados. Como recordarán, todas las partículas exhiben un comportamiento en forma de onda, pero la longitud de onda es inversamente proporcional a la masa de la partícula (en realidad, a su momento, el producto de su masa y velocidad). En consecuencia, el comportamiento en forma de onda es detectable solo para partículas con masas muy pequeñas, como los electrones. Por ejemplo, la ecuación química para la combustión de grafito para producir dióxido de carbono es la siguiente:
[ textrm {C (grafito)} + frac {1} {2} textrm O_2 ( textrm g) rightarrow mathrm {CO_2} ( textrm g) hspace {5mm} Delta H ^ circ = -393.5 textrm {kJ / mol} label {Eq2} ]
Las reacciones de combustión se llevan a cabo típicamente a presión constante, y en estas condiciones, el calor liberado o absorbido es igual a ΔH. Cuando se lleva a cabo una reacción a volumen constante, el calor liberado o absorbido es igual a ΔE. Para la mayoría de las reacciones químicas, sin embargo, ΔE ≈ ΔH. Si reescribimos la ecuación de Einstein como
[ Delta {E} = ( Delta m) c ^ 2 label {Eq3} ]
podemos reorganizar la ecuación para obtener la siguiente relación entre el cambio de masa y el cambio de energía:
[ Delta m = dfrac { Delta E} {c ^ 2} label {Eq4} ]
Debido a que 1 J = 1 (kg • m 2 ) / s 2 , el cambio en masa es el siguiente:
[ Delta m = dfrac {-393.5 textrm {kJ / mol}} {(2.998 times10 ^ 8 textrm {m / s}) ^ 2} = dfrac {-3.935 times10 ^ 5 ( mathrm {kg cdot m ^ 2}) / ( mathrm {s ^ 2 cdot mol})} {(2.998 times10 ^ 8 textrm {m / s}) ^ 2} = – 4.38 times10 ^ {-12} textrm {kg / mol} label {Eq5} ]
Este es un cambio de masa de aproximadamente 3.6 × 10 −10 g / g de carbono que se quema, o aproximadamente 100 millonésimas de la masa de un electrón por átomo de carbono. En la práctica, este cambio de masa es demasiado pequeño para ser medido experimentalmente y es insignificante.
En contraste, para una reacción nuclear típica, como la desintegración radiactiva de 14 C a 14 N y un electrón (una partícula β), hay un cambio mucho mayor en masa:
[^ {14} textrm C rightarrow , ^ {14} textrm N + , ^ 0 _ {- 1} beta label {Eq6} ]
Podemos usar las masas de partículas subatómicas e isótopos comunes medidos experimentalmente que se dan en Tabla 20.1 para calcular el cambio en masa directamente. La reacción implica la conversión de un átomo neutro de 14 C a un ion N 14 con carga positiva (con seis, no siete, electrones) y una partícula β con carga negativa (un electrón), entonces la masa de los productos es idéntica a la masa de un átomo neutro de 14 N. El cambio total en la masa durante la reacción es, por lo tanto, la diferencia entre la masa de un átomo neutro 14 N (14.003074 uma) y la masa de un átomo 14 C (14.003242 uma):
[ begin {align} Delta m & = { textrm {mass} _ { textrm {products}} – textrm {mass} _ { textrm {reactants}}}
\ & = 14.003074 textrm {amu} – 14.003242 textrm {amu} = – 0.000168 textrm {amu} end {align} label {Eq7} ]
La diferencia de masa, que se ha liberado como energía, corresponde a casi un tercio de un electrón. El cambio de masa para la desintegración de 1 mol de 14 C es −0,000168 g = −1,68 × 10 −4 g = −1,68 × 10 −7 kg. Aunque un cambio de masa de esta magnitud puede parecer pequeño, es aproximadamente 1000 veces mayor que el cambio de masa para la combustión de grafito. El cambio de energía es el siguiente:
[ begin {align} Delta E & = ( Delta m) c ^ 2 = (- 1.68 times10 ^ {- 7} textrm {kg}) (2.998 times10 ^ 8 textrm {m / s}) ^ 2 \ & = – 1.51 times10 ^ {10} ( mathrm {kg cdot m ^ 2}) / textrm s ^ 2 = -1.51 times10 ^ {10} textrm {J} = -1.51 times10 ^ 7 textrm {kJ} end {align} label {Eq8} ]
La energía liberada en esta reacción nuclear es más de 100,000 veces mayor que la de una reacción química típica, a pesar de que la descomposición de 14 C es una reacción nuclear de energía relativamente baja.
Debido a que los cambios de energía en las reacciones nucleares son tan grandes, a menudo se expresan en kiloelectronvoltios (1 keV = 10 3 eV), megaelectronvoltios (1 MeV = 10 6 eV) e incluso gigaelectronvoltios (1 GeV = 10 9 eV) por átomo o partícula. El cambio en la energía que acompaña a una reacción nuclear puede calcularse a partir del cambio en la masa utilizando la relación 1 amu = 931 MeV. La energía liberada por la desintegración de un átomo de 14 C es así
( mathrm {(- 1.68 times10 ^ {- 4} , amu) left ( dfrac {931 , MeV} {amu} right) = -0.156 , MeV = -156 , keV} label {Eq9} )
Energías de unión nuclear
Hemos visto que los cambios de energía en las reacciones químicas y nucleares van acompañados de cambios en la masa. La ecuación de Einstein, que nos permite interconvertir masa y energía, tiene otra consecuencia interesante: la masa de un átomo es siempre menor que la suma de las masas de sus partículas componentes. La única excepción a esta regla es el hidrógeno-1 ( 1 H), cuya masa medida de 1.007825 amu es idéntica a la suma de las masas de un protón y un electrón. En contraste, la masa medida experimentalmente de un átomo de deuterio ( 2 H) es 2.014102 amu, aunque su masa calculada es 2.016490 amu:
[ begin {align} m _ {^ 2 textrm H} & = m _ { textrm {neutron}} + m _ { textrm {proton}} + m _ { textrm {electron}}
& = 1.008665 textrm {amu} +1.007276 textrm {amu} +0.000549 textrm {amu} = 2.016490 textrm {amu} end {align} label {Eq10} ]
La diferencia entre la suma de las masas de los componentes y la masa atómica medida se denomina defecto de masa del núcleo. Así como una molécula es más estable que sus átomos aislados, un núcleo es más estable (más bajo en energía) que sus componentes aislados. En consecuencia, cuando los nucleones aislados se ensamblan en un núcleo estable, se libera energía. De acuerdo con Ecuación ( ref {Eq4} ) , esta liberación de energía debe ir acompañada de una disminución en la masa del núcleo.
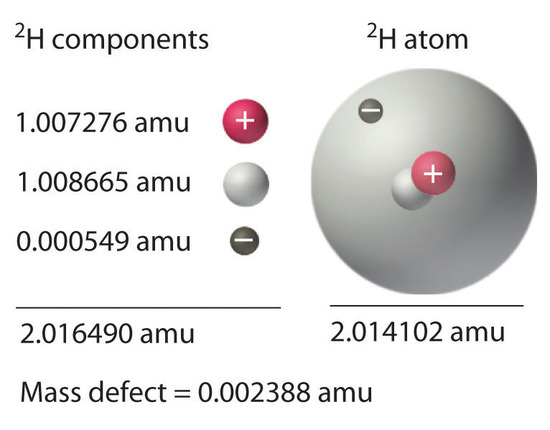
La cantidad de energía liberada cuando se forma un núcleo a partir de sus nucleones componentes es la energía de enlace nuclear ( Figura ( PageIndex {1} ) ). En el caso del deuterio, el defecto de masa es 0.002388 amu, que corresponde a una energía de unión nuclear de 2.22 MeV para el núcleo de deuterio. Debido a que la magnitud del defecto de masa es proporcional a la energía de unión nuclear, ambos valores indican la estabilidad del núcleo.
Así como una molécula es más estable (más baja en energía) que sus átomos aislados, un núcleo es más estable que sus componentes aislados.
No todos los núcleos son igualmente estables. Los químicos describen la estabilidad relativa de diferentes núcleos comparando la energía de unión por nucleón, que se obtiene dividiendo la energía de unión nuclear por el número de masa (A) del núcleo. Como se muestra en Figura ( PageIndex {2} ) , la energía de unión por nucleón aumenta rápidamente al aumentar el número atómico hasta aproximadamente Z = 26, donde se nivela a aproximadamente 8–9 MeV por nucleón y luego disminuye lentamente. El aumento inicial de la energía de unión no es una curva suave, sino que presenta picos agudos correspondientes a los núcleos de luz que tienen el mismo número de protones y neutrones (p. Ej., 4 He, 12 C, y 16 O). Como se mencionó anteriormente, estas son combinaciones particularmente estables.
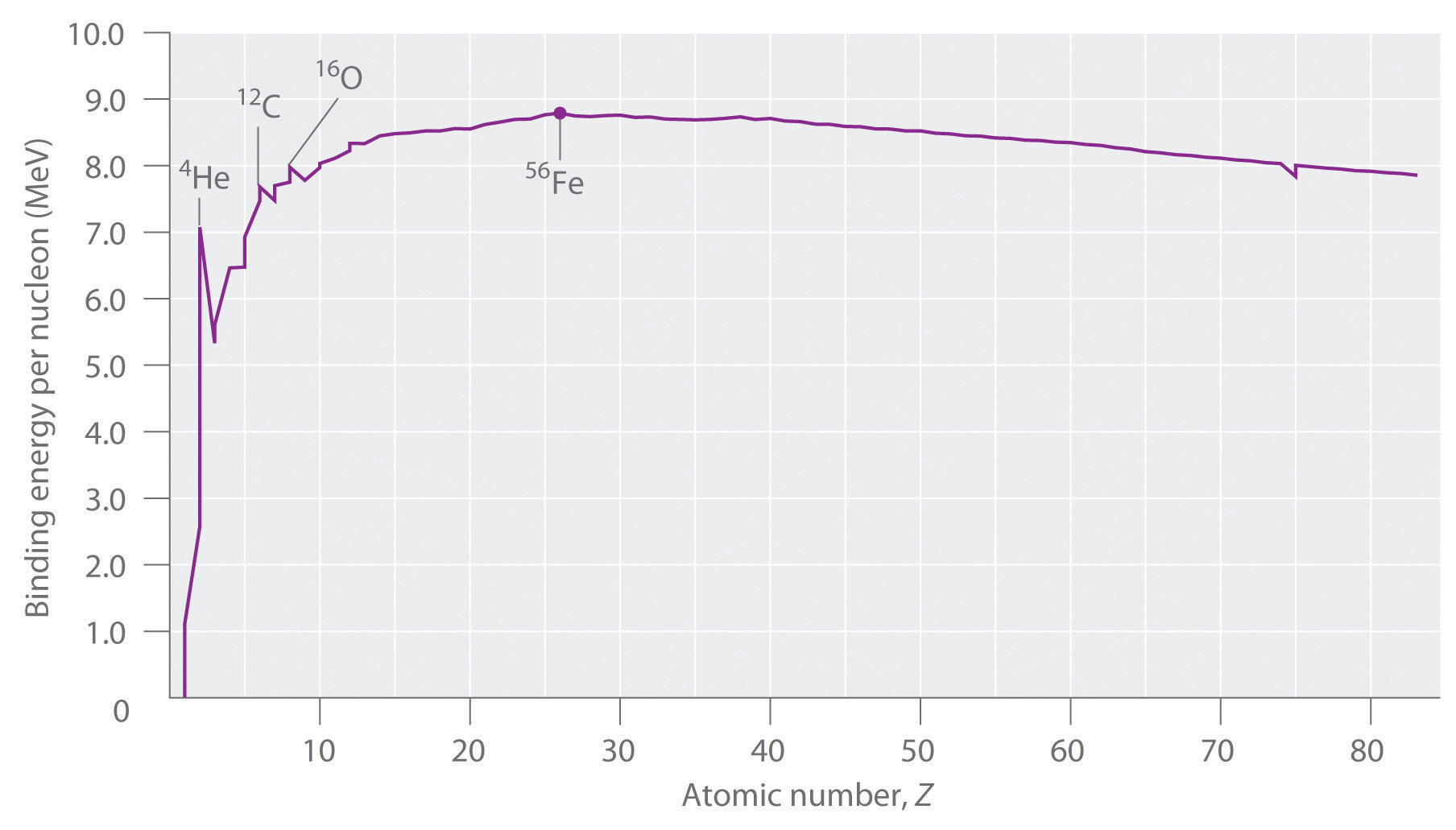
Debido a que la energía de unión máxima por nucleón se alcanza en 56 Fe, todos los demás núcleos son termodinámicamente inestables con respecto a la formación de 56 Fe. En consecuencia, los núcleos más pesados (hacia la derecha en Figura ( PageIndex {2} ) ) deberían sufrir reacciones espontáneas como la desintegración alfa, que resultan en una disminución en el número atómico. Por el contrario, los elementos más ligeros (a la izquierda en Figura ( PageIndex {2} ) ) deben sufrir reacciones espontáneas que resultan en un aumento en el número atómico. Este es de hecho el patrón observado.
Los núcleos más pesados sufren espontáneamente reacciones nucleares que disminuyen su número atómico. Los núcleos más ligeros sufren espontáneamente reacciones nucleares que aumentan su número atómico.