Habilidades para desarrollar
- Comprender las tendencias en propiedades y la reactividad de los elementos del grupo 13.
El Grupo 13 es el primer grupo que abarca la línea divisoria entre metales y no metales, por lo que su química es más diversa que la de los grupos 1 y 2, que incluyen solo elementos metálicos. Excepto por el elemento más ligero (boro), los elementos del grupo 13 son todos relativamente electropositivos; es decir, tienden a perder electrones en reacciones químicas en lugar de ganarlos. Aunque el grupo 13 incluye aluminio, el metal más abundante en la Tierra, ninguno de estos elementos se conocía hasta principios del siglo XIX porque nunca se encuentran en la naturaleza en su estado libre. El boro elemental y el aluminio, que se prepararon primero mediante la reducción de B 2 O 3 y AlCl 3 , respectivamente, con potasio, no pudieron prepararse hasta que el potasio había sido aislado y demostrado ser un potente reductor. El indio (In) y el talio (Tl) se descubrieron en la década de 1860 mediante el uso de técnicas espectroscópicas, mucho antes de que hubiera métodos disponibles para aislarlos. El indio, llamado así por su línea de emisión índigo (azul-violeta profundo), se observó por primera vez en el espectro de minerales de zinc, mientras que el talio (del griego thallos, que significa “un brote verde y joven de una planta”) recibió su nombre por su brillante línea de emisión verde. El galio (Ga; eka-aluminio de Mendeleev) fue descubierto en 1875 por el químico francés Paul Émile Lecoq de Boisbaudran durante una búsqueda sistemática del elemento “perdido” de Mendeleev en el grupo 13.
Los elementos del Grupo 13 nunca se encuentran en la naturaleza en su estado libre.
Preparación y propiedades generales de los elementos del Grupo 13
Como reductores, los elementos del grupo 13 son menos potentes que los metales alcalinos y los metales alcalinotérreos. Sin embargo, sus compuestos con oxígeno son termodinámicamente estables, y se necesitan grandes cantidades de energía para aislar incluso los dos elementos más accesibles, el boro y el aluminio, de sus minerales de óxido.
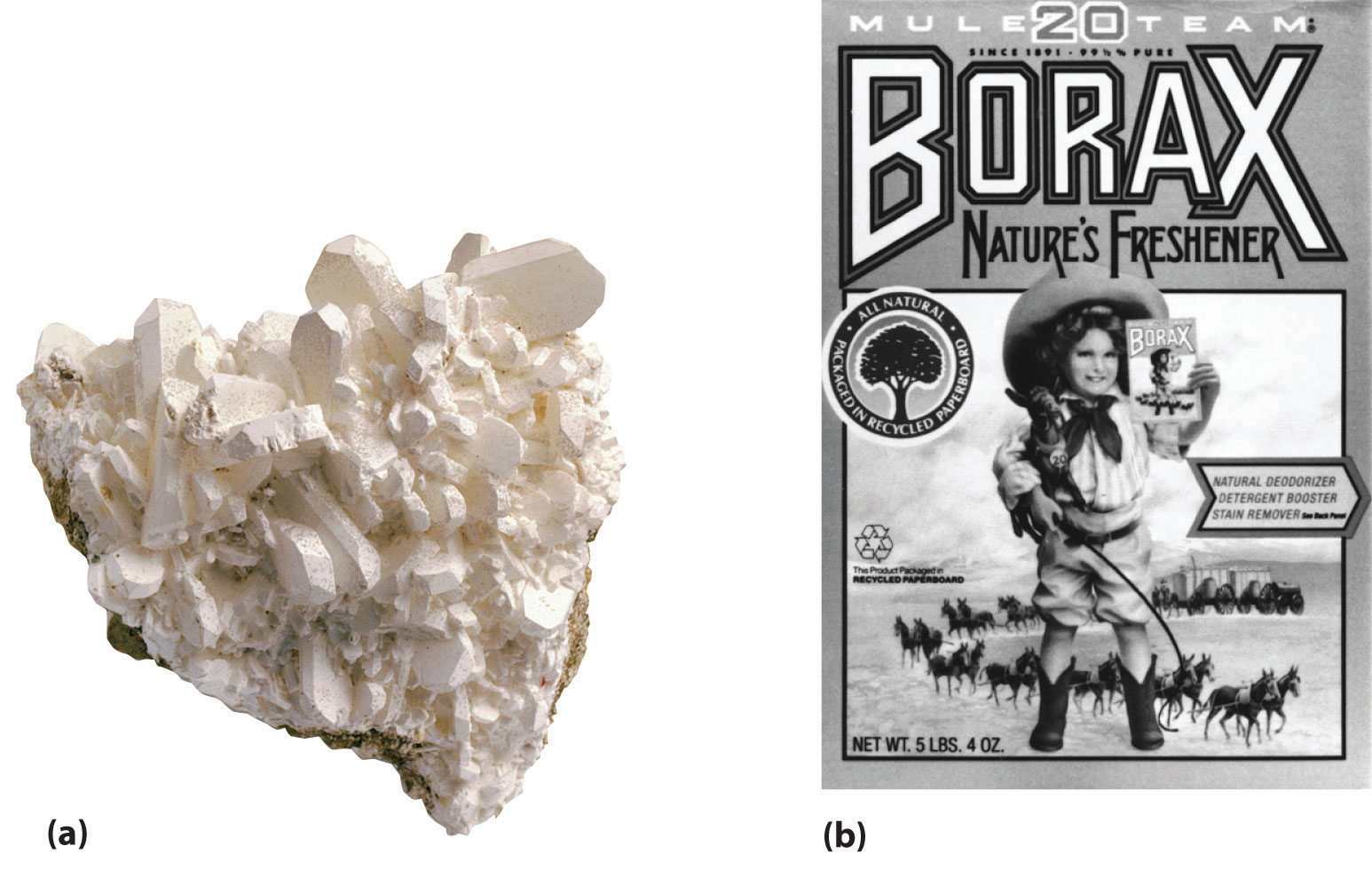
Aunque el boro es relativamente raro (es aproximadamente 10,000 veces menos abundante que el aluminio), los depósitos concentrados de bórax [Na 2 B 4 O 5 ( OH) 4 · 8H 2 O] se encuentran en los lechos de los lagos antiguos (Figura ( PageIndex {1} )) y se usaban en la antigüedad para hacer vidrio y cerámica para esmaltar . El boro se produce a gran escala haciendo reaccionar el bórax con ácido para producir ácido bórico [B (OH) 3 ], que luego se deshidrata al óxido (B 2 O 3 ). La reducción del óxido con magnesio o sodio produce boro amorfo que es solo un 95% puro:
[ mathrm {Na_2B_4O_5 (OH) _4 cdot8H_2O (s)} xrightarrow { textrm {acid}} mathrm {B (OH) _3 (s)} xrightarrow { Delta} mathrm {B_2O_3 (s)} label {Eq1} ]
[ mathrm {B_2O_3 (s)} + mathrm {3Mg (s)} xrightarrow { Delta} mathrm {2B (s)} + mathrm {3MgO (s)} label {Eq2} ]
Sin embargo, el boro cristalino puro es extremadamente difícil de obtener debido a su alto punto de fusión (2300 ° C) y la naturaleza altamente corrosiva del boro líquido. Generalmente se prepara reduciendo BCl puro 3 con gas hidrógeno a altas temperaturas o mediante la descomposición térmica de hidruros de boro como el diborano (B 2 H 6 ) :
[ mathrm {BCl_3 (g)} + frac {3} {2} mathrm {H_2 (g)} rightarrow mathrm {B (s)} + mathrm {3HCl (g)} etiqueta {Eq3} ]
[B_2H_ {6 (g)} rightarrow 2B _ {(s)} + 3H_ {2 (g)} label {Eq4} ]
La reacción que se muestra en la ecuación ( ref {Eq3} ) se usa para preparar fibras de boro, que son rígidas y ligeras. Por lo tanto, se usan como materiales de refuerzo estructural en objetos tan diversos como el transbordador espacial de los EE. UU. Y los cuadros de bicicletas livianas que se usan en carreras como el Tour de Francia. El boro también es un componente importante de muchas cerámicas y vidrios de borosilicato resistentes al calor, como Pyrex, que se usa para utensilios de cocina y cristalería de laboratorio.
A diferencia del boro, los depósitos de minerales de aluminio como la bauxita, una forma hidratada de Al 2 O 3 , son abundantes. Con una conductividad eléctrica aproximadamente el doble que la del cobre peso por peso, el aluminio se utiliza en más del 90% de las líneas eléctricas aéreas de los Estados Unidos. Sin embargo, debido a que los compuestos de aluminio y oxígeno son estables, obtener aluminio metal a partir de bauxita es un proceso costoso. El aluminio se extrae de los minerales de óxido mediante tratamiento con una base fuerte, que produce el complejo de hidróxido soluble [Al (OH) 4 ] – . La neutralización de la solución resultante con CO gaseoso 2 da como resultado la precipitación de Al (OH) 3 :
[2 [Al (OH) _4] ^ −_ {(aq)} + CO_ {2 (g)} rightarrow 2Al (OH) _ {3 (s)} + CO ^ {2 -} _ {3 (aq)} + H_2O _ {(l)} label {Eq5} ]
La deshidratación térmica de Al (OH) 3 produce Al 2 O 3 , y el aluminio metálico se obtiene mediante la reducción electrolítica de Al 2 O 3 utilizando el proceso Hall – Heroult . De los elementos del grupo 13, solo el aluminio se usa a gran escala: por ejemplo, cada avión Boeing 777 es aproximadamente 50% de aluminio en masa.
Figura ( PageIndex {2} ): Fuente: Thomas D. Kelly y Grecia R. Matos, “Estadísticas históricas de productos minerales y materiales en los Estados Unidos”, US Geological Survey Data Series 140, 2010, consultado el 20 de julio de 2011, http://pubs.usgs.gov/ds/2005/140/ .
Los otros miembros del grupo 13 son bastante raros: el galio es aproximadamente 5000 veces menos abundante que el aluminio, y el indio y el talio son aún más escasos. En consecuencia, estos metales generalmente se obtienen como subproductos en el procesamiento de otros metales. Sin embargo, el punto de fusión extremadamente bajo del galio (29,6 ° C) facilita la separación del aluminio. Debido a su bajo punto de fusión y alto punto de ebullición, el galio se usa como líquido en termómetros que tienen un rango de temperatura de casi 2200 ° C. El indio y el talio, los elementos más pesados del grupo 13, se encuentran como trazas de impurezas en los minerales de sulfuro de zinc y plomo. El indio se usa como un sello triturable para dispositivos criogénicos de alto vacío, y sus aleaciones se usan como soldaduras de baja fusión en placas de circuitos electrónicos. El talio, por otro lado, es tan tóxico que el metal y sus compuestos tienen pocos usos. Los óxidos de indio y talio se liberan en el polvo de los humos cuando los minerales de sulfuro se convierten en óxidos metálicos y SO 2 . Hasta hace relativamente poco tiempo, estos y otros elementos tóxicos podían dispersarse en el aire, creando grandes “zonas muertas” a favor del viento de una fundición. Los polvos de combustión ahora están atrapados y sirven como una fuente relativamente rica de elementos como In y Tl (así como Ge, Cd, Te y As).
La tabla ( PageIndex {1} ) resume algunas propiedades importantes de los elementos del grupo 13. Observe las grandes diferencias entre el tamaño del boro y el aluminio, la energía de ionización, la electronegatividad y el potencial de reducción estándar, lo que es consistente con la observación de que el boro se comporta químicamente como un metal y el aluminio como un metal. Todos los elementos del grupo 13 tienen ns 2 np 1 configuraciones de electrones de valencia, y todos tienden a perder sus tres electrones de valencia para formar compuestos en el estado de oxidación +3. Los elementos más pesados del grupo también pueden formar compuestos en el estado de oxidación +1 formado por la pérdida formal del electrón de valencia np único. Debido a que los elementos del grupo 13 generalmente contienen solo seis electrones de valencia en sus compuestos neutros, todos estos compuestos son ácidos de Lewis moderadamente fuertes.
| Propiedad | Boro | Aluminio * | Galio | Indio | Talio |
|---|---|---|---|---|---|
| * Este es el nombre utilizado en los Estados Unidos; el resto del mundo inserta un i adicional y lo llama aluminio. | |||||
| † La configuración que se muestra no incluye subcapas d y f llenas. | |||||
| ‡ Los valores citados son para iones de seis coordenadas en el estado de oxidación más común, excepto Al 3 + , para los cuales el valor para el Se da iones de cuatro coordenadas. El ion B 3 + no es una especie conocida; El radio citado es un valor estimado de cuatro coordenadas. | |||||
| § X es Cl, Br o I. La reacción con F 2 da los trifluoruros (MF 3 ) para todos los elementos del grupo 13. | |||||
| símbolo atómico | B | Al | Ga | En | Tl |
| número atómico | 5 | 13 | 31 | 49 | 81 |
| masa atómica (amu) | 10,81 | 26,98 | 69,72 | 114,82 | 204,38 |
| configuración de electrones de valencia † | 2s 2 2p 1 | 3s 2 3p 1 | 4s 2 4p 1 | 5s 2 5p 1 | 6s 2 6p 1 |
| punto de fusión / punto de ebullición (° C) | 2075/4000 | 660/2519 | 29,7 / 2204 | 156,6 / 2072 | 304/1473 |
| densidad (g / cm 3 ) a 25 ° C | 2,34 | 2,70 | 5,91 | 7,31 | 11,8 |
| radio atómico (pm) | 87 | 118 | 136 | 156 | 156 |
| primera energía de ionización (kJ / mol) | 801 | 578 | 579 | 558 | 589 |
| estado de oxidación más común | +3 | +3 | +3 | +3 | +1 |
| radio iónico (pm) ‡ | −25 | 54 | 62 | 80 | 162 |
| afinidad electrónica (kJ / mol) | −27 | −42 | −40 | −39 | −37 |
| electronegatividad | 2,0 | 1,6 | 1,8 | 1,8 | 1,8 |
| potencial de reducción estándar (E °, V) | −0,87 | −1,66 | −0,55 | −0,34 | +0,741 de M 3 + (aq) |
| producto de reacción con O 2 | B 2 O 3 | Al 2 O 3 | Ga 2 O 3 | En 2 O 3 | Tl 2 O |
| tipo de óxido | ácido | anfótero | anfótero | anfótero | básico |
| producto de reacción con N 2 | BN | AlN | GaN | InN | ninguno |
| producto de reacción con X 2 § | BX 3 | Al 2 X 6 | Ga 2 X 6 | En 2 X 6 | TlX |
Los compuestos neutros de los elementos del grupo 13 son deficientes en electrones, por lo que generalmente son ácidos de Lewis moderadamente fuertes.
En contraste con los grupos 1 y 2, los elementos del grupo 13 no muestran tendencias consistentes en las energías de ionización, afinidades electrónicas y potenciales de reducción, mientras que las electronegatividades en realidad aumentan de aluminio a talio. Algunas de estas anomalías, especialmente para la serie Ga, In, Tl, pueden explicarse por el aumento de la carga nuclear efectiva (Z eff ) que resulta de un blindaje deficiente de la carga nuclear por parte del relleno (n – 1) d 10 y (n – 2) f 14 subcapas. En consecuencia, aunque la carga nuclear real aumenta en 32 a medida que pasamos del indio al talio, el cribado de las subcapas 5d y 4f llenas es tan pobre que Z eff aumenta significativamente de indio a talio. Así, la primera energía de ionización del talio es en realidad mayor que la del indio.
Las anomalías en las tendencias periódicas entre Ga, In y T1 pueden explicarse por el aumento de la carga nuclear efectiva debido a un blindaje deficiente.
Reacciones y compuestos de boro
El boro elemental es un semimetal que es notablemente no reactivo; en contraste, los otros elementos del grupo 13 exhiben propiedades metálicas y reactividad. Por lo tanto, consideramos las reacciones y compuestos de boro por separado de los de otros elementos en el grupo. Todos los elementos del grupo 13 tienen menos electrones de valencia que los orbitales de valencia, lo que generalmente produce enlaces metálicos deslocalizados. Sin embargo, con su alta energía de ionización, baja afinidad electrónica, baja electronegatividad y pequeño tamaño, el boro no forma una red metálica con electrones de valencia deslocalizados. En cambio, el boro forma estructuras únicas e intrincadas que contienen enlaces multicéntricos, en los que un par de electrones mantiene unidos tres o más átomos.
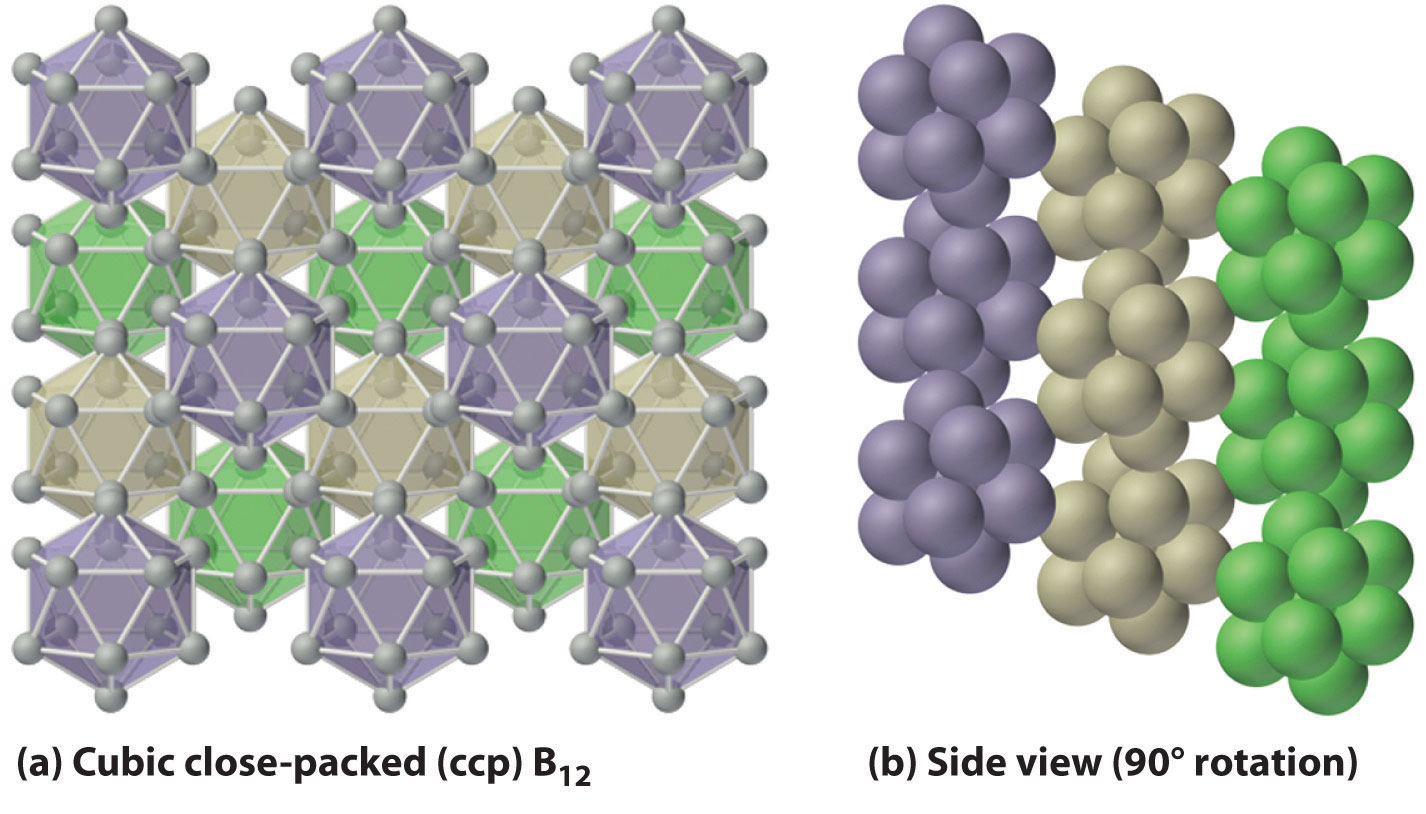
El boro elemental forma enlaces multicéntricos, mientras que los otros elementos del grupo 13 exhiben enlaces metálicos.
El componente básico del boro elemental no es el átomo de boro individual, como sería el caso en un metal, sino más bien el icosaedro B 12 . Debido a que estos icosaedros no se empaquetan muy bien, la estructura del boro sólido contiene huecos, lo que resulta en su baja densidad (Figura ( PageIndex {3} )). El boro elemental puede ser inducido a reaccionar con muchos elementos no metálicos para dar compuestos binarios que tienen una variedad de aplicaciones. Por ejemplo, las placas de carburo de boro (B 4 C) pueden detener una bala perforadora de blindaje de calibre 30, pero pesan entre 10% y 30% menos que la armadura convencional. Otros compuestos importantes de boro con no metales incluyen nitruro de boro (BN), que se produce al calentar boro con exceso de nitrógeno (Ecuación ( ref {Eq22.6} )); óxido de boro (B 2 O 3 ), que se forma cuando el boro se calienta con un exceso de oxígeno (Ecuación ( ref {Eq22.7} )); y los trihaluros de boro (BX 3 ), que se forman calentando boro con exceso de halógeno (Ecuación ( ref {Eq22.8} )).
[ mathrm {2B (s)} + mathrm {N_2 (g)} xrightarrow { Delta} mathrm {2BN (s)} label {Eq22.6} ]
[ mathrm {4B (s)} + mathrm {3O_2 (g)} xrightarrow { Delta} mathrm {2B_2O_3 (s)} label {Eq22.7} ]
[ mathrm {2B (s)} + mathrm {3X_2 (g)} xrightarrow { Delta} mathrm {2BX_3 (g)} label {Eq22.8} ]
Como es típico de los elementos que se encuentran cerca de la línea divisoria entre metales y no metales, muchos compuestos de boro son anfóteros y se disuelven en ácido o base.
El nitruro de boro es similar en muchos aspectos al carbono elemental. Con ocho electrones, la unidad B – N es isoelectrónica con la unidad C – C, y B y N tienen el mismo tamaño promedio y electronegatividad que C. La forma más estable de BN es similar al grafito, que contiene B de seis miembros [19459010 ] 3 N 3 anillos dispuestos en capas. A alta temperatura y presión, el BN hexagonal se convierte en una estructura cúbica similar al diamante, que es una de las sustancias más duras conocidas. El óxido de boro (B 2 O 3 ) contiene capas de grupos trigonales planos BO 3 (análogos a BX 3 ) en los que el oxígeno Los átomos unen dos átomos de boro. Disuelve muchos óxidos metálicos y no metálicos, incluido SiO 2 , para dar una amplia gama de vidrios de borosilicato comercialmente importantes. Una pequeña cantidad de CoO da el color azul profundo característico del vidrio “azul cobalto”.

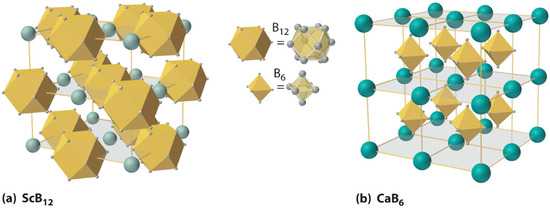
A altas temperaturas, el boro también reacciona con prácticamente todos los metales para dar boruros metálicos que contienen redes tridimensionales regulares o grupos de átomos de boro. Las estructuras de dos boruros metálicos — ScB 12 y CaB 6 – se muestran en la Figura ( PageIndex {4} ). Debido a que los boruros ricos en metales como ZrB 2 y TiB 2 son duros y resistentes a la corrosión incluso a altas temperaturas, se usan en aplicaciones como palas de turbina y boquillas de cohetes.
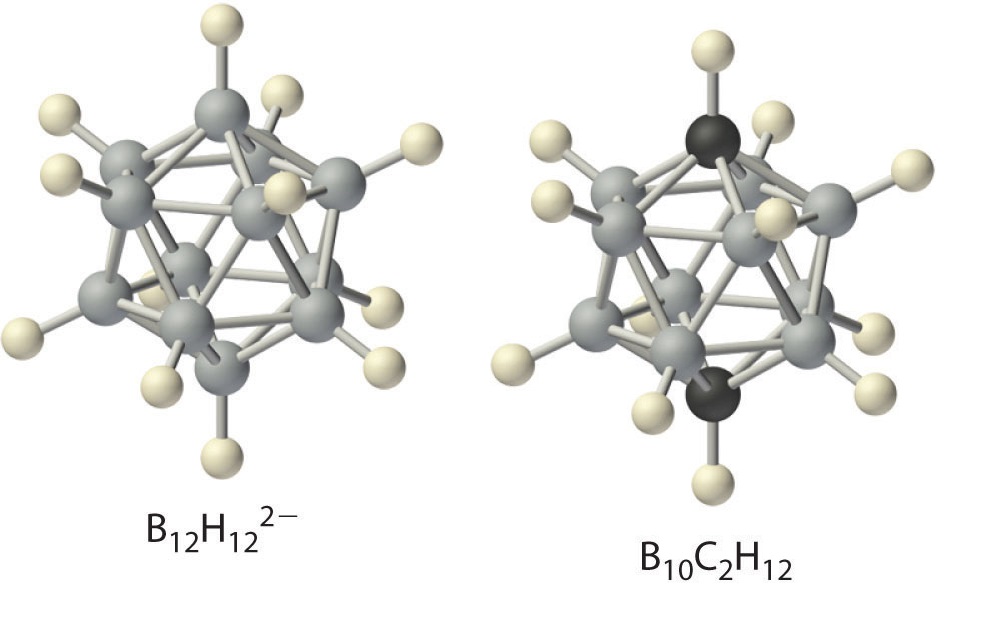
Los hidruros de boro no se descubrieron hasta principios del siglo XX, cuando el químico alemán Alfred Stock realizó una investigación sistemática de los compuestos binarios de boro e hidrógeno, aunque los hidruros binarios de carbono, nitrógeno, oxígeno y flúor se conocen desde siglo 18. Entre 1912 y 1936, Stock supervisó la preparación de una serie de compuestos de boro-hidrógeno con estructuras sin precedentes que no podían explicarse con simples teorías de enlace. Todos estos compuestos contienen enlaces multicéntricos. El ejemplo más simple es el diborano (B 2 H 6 ), que contiene dos átomos de hidrógeno puente (parte (a) en la Figura ( PageIndex {5} ). Una variedad extraordinaria de grupos poliédricos de boro-hidrógeno ahora se conoce; un ejemplo es el ion B 12 H 12 2− , que tiene una estructura poliédrica similar a la icosaédrica B 12 unidad de boro elemental, con un solo átomo de hidrógeno unido a cada átomo de boro.
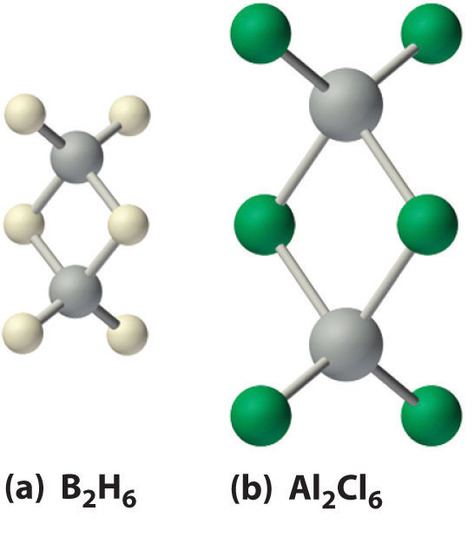
Una clase relacionada de grupos poliédricos, los carboranos, contienen unidades CH y BH; Aquí se muestra un ejemplo. Reemplazar los átomos de hidrógeno unidos al carbono con grupos orgánicos produce sustancias con propiedades novedosas, algunas de las cuales se están investigando actualmente para su uso como cristales líquidos y en la quimioterapia contra el cáncer.
La entalpía de combustión de diborano (B 2 H 6 ) es −2165 kJ / mol, uno de los valores más altos conocidos:
[B_2H_ {6 (g)} + 3O_ {2 (g)} rightarrow B_2O_ {3 (s)} + 3H_2O (l) ; ; ; ΔH_ {comb} = −2165 ; kJ / mol label {Eq 22.9} ]
En consecuencia, el ejército de los Estados Unidos exploró el uso de hidruros de boro como combustible para cohetes en las décadas de 1950 y 1960. Este esfuerzo fue finalmente abandonado porque los hidruros de boro son inestables, costosos y tóxicos y, lo más importante, B 2 O 3 demostró ser altamente abrasivo para las boquillas de cohetes. Sin embargo, las reacciones llevadas a cabo durante esta investigación mostraron que los hidruros de boro exhiben una reactividad inusual.
Debido a que el boro y el hidrógeno tienen electronegatividades casi idénticas, las reacciones de los hidruros de boro están dictadas por diferencias menores en la distribución de la densidad de electrones en un compuesto dado. En general, se observan dos tipos distintos de reacción: especies ricas en electrones como el ion BH 4 – son reductores, mientras que las especies deficientes en electrones como B 2 [ 19459011] H 6 actúan como oxidantes.
Ejemplo ( PageIndex {1} )
Para cada reacción, explica por qué se forman los productos dados.
- B 2 H 6 (g) + 3O 2 (g) → B 2 O 3 [19459011 ] (s) + 3H 2 O (l)
- BCl 3 (l) + 3H 2 O (l) → B (OH) 3 (aq) + 3HCl (aq)
- ( mathrm {2BI_3 (s)} + mathrm {3H_2 (g)} xrightarrow { Delta} frac {1} {6} mathrm {B_ {12} (s)} + mathrm {6HI (g)} )
Dado: ecuaciones químicas equilibradas
Preguntado: por qué se forman los productos dados
Estrategia:
Clasifica el tipo de reacción. Utilizando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explique por qué se forman los productos de reacción.
Solución:
- El oxígeno molecular es un oxidante. Si el otro reactivo es un potencial reductor, esperamos que ocurra una reacción redox. Aunque B 2 H 6 contiene boro en su estado de oxidación más alto (+3), también contiene hidrógeno en el estado de oxidación -1 (el ion hidruro). Debido a que el hidruro es un reductor fuerte, probablemente ocurrirá una reacción redox. Esperamos que H – se oxidará a H + y O 2 se reducirá a O 2− , pero cuáles son los productos reales? Una suposición razonable es B 2 O 3 y H 2 O, ambos compuestos estables.
- Ni BCl 3 ni el agua es un oxidante o reductor potente, por lo que es improbable una reacción redox; Una reacción de hidrólisis es más probable. Los haluros no metálicos son ácidos y reaccionan con el agua para formar una solución del ácido hidrohálico y un óxido o hidróxido no metálico. En este caso, el producto que contiene boro más probable es el ácido bórico [B (OH) 3 ].
- Normalmente esperamos que un trihaluro de boro se comporte como un ácido de Lewis. En este caso, sin embargo, el otro reactivo es el hidrógeno elemental, que generalmente actúa como reductor. Los átomos de yodo en BI 3 están en el estado de oxidación más bajo accesible (−1), y el boro está en el estado de oxidación +3. En consecuencia, podemos escribir una reacción redox en la que el hidrógeno se oxida y el boro se reduce. Debido a que los compuestos de boro en estados de oxidación más bajos son raros, esperamos que el boro se reduzca a boro elemental. Por lo tanto, el otro producto de la reacción debe ser HI.
Ejercicio ( PageIndex {1} )
Predice los productos de las reacciones y escribe una ecuación química equilibrada para cada reacción.
- ( mathrm {B_2H_6 (g)} + mathrm {H_2O (l)} xrightarrow { Delta} )
- ( mathrm {BBr_3 (l)} + mathrm {O_2 (g)} rightarrow )
- ( mathrm {B_2O_3 (s)} + mathrm {Ca (s)} xrightarrow { Delta} )
Respuesta:
- ( mathrm {B_2H_6 (g)} + mathrm {H_2O (l)} xrightarrow { Delta} mathrm {2B (OH) _3 (s)} + mathrm {6H_2 (g)} )
- ( mathrm {BBr_3 (l)} + mathrm {O_2 (g)} rightarrow textrm {sin reacción} )
- ( mathrm {6B_2O_3 (s)} + 18 mathrm {Ca (s)} xrightarrow { Delta} mathrm {B_ {12} (s)} + mathrm {18CaO (s)} )
Reacciones y compuestos de los elementos del Grupo 13 más pesados
Los cuatro elementos del grupo 13 más pesados (Al, Ga, In y Tl) reaccionan fácilmente con los halógenos para formar compuestos con una estequiometría 1: 3:
[2M _ {(s)} + 3X_ {2 (s, l, g)} rightarrow 2MX_ {3 (s)} text {or} M_2X_6 label {Eq10} ]
La reacción de Tl con yodo es una excepción: aunque el producto tiene la estequiometría TlI 3 , no es yoduro de talio (III), sino un compuesto de talio (I), el Tl [19459029 ] + sal del ion triyoduro (I 3 – ). Este compuesto se forma porque el yodo no es un oxidante lo suficientemente potente como para oxidar el talio al estado de oxidación +3.
De los haluros, solo los fluoruros exhiben un comportamiento típico de un compuesto iónico: tienen altos puntos de fusión (> 950 ° C) y baja solubilidad en solventes no polares. En contraste, los tricloruros, tribromuros y triyoduros de aluminio, galio e indio, así como TlCl 3 y TlBr 3 , son de carácter más covalente y forman dímeros con puentes de halógeno. (parte (b) en la Figura ( PageIndex {4} )). Aunque la estructura de estos dímeros es similar a la del diborano (B 2 H 6 ), la unión puede describirse en términos de enlaces de pares de electrones en lugar de los deocalizados deficientes en electrones unión encontrada en el diborano. Los haluros puente son donantes pobres de pares de electrones, por lo que los trihaluros del grupo 13 son potentes ácidos de Lewis que reaccionan fácilmente con bases de Lewis, como las aminas, para formar un aducto ácido-base de Lewis:
[Al_2Cl_ {6 (soln)} + 2 (CH_3) _3N _ {(soln)} rightarrow 2 (CH_3) _3N: AlCl_ {3 (soln)} label {Eq11} ]
En agua, los haluros de los metales del grupo 13 se hidrolizan para producir el hidróxido metálico ( [M (OH) _3 )):
[MX_ {3 (s)} + 3H_2O _ {(l)} rightarrow M (OH) _ {3 (s)} + 3HX _ {(aq)} label {Eq12} ]
En una reacción relacionada, Al 2 (SO 4 ) 3 se usa para aclarar el agua potable mediante la precipitación de Al (OH) hidratado [19459010 ] 3 , que atrapa partículas. Los haluros de los metales más pesados (In y Tl) son menos reactivos con el agua debido a su menor relación carga / radio. En lugar de formar hidróxidos, se disuelven para formar los iones complejos de metales hidratados: [M (H 2 O) 6 ] 3+ .
Del grupo 13 haluros, solo los fluoruros se comportan como compuestos iónicos típicos.
Al igual que el boro (Ecuación ( ref {Eq22.7} )), todos los elementos del grupo 13 más pesados reaccionan con exceso de oxígeno a temperaturas elevadas para dar el óxido trivalente (M 2 O [19459010 ] 3 ), aunque Tl 2 O 3 es inestable:
[ mathrm {4M (s)} + mathrm {3O_2 (g)} xrightarrow { Delta} mathrm {2M_2O_3 (s)} label {Eq13} ]
El óxido de aluminio (Al 2 O 3 ), también conocido como alúmina, es un aislante duro, de alto punto de fusión, químicamente inerte, utilizado como cerámica y como abrasivo en papel de lija y pasta de dientes. Reemplazando un pequeño número de iones Al 3 + en alúmina cristalina con iones Cr 3 + forma el rubí de la gema, mientras que reemplazando Al [ 19459029] 3 + with a mixture of Fe 2 + , Fe 3 + , and Ti 4 + produces blue sapphires. The gallium oxide compound MgGa 2 O 4 gives the brilliant green light familiar to anyone who has ever operated a xerographic copy machine. All the oxides dissolve in dilute acid, but Al 2 O 3 and Ga 2 O 3 are amphoteric, which is consistent with their location along the diagonal line of the periodic table, also dissolving in concentrated aqueous base to form solutions that contain M(OH) 4 − ions.
Group 13 trihalides are potent Lewis acids that react with Lewis bases to form a Lewis acid–base adduct.
Aluminum, gallium, and indium also react with the other group 16 elements (chalcogens) to form chalcogenides with the stoichiometry M 2 Y 3 . However, because Tl(III) is too strong an oxidant to form a stable compound with electron-rich anions such as S 2− , Se 2− , and Te 2− , thallium forms only the thallium(I) chalcogenides with the stoichiometry Tl 2 Y. Only aluminum, like boron, reacts directly with N 2 (at very high temperatures) to give AlN, which is used in transistors and microwave devices as a nontoxic heat sink because of its thermal stability; GaN and InN can be prepared using other methods. All the metals, again except Tl, also react with the heavier group 15 elements (pnicogens) to form the so-called III–V compounds, such as GaAs. These are semiconductors, whose electronic properties, such as their band gaps, differ from those that can be achieved using either pure or doped group 14 elements. For example, nitrogen- and phosphorus-doped gallium arsenide (GaAs 1−x−y P x N y ) is used in the displays of calculators and digital watches.
All group 13 oxides dissolve in dilute acid, but Al 2 O 3 and Ga 2 O 3 are amphoteric.
Unlike boron, the heavier group 13 elements do not react directly with hydrogen. Only the aluminum and gallium hydrides are known, but they must be prepared indirectly; AlH 3 is an insoluble, polymeric solid that is rapidly decomposed by water, whereas GaH 3 is unstable at room temperature.
Complexes of Group 13 Elements
Boron has a relatively limited tendency to form complexes, but aluminum, gallium, indium, and, to some extent, thallium form many complexes. Some of the simplest are the hydrated metal ions [M(H 2 O) 6 3+ ], which are relatively strong Brønsted–Lowry acids that can lose a proton to form the M(H 2 O) 5 (OH) 2+ ion:
[[M(H_2O)_6]^{3+}_{(aq)} rightarrow M(H_2O)_5(OH)^{2+}_{(aq)} + H^+_{(aq)} label{Eq14}]
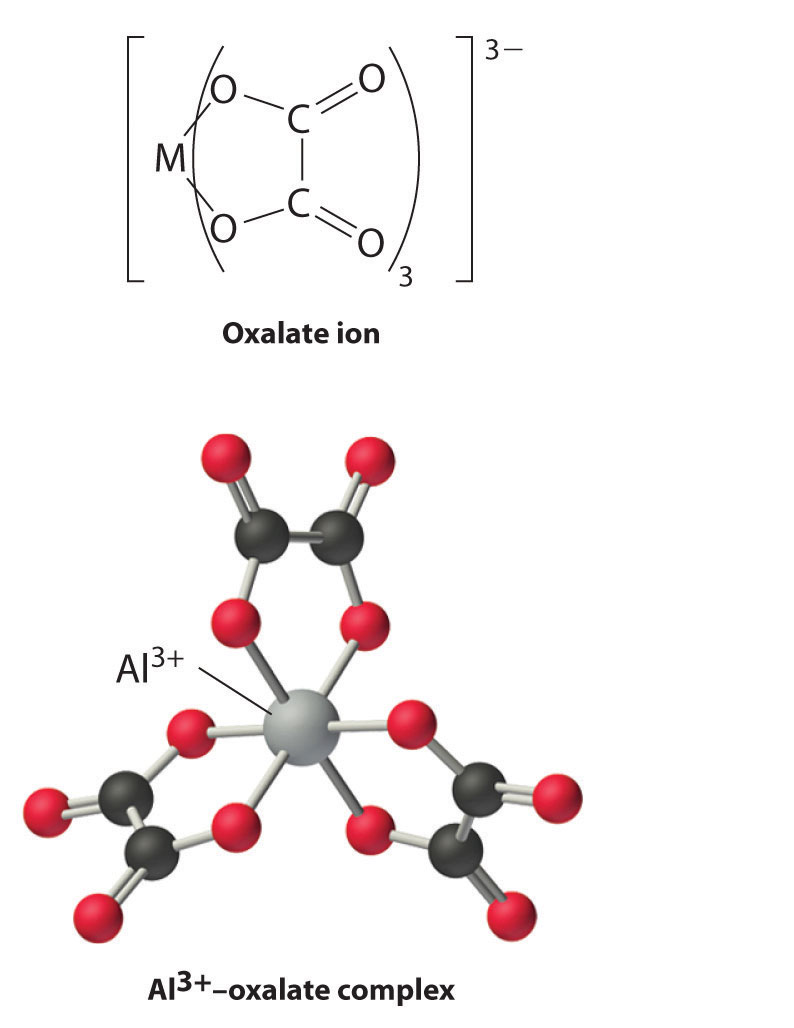
Group 13 metal ions also form stable complexes with species that contain two or more negatively charged groups, such as the oxalate ion. The stability of such complexes increases as the number of coordinating groups provided by the ligand increases.
Ejemplo ( PageIndex {2} )
Para cada reacción, explica por qué se forman los productos dados.
- (mathrm{2Al(s)} + mathrm{Fe_2O_3(s)}xrightarrow{Delta}mathrm{2Fe(l)} + mathrm{Al_2O_3(s)})
- (mathrm{2Ga(s)} + mathrm{6H_2O(l)}+ mathrm{2OH^-(aq)}xrightarrow{Delta}mathrm{3H_2(g)} + mathrm{2Ga(OH)^-_4(aq)})
- (mathrm{In_2Cl_6(s)}xrightarrow{mathrm{H_2O(l)}}mathrm{2In^{3+}(aq)}+mathrm{6Cl^-(aq)})
Given: balanced chemical equations
Asked for: why the given products form
Strategy:
Clasifica el tipo de reacción. Utilizando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explique por qué se forman los productos de reacción.
Solution:
- Aluminum is an active metal and a powerful reductant, and Fe 2 O 3 contains Fe(III), a potential oxidant. Hence a redox reaction is probable, producing metallic Fe and Al 2 O 3 . Because Al is a main group element that lies above Fe, which is a transition element, it should be a more active metal than Fe. Thus the reaction should proceed to the right. In fact, this is the thermite reaction, which is so vigorous that it produces molten Fe and can be used for welding.
- Gallium lies immediately below aluminum in the periodic table and is amphoteric, so it will dissolve in either acid or base to produce hydrogen gas. Because gallium is similar to aluminum in many of its properties, we predict that gallium will dissolve in the strong base.
- The metallic character of the group 13 elements increases with increasing atomic number. Indium trichloride should therefore behave like a typical metal halide, dissolving in water to form the hydrated cation.
Ejercicio ( PageIndex {2} )
Predice los productos de las reacciones y escribe una ecuación química equilibrada para cada reacción.
- LiH(s) + Al 2 Cl 6 (soln)→
- Al 2 O 3 (s) + OH − (aq)→
- Al(s) + N 2 (g) (xrightarrow{Delta})
- Ga 2 Cl 6 (soln) + Cl − (soln)→
Answer:
- 8LiH(s) + Al 2 Cl 6 (soln)→2LiAlH 4 (soln) + 6LiCl(s)
- Al 2 O 3 (s) + 2OH − (aq) + 3H 2 O(l) → 2Al(OH) 4 − (aq)
- 2Al(s) + N 2 (g) (xrightarrow{Delta}) 2AlN(s)
- Ga 2 Cl 6 (soln) + 2Cl − (soln) → 2GaCl 4 − (soln)
Summary
Compounds of the group 13 elements with oxygen are thermodynamically stable. Many of the anomalous properties of the group 13 elements can be explained by the increase in Z eff moving down the group. Isolation of the group 13 elements requires a large amount of energy because compounds of the group 13 elements with oxygen are thermodynamically stable. Boron behaves chemically like a nonmetal, whereas its heavier congeners exhibit metallic behavior. Many of the inconsistencies observed in the properties of the group 13 elements can be explained by the increase in Z eff that arises from poor shielding of the nuclear charge by the filled (n − 1)d 10 and (n − 2)f 14 subshells. Instead of forming a metallic lattice with delocalized valence electrons, boron forms unique aggregates that contain multicenter bonds, including metal borides, in which boron is bonded to other boron atoms to form three-dimensional networks or clusters with regular geometric structures. All neutral compounds of the group 13 elements are electron deficient and behave like Lewis acids. The trivalent halides of the heavier elements form halogen-bridged dimers that contain electron-pair bonds, rather than the delocalized electron-deficient bonds characteristic of diborane. Their oxides dissolve in dilute acid, although the oxides of aluminum and gallium are amphoteric. None of the group 13 elements reacts directly with hydrogen, and the stability of the hydrides prepared by other routes decreases as we go down the group. In contrast to boron, the heavier group 13 elements form a large number of complexes in the +3 oxidation state.