Habilidades para desarrollar
- Para comprender las tendencias en propiedades y reactividad de los elementos del grupo 16: los calcógenos.
Los calcógenos son el primer grupo en el bloque p que no tiene elementos metálicos estables. Todos los isótopos de polonio (Po), el único metal del grupo 16, son radiactivos, y solo un elemento del grupo, el telurio (Te), puede incluso describirse como semimetal. Como en los grupos 14 y 15, el elemento más ligero del grupo 16, el oxígeno, se encuentra en la naturaleza como elemento libre.
Del grupo de 16 elementos, solo se conocía azufre en la antigüedad; los otros no fueron descubiertos hasta finales de los siglos XVIII y XIX. El azufre se encuentra frecuentemente como depósitos cristalinos amarillos de S esencialmente puro 8 en áreas de intensa actividad volcánica o alrededor de aguas termales. Ya en el siglo XV aC, el azufre se usaba como fumigante en la Grecia homérica porque, cuando se quema, produce humos de SO 2 que son tóxicos para la mayoría de los organismos, incluidos los bichos escondidos en las paredes y debajo de los pisos de casas. Por lo tanto, las referencias al azufre son comunes en la literatura antigua, con frecuencia en el contexto de la purificación religiosa. De hecho, la asociación del azufre con lo divino era tan generalizada que los prefijos tio- (que significa “azufre”) y theo- (que significa “dios”) tienen la misma raíz en el griego antiguo. Aunque se usa principalmente en la producción de ácido sulfúrico, el azufre también se usa para fabricar pólvora y como agente de reticulación para el caucho, que permite que el caucho mantenga su forma pero mantenga su flexibilidad.
El grupo 16 es el primer grupo en el bloque p sin elementos metálicos estables.
El oxígeno no se descubrió hasta 1771, cuando el farmacéutico sueco Carl Wilhelm Scheele descubrió que los compuestos de calentamiento como KNO 3 , Ag 2 CO 3 , y HgO produjo un gas incoloro e inodoro que mejoró la combustión que el aire. Sin embargo, los resultados no se publicaron de inmediato, por lo que el trabajo de Scheele permaneció desconocido hasta 1777. Desafortunadamente, esto fue casi dos años después de que se publicara un artículo del químico inglés Joseph Priestley, que describe el aislamiento del mismo gas usando una lupa para enfoca los rayos del sol en una muestra de HgO. El oxígeno se usa principalmente en la industria del acero durante la conversión de hierro crudo en acero utilizando el proceso Bessemer. Otro uso industrial importante del oxígeno es la producción de TiO 2 , que se usa comúnmente como pigmento blanco en pinturas, papel y plásticos.

El telurio fue descubierto accidentalmente en 1782 por el químico austríaco Franz Joseph Müller von Reichenstein, jefe de agrimensores de minas en Transilvania, quien también fue responsable del análisis de muestras de mineral. El metal blanco plateado tenía la misma densidad que el antimonio pero propiedades muy diferentes. Debido a que era difícil de analizar, Müller lo llamó metallum problematicum (que significa “metal difícil”). El nombre telurio (del latín tellus, que significa “tierra”) fue acuñado por otro químico austriaco, Martin Klaproth, quien demostró en 1798 que el “metal difícil” de Müller era en realidad un elemento nuevo. El telurio se usa para colorear el vidrio y la cerámica, en la fabricación de tapas de granallado y en dispositivos termoeléctricos.
Jöns Jakob Berzelius (1779-1848)
Berzelius nació en una familia sueca bien educada, pero ambos padres murieron cuando él era joven. Estudió medicina en la Universidad de Uppsala, donde sus experimentos con la terapia de electrochoque provocaron que sus intereses se volvieran a la electroquímica. Berzelius ideó el sistema de notación química que usamos hoy. Además, descubrió seis elementos (cerio, torio, selenio, silicio, titanio y circonio).
El calcógeno más pesado, el polonio, fue aislado después de un esfuerzo extraordinario por Marie Curie. Aunque nunca pudo obtener cantidades macroscópicas del elemento, que nombró para su país natal de Polonia, demostró que su química requería ser asignado al grupo 16. Marie Curie recibió un segundo Premio Nobel de Química en 1911 por El descubrimiento del radio y el polonio.
Preparación y propiedades generales de los elementos del Grupo 16
El oxígeno es, con mucho, el elemento más abundante en la corteza terrestre y en la hidrosfera (aproximadamente 44% y 86% en masa, respectivamente). El mismo proceso que se utiliza para obtener nitrógeno de la atmósfera produce oxígeno puro. El oxígeno también se puede obtener mediante la electrólisis del agua, la descomposición de peróxidos o superóxidos de metales alcalinos o alcalinotérreos, o la descomposición térmica de sales inorgánicas simples, como el clorato de potasio en presencia de una cantidad catalítica de MnO 2 [ 19459011]:
[ mathrm {2KClO_3 (s) overset {MnO_2 (s)} { underset { Delta} rightleftharpoons} 2KCl (s) + 3O_2 (g)} label {22.4.1} ] [ 19459003]
A diferencia del oxígeno, el azufre no es muy abundante, pero se encuentra como azufre elemental en las formaciones rocosas que recubren los domos de sal, que a menudo acompañan a los depósitos de petróleo (Figura ( PageIndex {1} )). El azufre también se recupera de H 2 S y compuestos organosulfurados en petróleo crudo y carbón y de minerales de sulfuro de metal como la pirita (FeS 2 ).

Debido a que el selenio y el teluro son químicamente similares al azufre, generalmente se encuentran como contaminantes menores en los minerales de sulfuro de metal y generalmente se recuperan como subproductos. Aun así, son tan abundantes en la corteza terrestre como la plata, el paladio y el oro. Una de las mejores fuentes de selenio y teluro es el “limo” depositado durante la purificación electrolítica del cobre. Ambos elementos son conocidos por los viles olores de muchos de sus compuestos. Por ejemplo, cuando el cuerpo absorbe incluso pequeñas cantidades de telurio, se produce dimetiltellurio [(CH 3 ) 2 Te] y se libera lentamente en el aliento y la transpiración, lo que produce un ajo intenso similar a un olor que comúnmente se llama “aliento de telurio”.
Con sus configuraciones electrónicas ns 2 np 4 , los calcógenos son dos electrones por debajo de una capa de valencia llena. Por lo tanto, en las reacciones con metales, tienden a adquirir dos electrones adicionales para formar compuestos en el estado de oxidación -2. Esta tendencia es mayor para el oxígeno, el calcógeno con la mayor electronegatividad. Los calcógenos más pesados y menos electronegativos pueden perder cuatro electrones np o cuatro np y dos electrones ns para formar compuestos en el estado de oxidación +4 y +6, respectivamente, como se muestra en la Tabla Figura ( PageIndex {1} ). Al igual que con los otros grupos, el miembro más ligero del grupo, en este caso el oxígeno, difiere mucho de los demás en tamaño, energía de ionización, electronegatividad y afinidad electrónica, por lo que su química es única. También como en los otros grupos, el segundo y tercer miembro (azufre y selenio) tienen propiedades similares debido a los efectos de protección. Solo el polonio es metálico, formando el ión Po hidratado 2 + o Po 4 + en solución acuosa, según las condiciones.
| Propiedad | Oxígeno | Azufre | Selenio | Telurio | Polonio |
|---|---|---|---|---|---|
| * La configuración que se muestra no incluye subcapas d y f llenas. | |||||
| † Los valores citados para las hexacaciones son para iones de seis coordenadas y son solo valores estimados. | |||||
| masa atómica (amu) | 16,00 | 32.07 | 78,96 | 127,60 | 209 |
| número atómico | 8 | 16 | 34 | 52 | 84 |
| radio atómico (pm) | 48 | 88 | 103 | 123 | 135 |
| símbolo atómico | O | S | Se | Te | Po |
| densidad (g / cm 3 ) a 25 ° C | 1,31 (g / L) | 2,07 | 4,81 | 6,24 | 9,20 |
| afinidad electrónica (kJ / mol) | −141 | −200 | −195 | −190 | −180 |
| electronegatividad | 3,4 | 2.6 | 2,6 | 2,1 | 2,0 |
| primera energía de ionización (kJ / mol) | 1314 | 1000 | 941 | 869 | 812 |
| radio iónico (pm) † | 140 (−2) | 184 (−2), 29 (+6) | 198 (−2), 42 (+6) | 221 (−2), 56 (+6) | 230 (−2), 97 (+4) |
| punto de fusión / punto de ebullición (° C) | −219 / −183 | 115/445 | 221/685 | 450/988 | 254/962 |
| estado (s) de oxidación normal (es) | −2 | +6, +4, −2 | +6, +4, −2 | +6, +4, −2 | +2 (+4) |
| producto de reacción con H 2 | H 2 O | H 2 S | H 2 Se | ninguno | ninguno |
| producto de reacción con N 2 | NO, NO 2 | ninguno | ninguno | ninguno | ninguno |
| producto de reacción con O 2 | – | SO 2 | SeO 2 | TeO 2 | PoO 2 |
| producto de reacción con X 2 | O 2 F 2 | SF 6 , S 2 Cl 2 , S 2 Br 2 | SeF 6 , SeX 4 | TeF 6 , TeX 4 | PoF 4 , PoCl 2 , PoBr 2 |
| potencial de reducción estándar (E °, V) (E 0 → H 2 E en solución ácida) | +1,23 | +0,14 | −0,40 | −0,79 | −1,00 |
| tipo de óxido | – | ácido | ácido | anfótero | básico |
| configuración electrónica de valencia * | 2s 2 2p 4 | 3s 2 3p 4 | 4s 2 4p 4 | 5s 2 5p 4 | 6s 2 6p 4 |
Reacciones y compuestos de oxígeno
Al igual que en los grupos 14 y 15, el miembro más ligero del grupo 16 tiene la mayor tendencia a formar enlaces múltiples. Así, el oxígeno elemental se encuentra en la naturaleza como un gas diatómico que contiene un doble enlace neto: O = O. Al igual que con el nitrógeno, la repulsión electrostática entre pares de electrones solitarios en átomos adyacentes evita que el oxígeno forme compuestos cateados estables. De hecho, a excepción de O 2 , todos los compuestos que contienen enlaces O – O son potencialmente explosivos. El ozono, los peróxidos y los superóxidos son todos potencialmente peligrosos en forma pura. El ozono (O 3 ), uno de los oxidantes más potentes conocidos, se utiliza para purificar el agua potable porque no produce el sabor característico asociado con el agua clorada. El peróxido de hidrógeno (H 2 O 2 ) es tan termodinámicamente inestable que tiende a sufrir una descomposición explosiva cuando es impuro:
[2H_2O_ {2 (l)} rightarrow 2H_2O _ {(l)} + O_ {2 (g)} ; ; ; ΔG ^ o = −119 ; kJ / mol label {1} ]
Como en los grupos 14 y 15, el elemento más ligero del grupo 16 tiene la mayor tendencia a formar enlaces múltiples.
A pesar de la fuerza del enlace O = O ( (D_ mathrm {O_2} ) = 494 kJ / mol), (O_2 ) es extremadamente reactivo, reaccionando directamente con casi todos los demás elementos, excepto los gases nobles . Algunas propiedades de O 2 y especies relacionadas, como los iones peróxido y superóxido, se encuentran en la Tabla ( PageIndex {2} ). Con pocas excepciones, la química del oxígeno está restringida a estados de oxidación negativos debido a su alta electronegatividad (χ = 3.4). A diferencia de otros calcógenos, el oxígeno no forma compuestos en el estado de oxidación +4 o +6. El oxígeno solo es superado por el flúor en su capacidad para estabilizar estados de oxidación alta de metales en compuestos iónicos y covalentes. Por ejemplo, AgO es un sólido estable que contiene plata en el estado inusual de Ag (II), mientras que OsO 4 es un sólido volátil que contiene Os (VIII). Debido a que el oxígeno es tan electronegativo, el enlace O-H es altamente polar, creando un gran momento dipolar de enlace que hace que el enlace de hidrógeno sea mucho más importante para compuestos de oxígeno que para compuestos similares de los otros calcógenos.
| Especie | Orden de fianza | Número de e no apareados – | Distancia O – O (pm) * |
|---|---|---|---|
| * Fuente de datos: Lauri Vaska, “Complejos de dioxígeno-metal: hacia una visión unificada”, Cuentas de Investigación Química 9 (1976): 175. | |||
| O 2 + | 2,5 | 1 | 112 |
| O 2 | 2 | 2 | 121 |
| O 2 – | 1,5 | 1 | 133 |
| O 2 2− | 1 | 0 | 149 |
Los óxidos metálicos son generalmente básicos, y los óxidos no metálicos son ácidos, mientras que los óxidos de elementos que se encuentran en o cerca de la banda diagonal de semimetales son generalmente anfóteros. Algunos óxidos, como CO y PbO 2 , son neutros y no reaccionan con agua, ácido acuoso o base acuosa. Los óxidos no metálicos son típicamente compuestos covalentes en los que los enlaces entre el oxígeno y el no metal están polarizados (E δ + –O δ− ). En consecuencia, un par solitario de electrones en una molécula de agua puede atacar el átomo de E parcialmente cargado positivamente para finalmente formar un oxoácido. Un ejemplo es hacer reaccionar el trióxido de azufre con agua para formar ácido sulfúrico:
[H_2O _ {(l)} + SO_ {3 (g)} rightarrow H_2SO_ {4 (aq)} label {2} ]
Los óxidos de los semimetales y de elementos como Al que se encuentran cerca de la línea divisoria metal / no metal son anfóteros, como esperamos:
[Al_2O_ {3 (s)} + 6H ^ + _ {(aq)} rightarrow 2Al ^ {3 +} _ {(aq)} + 3H_2O _ {(l)} label {3} ]
[Al_2O_ {3 (s)} + 2OH ^ −_ {(aq)} + 3H_2O _ {(l)} rightarrow 2Al (OH) ^ −_ {4 (aq)} label {4} ]
Los óxidos de metales tienden a ser básicos, los óxidos de no metales tienden a ser ácidos, y los óxidos de elementos en o cerca de la banda diagonal de semimetales son generalmente anfóteros.
Ejemplo ( PageIndex {1} )
Para cada reacción, explica por qué se forman los productos dados.
- Ga 2 O 3 (s) + 2OH – (aq) + 3H 2 O (l) → 2Ga ( OH) 4 – (ac)
- 3H 2 O 2 (aq) + 2MnO 4 – (aq) + 2H + (aq) → 3O 2 (g) + 2MnO 2 (s) + 4H 2 O (l)
- KNO 3 (s) ( xrightarrow { Delta} ) KNO (s) + O 2 (g)
Dado: ecuaciones químicas equilibradas
Preguntado por: por qué se forman los productos
Estrategia:
Clasifica el tipo de reacción. Usando tendencias periódicas en las propiedades atómicas, termodinámica y cinética, explique por qué se forman los productos de reacción observados.
Solución:
- El galio es un metal. Esperamos que los óxidos de los elementos metálicos sean básicos y, por lo tanto, no reaccionen con una base acuosa. Sin embargo, una mirada cercana a la tabla periódica muestra que el galio está cerca de la línea diagonal de semimetales. Además, el aluminio, el elemento inmediatamente superior al galio en el grupo 13, es anfótero . En consecuencia, predecimos que el galio se comportará como el aluminio (Ecuación ( ref {4} )).
- El peróxido de hidrógeno es un oxidante que puede aceptar dos electrones por molécula para dar dos moléculas de agua. Sin embargo, con un oxidante fuerte, H 2 O 2 también puede actuar como un reductor, perdiendo dos electrones (y dos protones) para producir O 2 . Debido a que el otro reactivo es el permanganato, que es un oxidante potente, la única reacción posible es una reacción redox en la que el permanganato es el oxidante y el peróxido de hidrógeno es el reductor. Recuerde que la reducción del permanganato a menudo da MnO 2 , un sólido marrón insoluble. Reducción de MnO 4 – a MnO 2 es una reducción de tres electrones, mientras que la oxidación de H 2 O 2 [ 19459011] a O 2 es una oxidación de dos electrones.
- Esta es una reacción de descomposición térmica. Debido a que KNO 3 contiene nitrógeno en su estado de oxidación más alto (+5) y oxígeno en su estado de oxidación más bajo (−2), es probable una reacción redox. La oxidación del oxígeno en nitrato a oxígeno atómico es un proceso de dos electrones por átomo de oxígeno. Es probable que el nitrógeno acepte dos electrones porque los oxoaniones de nitrógeno solo se conocen en el +5 (NO 3 – ) y +3 (NO 2 – ) estados de oxidación.
Ejercicio ( PageIndex {2} )
Predice los productos de cada reacción y escribe una ecuación química equilibrada para cada reacción.
- SiO 2 (s) + H + (aq) →
- NO (g) + O 2 (g) →
- SO 3 (g) + H 2 O (l) →
- H 2 O 2 (aq) + I – (aq) →
Respuesta:
- SiO 2 (s) + H + (aq) → sin reacción
- 2NO (g) + O 2 (g) → 2NO 2 (g)
- SO 3 (g) + H 2 O (l) → H 2 SO 4 (aq)
- H 2 O 2 (aq) + 2I – (aq) → I 2 (aq) + 2OH [19459028 ] – (aq)
Reacciones y compuestos de los calcógenos más pesados
Debido a que la mayoría de los calcógenos más pesados (grupo 16) y pnicógenos (grupo 15) no son metales, a menudo forman compuestos similares. Por ejemplo, ambos elementos del tercer período de estos grupos (fósforo y azufre) forman compuestos cateados y forman múltiples alótropos. De acuerdo con las tendencias periódicas, la tendencia a catear disminuye a medida que avanzamos en la columna.
El azufre y el selenio forman una serie bastante extensa de especies cateneadas. Por ejemplo, el azufre elemental forma anillos S 8 empaquetados en una disposición compleja de “cigüeñal” (Figura ( PageIndex {2} )), y el azufre fundido contiene largas cadenas de átomos de azufre conectados por S– S enlaces. Además, tanto el azufre como el selenio forman polisulfuros (S n 2− ) y poliselenuros (Se n 2− ), con n ≤ 6. El único alótropo estable de teluro es una sustancia blanca plateada cuyas propiedades y estructura son similares a las de uno de los alótropos de selenio. El polonio, por el contrario, no muestra tendencia a formar compuestos cateados. La sorprendente disminución en la complejidad estructural del azufre al polonio es consistente con la disminución en la resistencia de los enlaces simples y el aumento en el carácter metálico a medida que avanzamos en el grupo.
Como en el grupo 15, la reactividad de los elementos en el grupo 16 disminuye del más ligero al más pesado. Por ejemplo, el selenio y el telurio reaccionan con la mayoría de los elementos, pero no tan fácilmente como lo hace el azufre. Como se esperaba para los no metales, el azufre, el selenio y el teluro no reaccionan con agua, ácido acuoso o base acuosa, sino que se disuelven en ácidos fuertemente oxidantes como el HNO 3 para formar oxoácidos como el H 2 SO 4 . A diferencia de los otros calcógenos, el polonio se comporta como un metal, disolviéndose en HCl diluido para formar soluciones que contienen el ion Po 2 + .
Al igual que con los otros grupos, la tendencia a catenado, la fuerza de los enlaces simples y la reactividad disminuyen en el grupo.
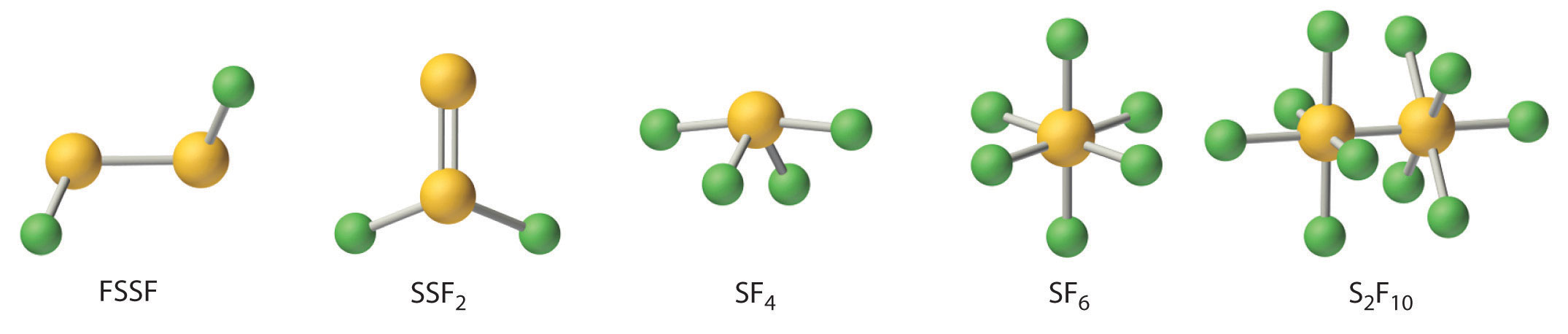
El flúor reacciona directamente con todos los calcógenos, excepto el oxígeno, para producir los hexafluoruros (YF 6 ), que son compuestos extraordinariamente estables y no reactivos. Se conocen cuatro fluoruros de azufre estables adicionales; así, los estados de oxidación de azufre varían de +1 a +6 (Figura ( PageIndex {2} )). Por el contrario, solo cuatro fluoruros de selenio (SeF 6 , SeF 4 , FSeSeF y SeSeF 2 ) y solo tres de teluro (TeF 4 , TeF 6 y Te 2 F 10 ) son conocidos.
La reacción directa de los calcógenos más pesados con oxígeno a temperaturas elevadas da los dióxidos (YO 2 ), que exhiben una gama dramática de estructuras y propiedades. Los dióxidos se vuelven cada vez más metálicos en el grupo, como se esperaba, y el número de coordinación del calcógeno aumenta constantemente. Por lo tanto, SO 2 es un gas que contiene moléculas en forma de V (como lo predice el modelo de repulsión de pares de electrones de capa de valencia), SeO 2 es un sólido blanco con una estructura de cadena infinita (cada Se tiene tres coordenadas), TeO 2 es un sólido amarillo claro con una estructura de red en la que cada átomo de Te tiene cuatro coordenadas, y PoO 2 es un sólido iónico amarillo en el que cada Po 4 + ión es ocho coordenadas.
Los dióxidos de azufre, selenio y teluro reaccionan con el agua para producir los oxoácidos dipróticos débiles (H 2 YO 3 – ácido sulfuroso, selenoso y teluroso, respectivamente) . Tanto el ácido sulfúrico como el ácido selenico (H 2 SeO 4 ) son ácidos fuertes, pero el ácido telúrico [Te (OH) 6 ] es bastante diferente. Como el telurio es más grande que el azufre o el selenio, forma enlaces π más débiles con el oxígeno. Como resultado, la estructura más estable para el ácido telúrico es Te (OH) 6 , con seis enlaces Te – OH en lugar de enlaces Te = O. Por lo tanto, el ácido telúrico se comporta como un ácido triprótico débil en solución acuosa, perdiendo sucesivamente los átomos de hidrógeno unidos a tres de los átomos de oxígeno. Como se esperaba para los compuestos que contienen elementos en su estado de oxidación más alto accesible (+6 en este caso), los ácidos sulfúrico, selenico y telúrico son oxidantes. Debido a que la estabilidad del estado de oxidación más alto disminuye con el aumento del número atómico, el ácido telúrico es un oxidante más fuerte que el ácido sulfúrico.
La estabilidad del estado de oxidación más alto de los calcógenos disminuye en la columna.
El azufre y, en menor medida, el selenio reaccionan con el carbono para formar una extensa serie de compuestos que son estructuralmente similares a sus análogos de oxígeno. Por ejemplo, CS 2 y CSe 2 son líquidos volátiles que contienen enlaces C = S o C = Se y tienen la misma estructura lineal que CO 2 . Sin embargo, debido a que estos enlaces dobles son significativamente más débiles que el enlace C = O, CS 2 , CSe 2 , y los compuestos relacionados son menos estables y más reactivos que sus análogos de oxígeno. Los calcógenos también reaccionan directamente con casi todos los metales para formar compuestos con una amplia gama de estequiometrías y una variedad de estructuras. Los calcogenuros metálicos pueden contener el ion calcogenuro simple (Y 2− ), como en Na 2 S y FeS, o iones de policacogenuro (Y n 2− ), como en FeS 2 y Na 2 S 5 .
Los dióxidos de los elementos del grupo 16 se vuelven cada vez más básicos, y el número de coordinación del calcógeno aumenta constantemente en el grupo.
Los calcogenuros iónicos como Na 2 S reaccionan con ácido acuoso para producir hidruros binarios como el sulfuro de hidrógeno (H 2 S). Debido a que la fuerza del enlace Y – H disminuye con el aumento del radio atómico, la estabilidad de los hidruros binarios disminuye rápidamente en el grupo. Quizás sea sorprendente que el sulfuro de hidrógeno, con su olor familiar a huevo podrido, sea mucho más tóxico que el cianuro de hidrógeno (HCN), el gas utilizado para ejecutar prisioneros en la “cámara de gas”. El sulfuro de hidrógeno a concentraciones relativamente bajas amortigua los receptores olfativos de la nariz, lo que le permite alcanzar niveles tóxicos sin detección y lo hace especialmente peligroso.
Ejemplo ( PageIndex {2} )
Para cada reacción, explique por qué el producto dado se forma o no se produce reacción.
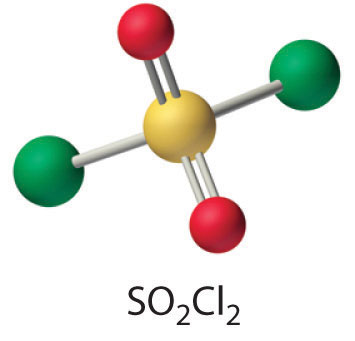
- SO 2 (g) + Cl 2 (g) → SO 2 Cl 2 (l)
- SF 6 (g) + H 2 O (l) → sin reacción
- 2Se (s) + Cl 2 (g) → Se 2 Cl 2 (l)
Dado: ecuaciones químicas equilibradas
Preguntado por: por qué se forman los productos (o ningún producto)
Estrategia:
Clasifica el tipo de reacción. Utilizando tendencias periódicas en las propiedades atómicas, termodinámica y cinética, explique por qué se forman los productos de reacción o por qué no ocurre reacción.
Solución:
- One of the reactants (Cl 2 ) is an oxidant. If the other reactant can be oxidized, then a redox reaction is likely. Sulfur dioxide contains sulfur in the +4 oxidation state, which is 2 less than its maximum oxidation state. Sulfur dioxide is also known to be a mild reducing agent in aqueous solution, producing sulfuric acid as the oxidation product. Hence a redox reaction is probable. The simplest reaction is the formation of SO 2 Cl 2 (sulfuryl chloride), which is a tetrahedral species with two S–Cl and two S=O bonds.
- Sulfur hexafluoride is a nonmetallic halide. Such compounds normally react vigorously with water to produce an oxoacid of the nonmetal and the corresponding hydrohalic acid. In this case, however, we have a highly stable species, presumably because all of sulfur’s available orbitals are bonding orbitals. Thus SF 6 is not likely to react with water.
- Here we have the reaction of a chalcogen with a halogen. The halogen is a good oxidant, so we can anticipate that a redox reaction will occur. Only fluorine is capable of oxidizing the chalcogens to a +6 oxidation state, so we must decide between SeCl 4 and Se 2 Cl 2 as the product. The stoichiometry of the reaction determines which of the two is obtained: SeCl 4 or Se 2 Cl 2 .
Ejercicio ( PageIndex {2} )
Predict the products of each reaction and write a balanced chemical equation for each reaction.
- Te(s) + Na(s) (xrightarrow{Delta})
- SF 4 (g) + H 2 O(l) →
- CH 3 SeSeCH 3 (soln) + K(s) →
- Li 2 Se(s) + H + (aq) →
Answer:
- Te(s) + 2Na(s) → Na 2 Te(s)
- SF 4 (g) + 3H 2 O(l) → H 2 SO 3 (aq) + 4HF(aq)
- CH 3 SeSeCH 3 (soln) + 2K(s) → 2KCH 3 Se(soln)
- Li 2 Se(s) + 2H + (aq) → H 2 Se(g) + 2Li + (aq)
Summary
The chalcogens have no stable metallic elements. The tendency to catenate, the strength of single bonds, and the reactivity all decrease moving down the group. Because the electronegativity of the chalcogens decreases down the group, so does their tendency to acquire two electrons to form compounds in the −2 oxidation state. The lightest member, oxygen, has the greatest tendency to form multiple bonds with other elements. It does not form stable catenated compounds, however, due to repulsions between lone pairs of electrons on adjacent atoms. Because of its high electronegativity, the chemistry of oxygen is generally restricted to compounds in which it has a negative oxidation state, and its bonds to other elements tend to be highly polar. Metal oxides are usually basic, and nonmetal oxides are acidic, whereas oxides of elements along the dividing line between metals and nonmetals are amphoteric. The reactivity, the strength of multiple bonds to oxygen, and the tendency to form catenated compounds all decrease down the group, whereas the maximum coordination numbers increase. Because Te=O bonds are comparatively weak, the most stable oxoacid of tellurium contains six Te–OH bonds. The stability of the highest oxidation state (+6) decreases down the group. Double bonds between S or Se and second-row atoms are weaker than the analogous C=O bonds because of reduced orbital overlap. The stability of the binary hydrides decreases down the group.