Los compuestos orgánicos, moléculas creadas alrededor de una cadena de átomos de carbono (más comúnmente conocida como columna vertebral de carbono), juegan un papel esencial en la química de la vida. Estas moléculas derivan su importancia de la energía que transportan, principalmente en forma de energía potencial entre las moléculas atómicas. Dado que dicha fuerza potencial puede verse ampliamente afectada debido a cambios en la colocación atómica, es importante comprender el concepto de un isómero, una molécula que comparte la misma composición atómica que otra pero que difiere en su disposición estructural.
Los estereoisómeros son isómeros que difieren en la disposición espacial de los átomos, en lugar del orden de conectividad atómica. Uno de los tipos de isómeros más interesantes son los estereoisómeros de imagen especular, un conjunto no superponible de dos moléculas que son imágenes especulares entre sí. La existencia de estas moléculas está determinada por el concepto conocido como quiralidad.
Estereoisómeros
Las moléculas con la misma conectividad pero diferentes disposiciones de los átomos en el espacio se denominan estereoisómeros. Hay dos tipos de estereoisómeros: geométricos y ópticos. Los isómeros geométricos difieren en la (s) posición (es) relativa (s) de los sustituyentes en una molécula rígida. La rotación simple sobre un enlace C – C σ en un alqueno, por ejemplo, no puede ocurrir debido a la presencia del enlace π. Por lo tanto, los sustituyentes están rígidamente bloqueados en una disposición espacial particular. Por lo tanto, un enlace múltiple carbono-carbono, o en algunos casos un anillo, evita que un isómero geométrico se convierta fácilmente en el otro. Los miembros de un par isomérico se identifican como cis o trans, y la interconversión entre las dos formas requiere romper y reformar uno o más enlaces. Debido a que su diferencia estructural hace que tengan diferentes propiedades físicas y químicas, los isómeros cis y trans son en realidad dos compuestos químicos distintos.
Los estereoisómeros tienen la misma conectividad, pero diferentes disposiciones de átomos en el espacio.
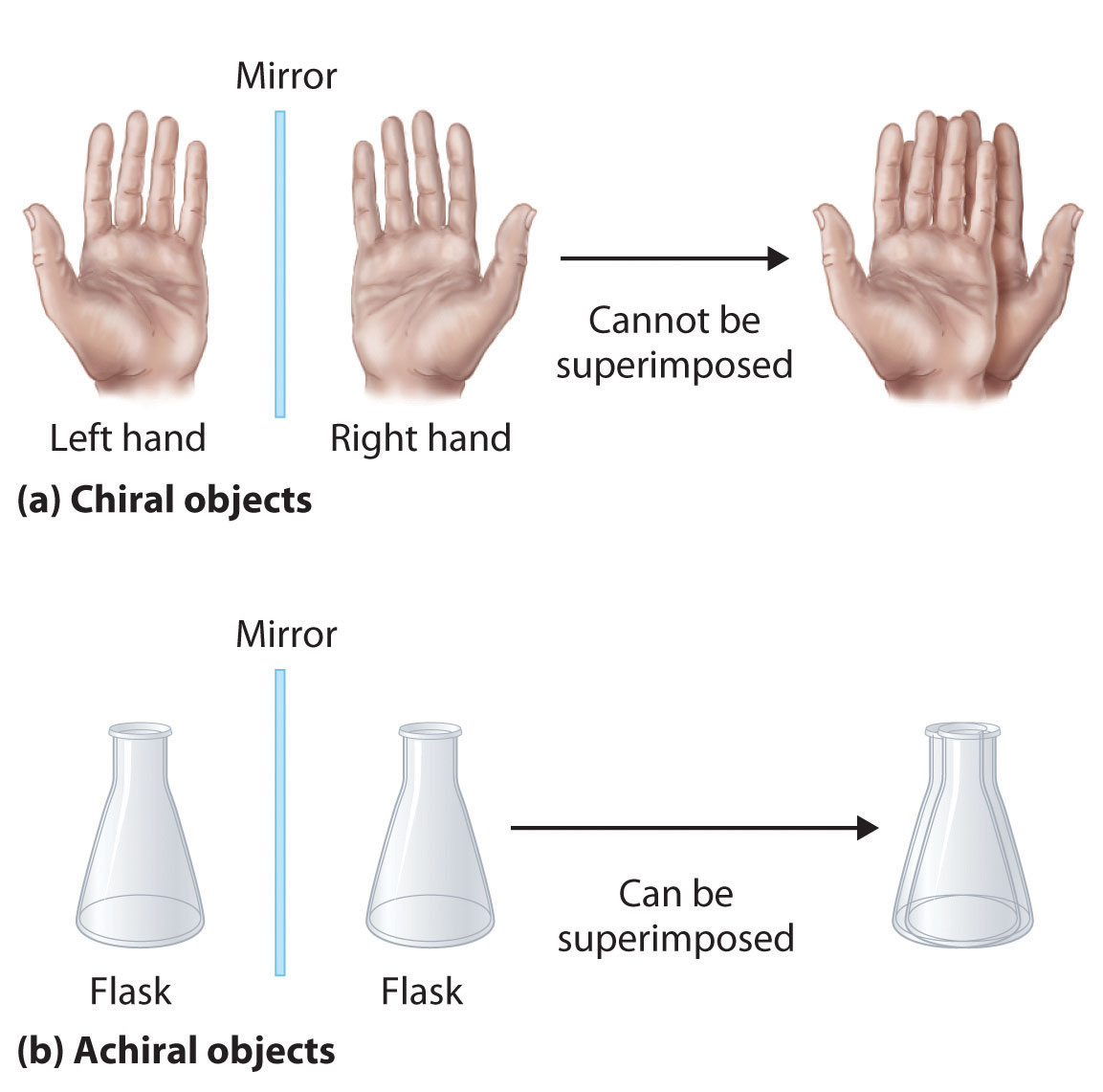
Los isómeros ópticos son moléculas cuyas estructuras son imágenes especulares pero no pueden superponerse entre sí en ninguna orientación. Los isómeros ópticos tienen propiedades físicas idénticas, aunque sus propiedades químicas pueden diferir en entornos asimétricos. Se dice que las moléculas que son imágenes especulares no superponibles entre sí son quirales (pronunciado “ky-ral”, del griego cheir, que significa “mano”). Ejemplos de algunos objetos quirales familiares son sus manos, pies y orejas. Como se muestra en la Figura ( PageIndex {1a} ), sus manos izquierda y derecha son imágenes especulares no superponibles. (Intente colocar su zapato derecho sobre su pie izquierdo, simplemente no funciona.) Un objeto aquiral es uno que se puede superponer en su imagen especular, como se muestra en los frascos superpuestos en la Figura ( PageIndex {1b} ) .
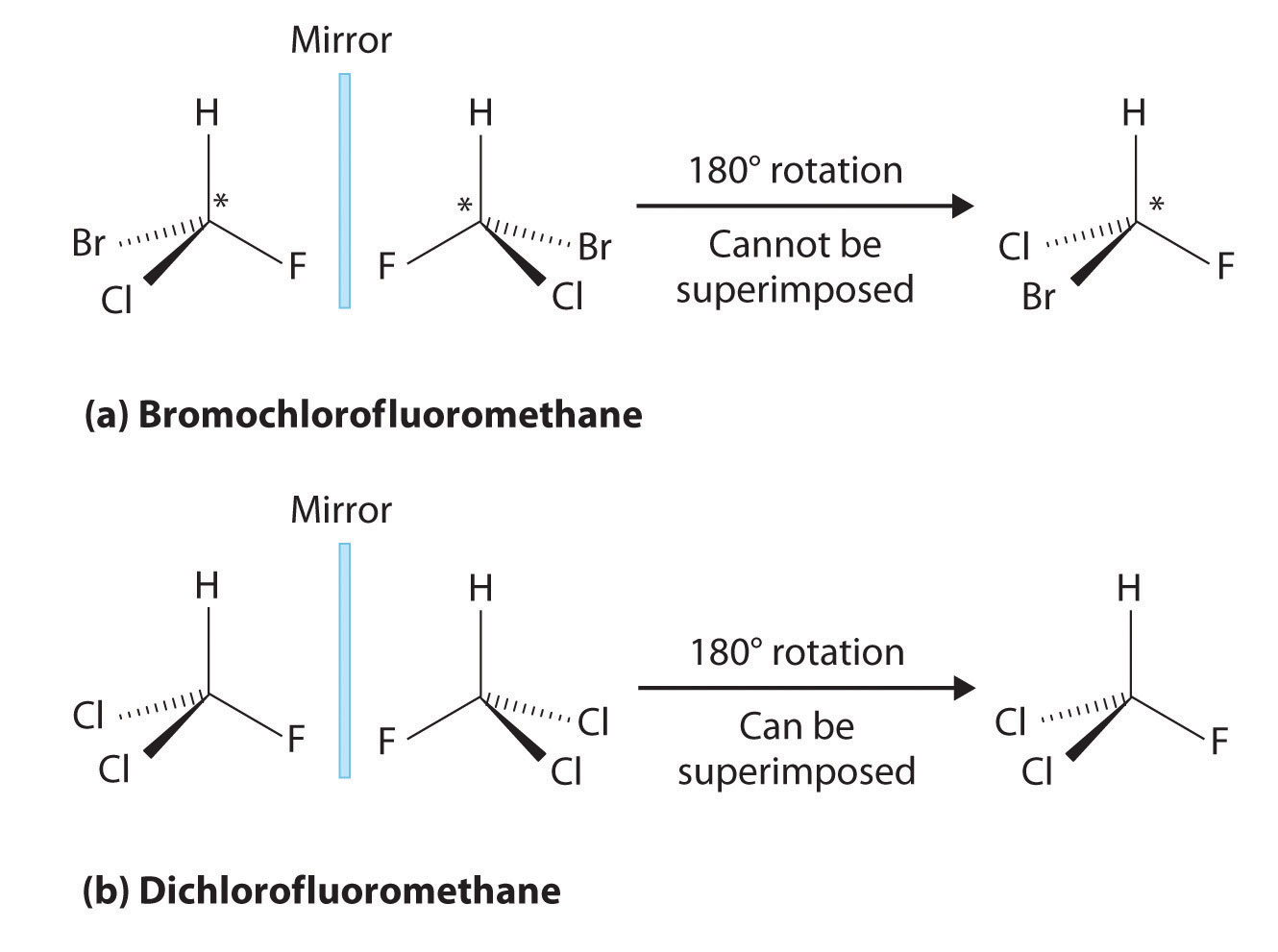
La mayoría de las moléculas orgánicas quirales tienen al menos un átomo de carbono que está unido a cuatro grupos diferentes, como ocurre en la molécula de bromoclorofluorometano que se muestra en la parte (a) en la Figura ( PageIndex {2} ). Este carbono, a menudo designado por un asterisco en los dibujos estructurales, se llama centro quiral o átomo de carbono asimétrico. Si el átomo de bromo se reemplaza por otro cloro (Figura ( PageIndex {2b} )), la molécula y su imagen especular ahora se pueden superponer mediante una simple rotación. Por lo tanto, el carbono ya no es un centro quiral. Los átomos de carbono asimétricos se encuentran en muchas moléculas naturales, como el ácido láctico, que está presente en la leche y los músculos, y la nicotina, un componente del tabaco. Una molécula y su imagen especular no superponible se llaman enantiómeros (del griego enantiou, que significa “opuesto”).
Buscar planos de simetría en una molécula es útil, pero a menudo difícil en la práctica. En la mayoría de los casos, la forma más fácil de decidir si una molécula es quiral o aquiral es buscar uno o más estereocentros; con algunas raras excepciones, la regla general es que las moléculas con al menos un estereocentro son quirales y las moléculas sin estereocentros son aquirales Los estereocentros de carbono también se conocen con bastante frecuencia como carbonos quirales .
Cuando se evalúa la quiralidad de una molécula, es importante reconocer que la cuestión de si se usa o no la convención de dibujo de cuña discontinua / sólida es irrelevante. Las moléculas quirales a veces se dibujan sin usar cuñas (aunque obviamente esto significa que se omite la información estereoquímica). Por el contrario, las cuñas se pueden usar en carbonos que no son estereocentros; observe, por ejemplo, los dibujos de glicina y citrato en la figura anterior. Solo porque vea cuñas discontinuas y sólidas en una estructura, no asuma automáticamente que está mirando un estereocentro.