Objetivos de aprendizaje
- Reconocer aminoácidos y clasificarlos en función de las características de sus cadenas laterales.
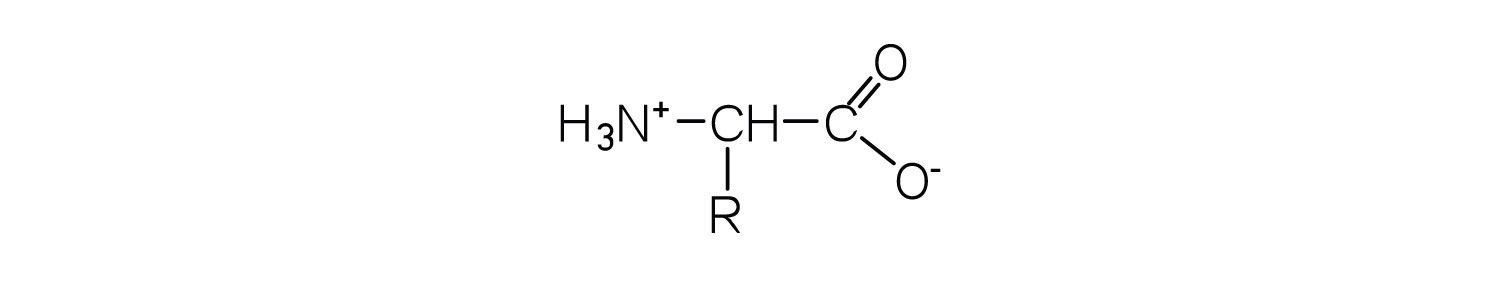
Las proteínas en todas las especies vivas, desde las bacterias hasta los humanos, se construyen a partir del mismo conjunto de 20 aminoácidos, llamado así porque cada uno contiene un grupo amino unido a un ácido carboxílico. Los aminoácidos en las proteínas son α-aminoácidos, lo que significa que el grupo amino está unido al carbono α del ácido carboxílico. Los humanos pueden sintetizar solo aproximadamente la mitad de los aminoácidos necesarios; el resto debe obtenerse de la dieta y se conocen como aminoácidos esenciales. Sin embargo, se han encontrado dos aminoácidos adicionales en cantidades limitadas en proteínas: la selenocisteína se descubrió en 1986, mientras que la pirrolisina se descubrió en 2002.
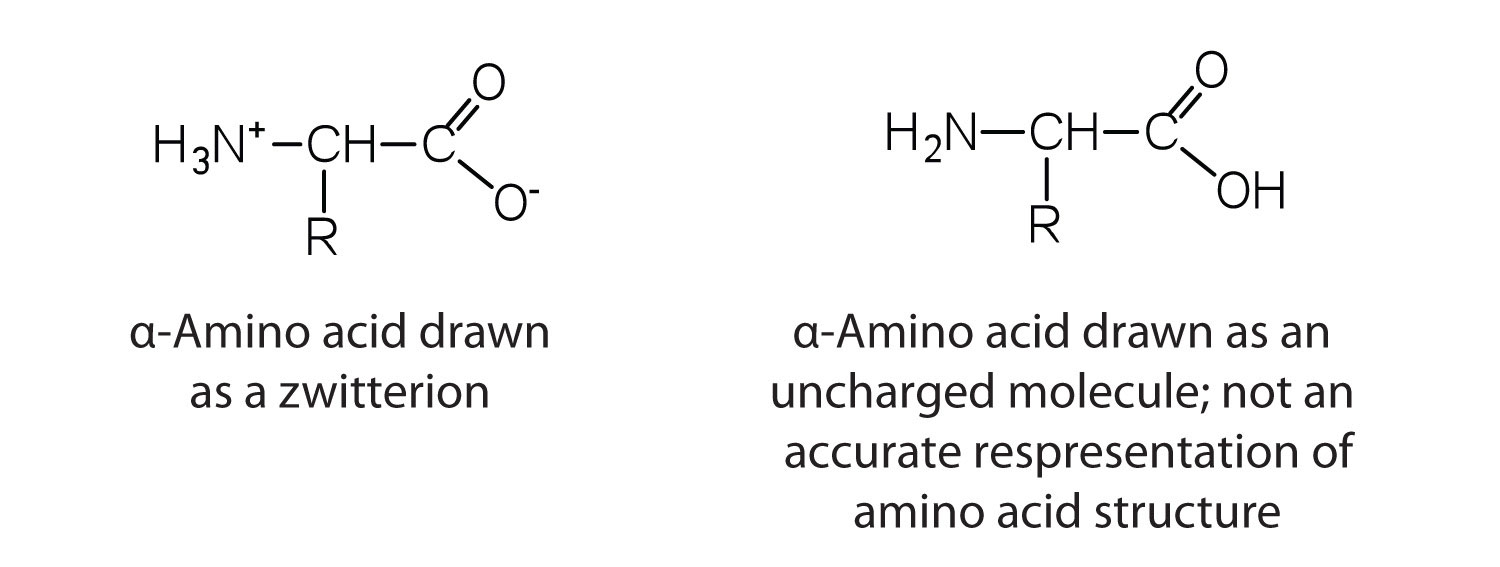
Los aminoácidos son sólidos cristalinos incoloros, no volátiles, que se funden y se descomponen a temperaturas superiores a 200 ° C. Estas temperaturas de fusión se parecen más a las de las sales inorgánicas que a las de las aminas o los ácidos orgánicos e indican que las estructuras de los aminoácidos en estado sólido y en solución neutra se representan mejor con un grupo con carga negativa y un grupo con carga positiva. Dicha especie se conoce como zwitterion .
Clasificación
Además de los grupos amino y carboxilo, los aminoácidos tienen una cadena lateral o grupo R unido al carbono α. Cada aminoácido tiene características únicas que surgen del tamaño, la forma, la solubilidad y las propiedades de ionización de su grupo R. Como resultado, las cadenas laterales de aminoácidos ejercen un profundo efecto sobre la estructura y la actividad biológica de las proteínas. Aunque los aminoácidos se pueden clasificar de varias maneras, un enfoque común es clasificarlos según si el grupo funcional en la cadena lateral a pH neutro es no polar, polar pero no cargado, cargado negativamente o cargado positivamente. Las estructuras y los nombres de los 20 aminoácidos, sus abreviaturas de una y tres letras, y algunas de sus características distintivas se dan en la Tabla ( PageIndex {1} ).
El primer aminoácido que se aisló fue la asparagina en 1806. Se obtuvo de la proteína que se encuentra en el jugo de espárragos (de ahí el nombre). La glicina, el aminoácido principal que se encuentra en la gelatina, recibió su nombre por su sabor dulce (griego glykys , que significa “dulce”). En algunos casos, un aminoácido que se encuentra en una proteína es en realidad un derivado de uno de los 20 aminoácidos comunes (uno de esos derivados es la hidroxiprolina). La modificación ocurre después de el aminoácido ha sido ensamblado en una proteína.
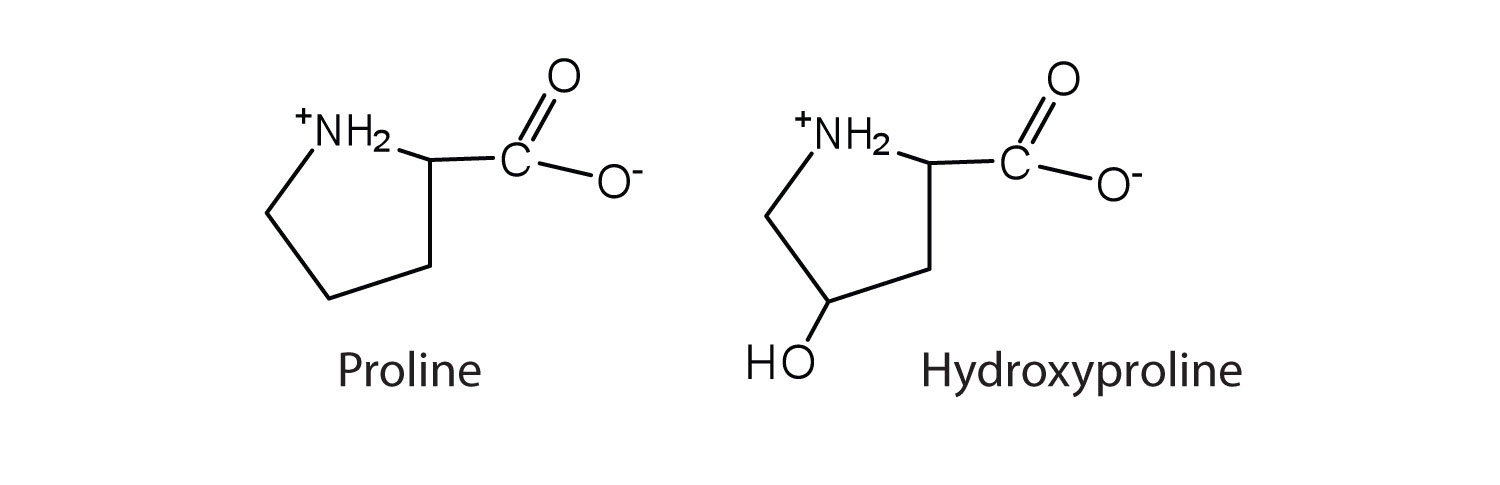
Configuración
Observe en la Tabla ( PageIndex {1} ) que la glicina es el único aminoácido cuyo carbono α es no quiral . Por lo tanto, con la excepción de la glicina, los aminoácidos podrían existir teóricamente en forma enantiomérica D o L y rotar la luz polarizada en el plano. Al igual que con los azúcares, los químicos usan el gliceraldehído como compuesto de referencia para la asignación de la configuración a los aminoácidos. Su estructura se asemeja mucho a una estructura de aminoácidos, excepto que en este último, un grupo amino toma el lugar del grupo OH en el carbono quiral del azúcar.
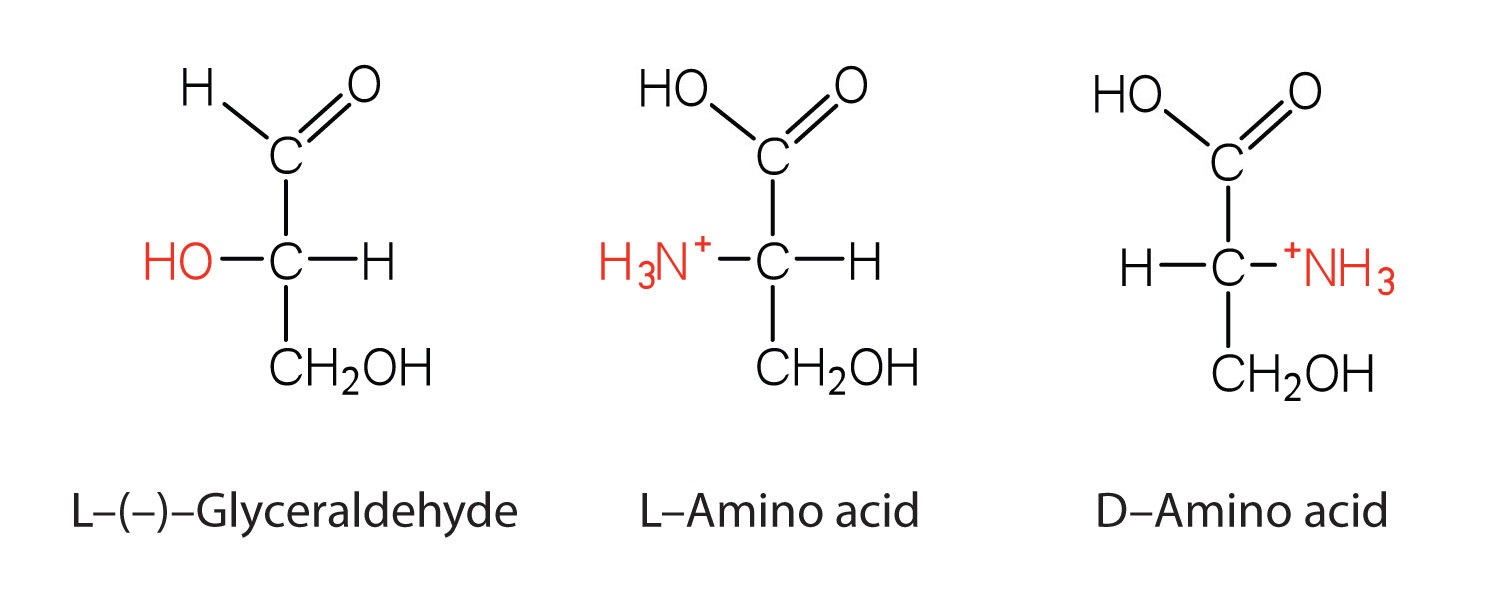
Aprendimos que todos los azúcares naturales pertenecen a la serie D. Es interesante, por lo tanto, que casi todas las proteínas vegetales y animales conocidas están compuestas completamente de L-aminoácidos. Sin embargo, ciertas bacterias contienen D-aminoácidos en sus paredes celulares, y varios antibióticos (por ejemplo, actinomicina D y gramicidinas) contienen cantidades variables de D-leucina, D-fenilalanina y D-valina.
Resumen
Los aminoácidos se pueden clasificar según las características de sus cadenas laterales distintivas como no polares, polares pero sin carga, con carga negativa o con carga positiva. Los aminoácidos que se encuentran en las proteínas son los L-aminoácidos.
Ejercicios de revisión del concepto
-
¿Cuál es la estructura general de un α-aminoácido?
-
Identifica el aminoácido que se ajusta a cada descripción.
- también conocido como aspartato
- una base casi tan fuerte como el hidróxido de sodio
- no tiene carbono quiral
Respuestas
-
-
- ácido aspártico
- arginina
- glicina
Ejercicios
-
Escribe la cadena lateral de cada aminoácido.
- serina
- arginina
- fenilalanina
-
Escribe la cadena lateral de cada aminoácido.
- ácido aspártico
- metionina
- valina
-
Dibuja la estructura para cada aminoácido.
- alanina
- cisteína
- histidina
-
Dibuja la estructura para cada aminoácido.
- treonina
- ácido glutámico
- leucina
-
Identifica un aminoácido cuya cadena lateral contiene un (n)
- grupo funcional amida.
- anillo aromático.
- grupo carboxilo.
-
Identifica un aminoácido cuya cadena lateral contiene un (n)
- Grupo OH
- cadena ramificada
- grupo amino
Respuestas
-
- CH 2 OH –
-
-
-
-
-
-
- asparagina o glutamina
- fenilalanina, tirosina o triptófano
- ácido aspártico o ácido glutámico
Objetivos de aprendizaje
- Describa los cuatro niveles de estructura proteica.
- Identifique los tipos de interacciones atractivas que mantienen las proteínas en su estructura tridimensional más estable.
- Explica qué sucede cuando las proteínas se desnaturalizan.
- Identifica cómo se puede desnaturalizar una proteína.
Cada una de las miles de proteínas naturales tiene su propia composición y secuencia de aminoácidos característica que dan como resultado una forma tridimensional única. Desde la década de 1950, los científicos han determinado las secuencias de aminoácidos y la conformación tridimensional de numerosas proteínas y, por lo tanto, obtuvieron pistas importantes sobre cómo cada proteína realiza su función específica en el cuerpo.
Las proteínas son compuestos de alta masa molar que consisten en gran parte o completamente en cadenas de aminoácidos. Debido a su gran complejidad, las moléculas de proteínas no pueden clasificarse en función de similitudes estructurales específicas, ya que los carbohidratos y los lípidos se clasifican. Las dos principales clasificaciones estructurales de las proteínas se basan en cualidades mucho más generales: si la proteína es (1) fibrosa e insoluble o (2) globular y soluble. Algunas proteínas, como las que componen el cabello, la piel, los músculos y el tejido conectivo, son fibrosas. Estas proteínas fibrosas son insolubles en agua y generalmente cumplen funciones estructurales, conectivas y protectoras. Ejemplos de proteínas fibrosas son queratinas, colágenos, miosinas y elastinas. El cabello y la capa externa de la piel están compuestos de queratina. Los tejidos conectivos contienen colágeno. Las miosinas son proteínas musculares y son capaces de contraerse y extenderse. Las elastinas se encuentran en los ligamentos y el tejido elástico de las paredes arteriales.
Las proteínas globulares , la otra clase principal, son solubles en medios acuosos. En estas proteínas, las cadenas se pliegan para que la molécula en su conjunto sea más o menos esférica. Ejemplos conocidos incluyen albúmina de huevo de claras de huevo y albúmina sérica en sangre. La albúmina sérica desempeña un papel importante en el transporte de ácidos grasos y en el mantenimiento de un equilibrio adecuado de las presiones osmóticas en el cuerpo. La hemoglobina y la mioglobina, que son importantes para unir el oxígeno, también son proteínas globulares.
Niveles de estructura proteica
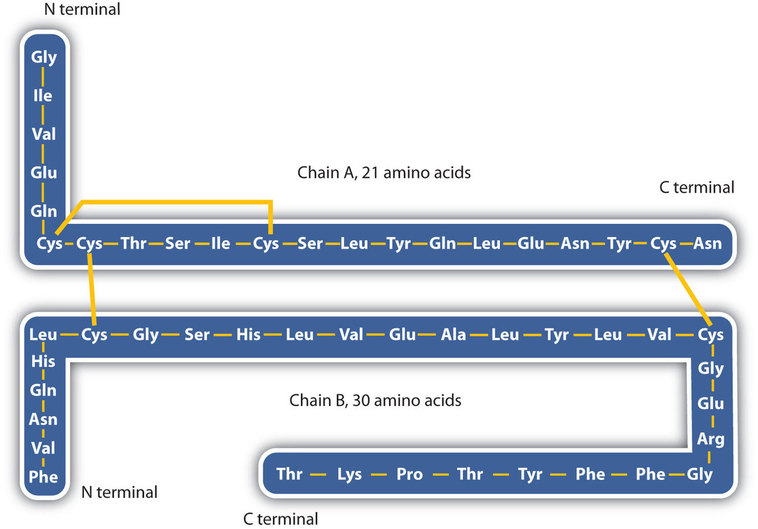
La estructura de las proteínas se describe generalmente como que tiene cuatro niveles de organización. La primera de ellas es la estructura primaria , que es el número y la secuencia de aminoácidos en la cadena o cadenas de polipéptidos de una proteína, comenzando con el grupo amino libre y mantenido por los enlaces peptídicos que conectan cada aminoácido con el siguiente. La estructura primaria de la insulina, compuesta de 51 aminoácidos, se muestra en la Figura ( PageIndex {1} ).
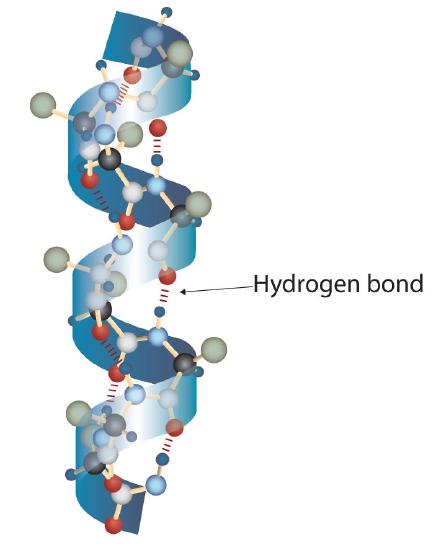
Una molécula de proteína no es una maraña aleatoria de cadenas de polipéptidos. En cambio, las cadenas están dispuestas en conformaciones únicas pero específicas. El término estructura secundaria se refiere a la disposición fija del esqueleto del polipéptido. Sobre la base de los estudios de rayos X, Linus Pauling y Robert Corey postularon que ciertas proteínas o porciones de proteínas se retuercen en espiral o hélice. Esta hélice se estabiliza mediante intracadena enlaces de hidrógeno entre el átomo de oxígeno de carbonilo de un aminoácido y el átomo de hidrógeno de amida cuatro aminoácidos arriba de la cadena (ubicado en la próxima vuelta de la hélice) y se conoce como un derecho α-hélice de mano. Los datos de rayos X indican que esta hélice gira una vez por cada 3.6 aminoácidos, y las cadenas laterales de estos aminoácidos se proyectan hacia afuera desde la columna vertebral en espiral (Figura ( PageIndex {2} )). Las queratinas α, que se encuentran en el cabello y la lana, tienen una conformación exclusivamente helicoidal α. Algunas proteínas, como la gammaglobulina, la quimotripsina y el citocromo c, tienen poca o ninguna estructura helicoidal. Otros, como la hemoglobina y la mioglobina, son helicoidales en ciertas regiones pero no en otras.
Otro tipo común de estructura secundaria, llamada conformación de lámina plisada β , es una disposición en forma de lámina en la que dos o más cadenas de polipéptidos extendidas (o regiones separadas en la misma cadena) están alineadas una al lado de la otra . Los segmentos alineados pueden correr paralelos o antiparalelos, es decir, los terminales N pueden estar orientados en la misma dirección en cadenas adyacentes o en diferentes direcciones, y están conectados por enlaces de hidrógeno intercadena (Figura ( PageIndex {3} )). La lámina plisada β es particularmente importante en proteínas estructurales, como la fibroína de seda. También se observa en porciones de muchas enzimas, como la carboxipeptidasa A y la lisozima.
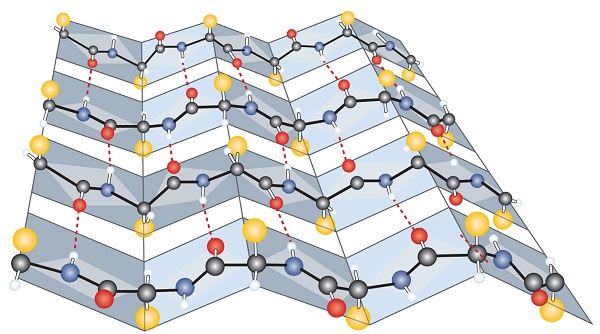
La estructura terciaria se refiere a la forma tridimensional única de la proteína en su conjunto, que resulta del plegamiento y flexión de la estructura de la proteína. La estructura terciaria está íntimamente ligada al correcto funcionamiento bioquímico de la proteína. La figura ( PageIndex {4} ) muestra una representación de la estructura tridimensional de la insulina.
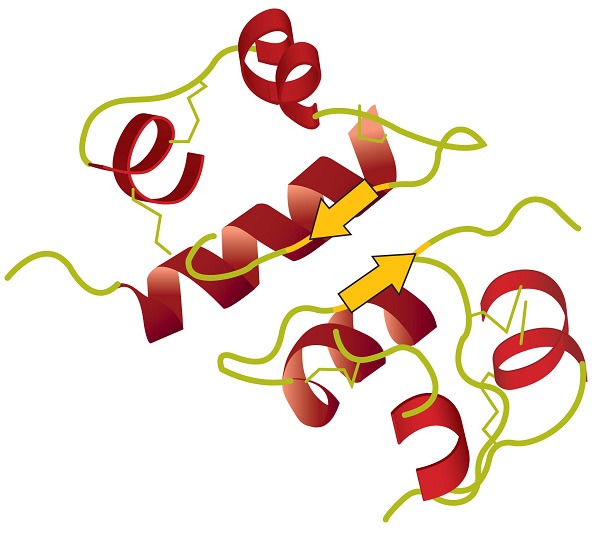
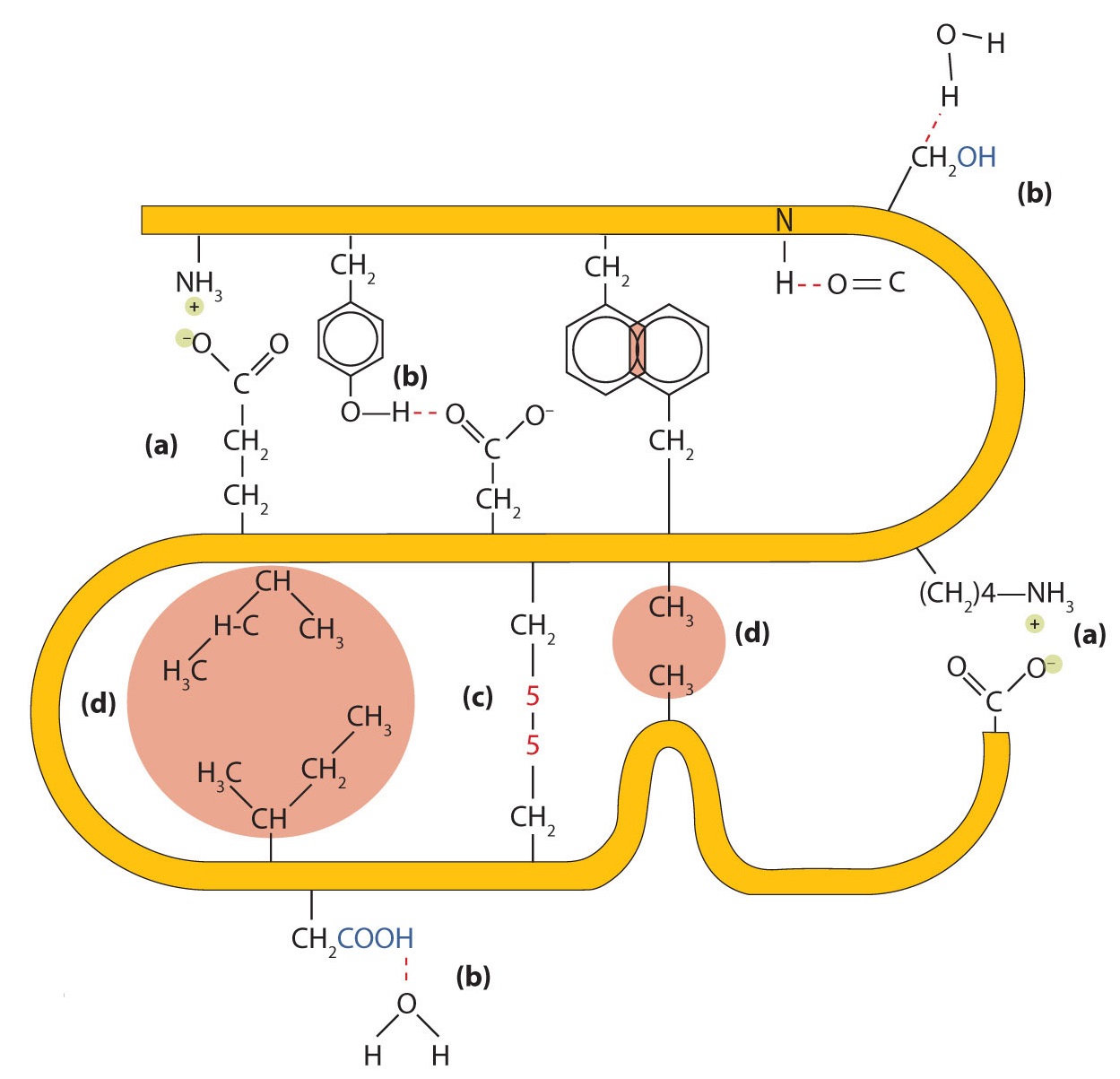
Cuatro tipos principales de interacciones atractivas determinan la forma y la estabilidad de la estructura terciaria de las proteínas. Usted estudió varios de ellos anteriormente .
- Enlace iónico . Los enlaces iónicos resultan de atracciones electrostáticas entre cadenas laterales de aminoácidos cargadas positiva y negativamente. Por ejemplo, la atracción mutua entre un ion carboxilato de ácido aspártico y un ion lisina amonio ayuda a mantener un área particular plegada de una proteína (parte (a) de la Figura ( PageIndex {5} )).
- Enlace de hidrógeno . El enlace de hidrógeno se forma entre un átomo de oxígeno altamente electronegativo o un átomo de nitrógeno y un átomo de hidrógeno unido a otro átomo de oxígeno o un átomo de nitrógeno, como los que se encuentran en las cadenas laterales de aminoácidos polares. El enlace de hidrógeno (así como las atracciones iónicas) es extremadamente importante en las interacciones intra e intermoleculares de las proteínas (parte (b) de la Figura ( PageIndex {5} )).
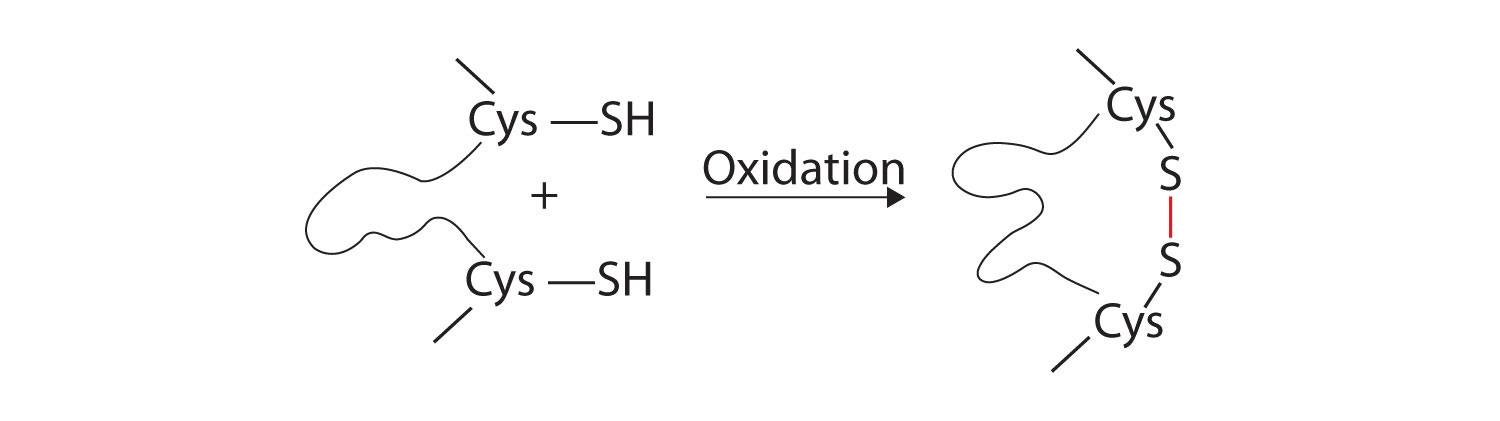
- Enlaces de disulfuro . Se pueden juntar dos unidades de aminoácidos de cisteína a medida que la molécula de proteína se pliega. La posterior oxidación y unión de los átomos de azufre en los grupos sulfhidrilo (SH) altamente reactivos conduce a la formación de cistina (parte (c) de la Figura ( PageIndex {5} )). Los enlaces disulfuro intracadena se encuentran en muchas proteínas, incluida la insulina (barras amarillas en la Figura ( PageIndex {1} )) y tienen un fuerte efecto estabilizador en la estructura terciaria.
- Fuerzas de dispersión . Las fuerzas de dispersión surgen cuando un átomo normalmente no polar se vuelve momentáneamente polar debido a una distribución desigual de electrones, lo que conduce a un dipolo instantáneo que induce un desplazamiento de electrones en un átomo no polar vecino. Las fuerzas de dispersión son débiles pero pueden ser importantes cuando faltan otros tipos de interacciones o son mínimas (parte (d) de la Figura ( PageIndex {5} )). Este es el caso de la fibroína, la proteína principal en la seda, en la que una alta proporción de aminoácidos en la proteína tiene cadenas laterales no polares. El término interacción hidrófoba a menudo se usa incorrectamente como sinónimo de fuerzas de dispersión. Las interacciones hidrofóbicas surgen porque las moléculas de agua se unen en enlaces de hidrógeno con otras moléculas de agua (o grupos en proteínas capaces de enlaces de hidrógeno). Debido a que los grupos no polares no pueden participar en enlaces de hidrógeno, la proteína se pliega de tal manera que estos grupos están enterrados en la parte interior de la estructura de la proteína, minimizando su contacto con el agua.
Cuando una proteína contiene más de una cadena de polipéptidos, cada cadena se denomina subunidad . La disposición de múltiples subunidades representa un cuarto nivel de estructura, la estructura cuaternaria de una proteína. La hemoglobina, con cuatro cadenas o subunidades de polipéptidos, es el ejemplo más frecuentemente citado de una proteína que tiene estructura cuaternaria (Figura ( PageIndex {6} )). La estructura cuaternaria de una proteína es producida y estabilizada por los mismos tipos de interacciones que producen y mantienen la estructura terciaria. Una representación esquemática de los cuatro niveles de estructura de proteínas se encuentra en la Figura ( PageIndex {7} ).
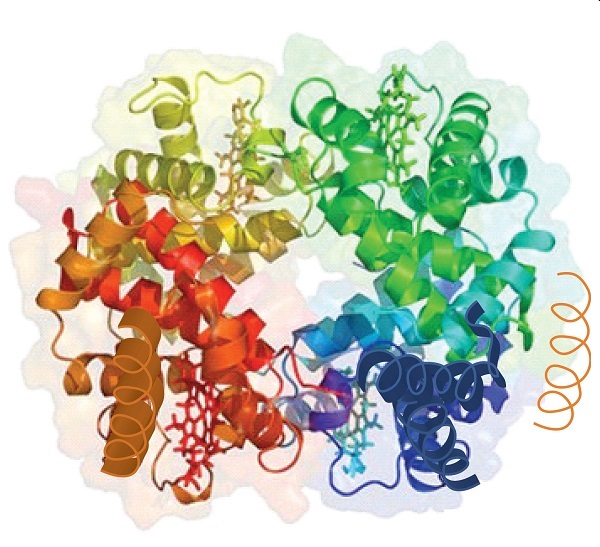
Fuente: Imagen de RCSB PDB ( www.pdb.org ) de PDB ID 1I3D (RD Kidd, HM Baker, AJ Mathews, T. Brittain, EN Baker (2001) Oligomerización y unión de ligando en una hemoglobina homotetramérica: dos estructuras cristalinas de alta resolución de la hemoglobina de Bart (gamma (4)), un marcador de alfa-talasemia. Protein Sci. 1739-1749).
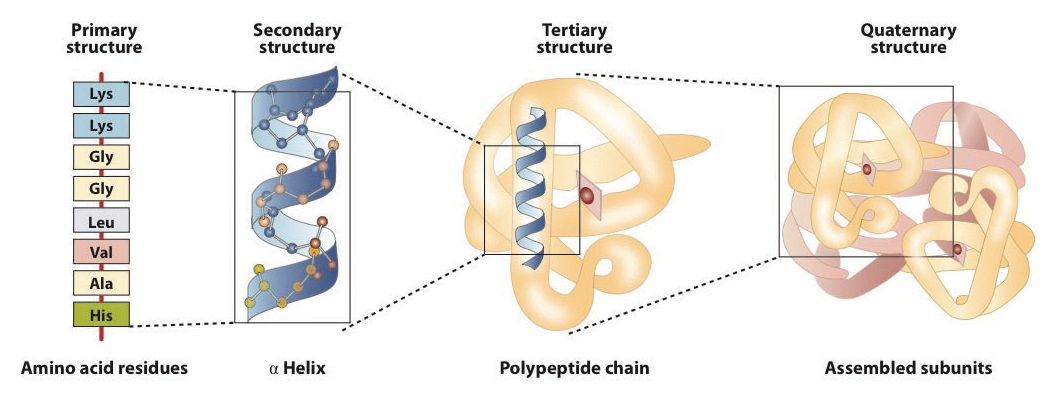
La estructura primaria consiste en la secuencia de aminoácidos específica. La cadena peptídica resultante puede retorcerse en una hélice α, que es un tipo de estructura secundaria . Este segmento helicoidal se incorpora a la estructura terciaria de la cadena de polipéptidos plegada. La cadena polipeptídica individual es una subunidad que constituye la estructura cuaternaria de una proteína, como la hemoglobina que tiene cuatro cadenas polipeptídicas.
Desnaturalización de proteínas
Las estructuras altamente organizadas de las proteínas son verdaderas obras maestras de la arquitectura química. Pero las estructuras altamente organizadas tienden a tener cierta delicadeza, y esto es cierto para las proteínas. Desnaturalización es el término utilizado para cualquier cambio en la estructura tridimensional de una proteína que la hace incapaz de realizar su función asignada. Una proteína desnaturalizada no puede hacer su trabajo. (A veces, la desnaturalización se equipara con la precipitación o la coagulación de una proteína; nuestra definición es un poco más amplia). Una amplia variedad de reactivos y condiciones, como calor, compuestos orgánicos, cambios de pH e iones de metales pesados pueden causar desnaturalización de proteínas (Figura ( PageIndex {1} )).
| Método | Efecto sobre la estructura de la proteína |
|---|---|
| Calor por encima de 50 ° C o radiación ultravioleta (UV) | El calor o la radiación UV suministra energía cinética a las moléculas de proteínas, lo que hace que sus átomos vibren más rápidamente e interrumpen las fuerzas de dispersión y los enlaces de hidrógeno relativamente débiles. |
| Uso de compuestos orgánicos, como el alcohol etílico | Estos compuestos son capaces de participar en enlaces de hidrógeno intermoleculares con moléculas de proteínas, interrumpiendo los enlaces de hidrógeno intramoleculares dentro de la proteína. |
| Sales de iones de metales pesados, como mercurio, plata y plomo | Estos iones forman fuertes enlaces con los aniones carboxilato de los aminoácidos ácidos o grupos SH de cisteína, lo que altera los enlaces iónicos y los enlaces disulfuro. |
| Reactivos alcaloides, como el ácido tánico (utilizado en el cuero curtido) | Estos reactivos se combinan con grupos amino cargados positivamente en proteínas para romper los enlaces iónicos. |
Cualquiera que haya frito un huevo ha observado desnaturalización. La clara clara de huevo se vuelve opaca a medida que la albúmina se desnaturaliza y coagula. Nadie ha revertido aún ese proceso. Sin embargo, dadas las circunstancias adecuadas y el tiempo suficiente, una proteína que se ha desplegado en condiciones suficientemente suaves puede replegarse y volver a exhibir actividad biológica (Figura ( PageIndex {8} )). Tal evidencia sugiere que, al menos para estas proteínas, la estructura primaria determina la estructura secundaria y terciaria. Una secuencia dada de aminoácidos parece adoptar su disposición tridimensional particular de forma natural si las condiciones son correctas.

Las estructuras primarias de las proteínas son bastante resistentes. En general, se necesitan condiciones bastante vigorosas para hidrolizar enlaces peptídicos. Sin embargo, en los niveles secundario a cuaternario, las proteínas son bastante vulnerables al ataque, aunque varían en su vulnerabilidad a la desnaturalización. Las proteínas globulares delicadamente dobladas son mucho más fáciles de desnaturalizar que las proteínas fibrosas y duras del cabello y la piel.
Resumen
Las proteínas se pueden dividir en dos categorías: fibrosas, que tienden a ser insolubles en agua, y globulares, que son más solubles en agua. Una proteína puede tener hasta cuatro niveles de estructura. La estructura primaria consiste en la secuencia de aminoácidos específica. La cadena peptídica resultante puede formar una hélice α o una lámina plegada β (o estructuras locales que no se clasifican tan fácilmente), lo que se conoce como estructura secundaria. Estos segmentos de estructura secundaria se incorporan a la estructura terciaria de la cadena de polipéptidos plegada. La estructura cuaternaria describe las disposiciones de las subunidades en una proteína que contiene más de una subunidad. Cuatro tipos principales de interacciones atractivas determinan la forma y la estabilidad de la proteína plegada: enlace iónico, enlace de hidrógeno, enlaces disulfuro y fuerzas de dispersión. Una amplia variedad de reactivos y condiciones pueden hacer que una proteína se desarrolle o desnaturalice.
Ejercicios de revisión del concepto
-
¿Cuál es la fuerza de atracción predominante que estabiliza la formación de estructura secundaria en proteínas?
-
Distinga entre los niveles terciario y cuaternario de la estructura de la proteína.
-
Describa brevemente cuatro formas en que una proteína podría desnaturalizarse.
Respuestas
-
-
La estructura terciaria se refiere a la forma tridimensional única de una sola cadena de polipéptidos, mientras que la estructura cuaternaria describe la interacción entre múltiples cadenas de polipéptidos para proteínas que tienen más de una cadena de polipéptidos.
-
(1) calienta una proteína por encima de 50 ° C o la expone a la radiación UV; (2) agregar solventes orgánicos, como alcohol etílico, a una solución de proteína; (3) agregue sales de iones de metales pesados, como mercurio, plata o plomo; y (4) agregar reactivos alcaloides como el ácido tánico
Ejercicios
-
Clasifique cada proteína como fibrosa o globular.
- albúmina
- miosina
- fibroína
-
Clasifique cada proteína como fibrosa o globular.
- hemoglobina
- queratina
- mioglobina
-
¿Qué nombre se le da a la estructura secundaria predominante que se encuentra en la seda?
-
¿Qué nombre se le da a la estructura secundaria predominante que se encuentra en la proteína de lana?
-
Una proteína tiene una estructura terciaria formada por interacciones entre las cadenas laterales de los siguientes pares de aminoácidos. Para cada par, identifique el tipo de interacción más fuerte entre estos aminoácidos.
- ácido aspártico y lisina
- fenilalanina y alanina
- serina y lisina
- dos cisteínas
-
Una proteína tiene una estructura terciaria formada por interacciones entre las cadenas laterales de los siguientes pares de aminoácidos. Para cada par, identifique el tipo de interacción más fuerte entre estos aminoácidos.
- valina e isoleucina
- asparagina y serina
- ácido glutámico y arginina
- triptófano y metionina
-
¿Qué nivel (s) de estructura de la proteína se interrumpen normalmente en la desnaturalización? ¿Qué nivel (es) no es (n)?
-
¿Qué clase de proteínas se desnaturaliza más fácilmente: fibrosa o globular?
Respuestas
-
- enlace iónico
- fuerzas de dispersión
- fuerzas de dispersión
- enlace disulfuro
-
La desnaturalización de proteínas altera los niveles de estructura secundaria, terciaria y cuaternaria. Solo la estructura primaria no se ve afectada por la desnaturalización.