- química orgánica – el estudio de los compuestos de carbono
- bioquímica – el estudio de la química de las especies vivas
25.2: Introducción a los hidrocarburos
- hecho solo de hidrógeno y carbono
- 4 tipos: alcanos, alquenos, alquinos e hidrocarburos aromáticos
- alcanos – solo enlaces simples
- también llamado hidrocarburos saturados
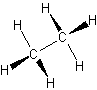
- tienen la mayor cantidad de átomos de hidrógeno unidos a un solo átomo de carbono
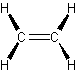
- alquenos (olefinas) – tienen dobles enlaces de carbono
-
- alquinos – enlaces triples de carbono
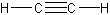
-
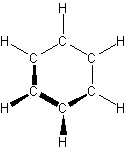
- hidrocarburos aromáticos – átomos de carbono conectados en una estructura de anillo plana, unidos por s y p enlaces entre átomos de carbono
-
- alquenos, alquinos e hidrocarburos aromáticos – hidrocarburos insaturados
- menos volátil con masa molar creciente
- muy bajo peso molecular = gas a temperatura ambiente
- peso molecular moderado = líquido
- alto peso molecular = sólido
25.3: Alcanos
- metano, gran parte del gas natural
- utilizado en calefacción doméstica, estufas de gas, calentadores de agua
- propano, la mayor parte del gas envasado
- utilizado para calentar el hogar, cocinar
- butano – utilizado en encendedores desechables, botes de combustible
- alcanos con 5-12 átomos de carbono se encuentran en la gasolina
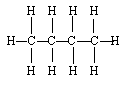
- la fórmula para alcanos se llama fórmulas estructurales condensadas
| Fórmula molecular | Fórmula estructural condensada | Nombre | Punto de ebullición (° C) |
|---|---|---|---|
| CH 4 | CH 4 | Metano | -161 |
| C 2 H 6 | CH 3 CH 3 | Etano | -89 |
| C 3 H 8 | CH 3 CH 2 CH 3 | Propano | -44 |
| C 4 H 10 | CH 3 CH 2 CH 2 CH 3 | Butano | -0,5 |
| C 5 H 12 | CH 3 CH 2 CH 2 CH 2 CH 3 | Pentano | 36 |
| C 6 H 14 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 ] | Hexano | 68 |
| C 7 H 16 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 ] CH 3 | Heptano | 98 |
| C 8 H 18 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 ] CH 2 CH 3 | Octano | 125 |
| C 9 H 20 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 ] CH 2 CH 2 CH 3 | Nonano | 151 |
| C 10 H 22 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 ] CH 2 CH 2 CH 2 CH 3 | Decano | 174 |
Estructura de Lewis
- Estructuras de alcanos
-
- geometría tetraédrica
- el enlace sencillo carbono-carbono gira fácilmente a temperatura ambiente
- las cadenas largas tienden a cambiar de forma
- Isómeros estructurales
-
- hidrocarburos de cadena recta – átomos de carbono que se unen en una cadena continua
- hidrocarburos de cadena ramificada – hidrocarburos con cadenas ramificadas, 4 o más átomos de carbono
- isómeros estructurales – compuestos con la misma fórmula molecular pero diferentes disposiciones de unión
- Nomenclatura de alcanos
-
- 1) Encuentra la cadena continua más larga de átomos de carbono y usa el nombre de esta cadena como el nombre base del compuesto.
- 2) Numere los átomos de carbono en la cadena más larga, comenzando con el final de la cadena más cercana a un sustituyente
- 3) Nombra y da la ubicación de cada grupo sustituyente
- 4) Cuando hay dos o más sustituyentes, enumérelos en orden alfabético
- Cicloalcanos
-
- alcanos que forman anillos o ciclos
- los anillos de carbono con menos de cinco átomos de carbono están filtrados
- más reactivo
- Reacciones de alcanos
-
- a temperatura ambiente los alcanos no reaccionan con ácidos, bases o agentes oxidantes fuertes
- importante por su combustión en el aire; bases para combustibles
25.4: Hidrocarburos insaturados
- Alquenos
-
- dobles enlaces de carbono
- eteno o etileno alqueno más simple
- la nomenclatura de los alquenos proviene del nombre del alcano correspondiente
- el final de –ane se cambia a –ene
- isómeros geométricos – compuestos que tienen la misma fórmula molecular y los mismos grupos unidos entre sí pero difieren en la disposición espacial de estos grupos
- los isómeros geométricos tienen propiedades físicas distintas y difieren en el comportamiento químico
- el doble enlace de carbono es resistente a la torsión
- la rotación sobre un doble enlace es un proceso clave en la química de la visión
- Alquinos
-
- uno o más enlaces triples
- el alquino más simple es el acetileno
- altamente reactivo
- nombrado cambiando la terminación del alcano (-ane) a –yne
- Reacciones de adición de alquenos y alquinos
-
- reacciones de adición – se agrega un reactivo a los dos átomos que forman el enlace múltiple
- hidrogenación – reacción entre alqueno y H 2
- Hidrocarburos aromáticos
-
- el más simple es el benceno
- proviene de la estabilización de los electrones p a través de la deslocalización en los orbitales p
- representado por un hexágono con un círculo inscrito
- reacciones de sustitución – un átomo de una molécula se elimina y se reemplaza por otro átomo o grupo de átomos
La estabilidad
25.5: Grupos funcionales
grupo funcional – sitio de reactividad en una molécula orgánica; controla cómo se comporta o funciona la molécula
- la química de una molécula orgánica está determinada por los grupos funcionales que contiene
- Alcoholes (R-OH)
- alcoholes – derivados de hidrocarburos en los que uno o más hidrógenos de un hidrocarburo original han sido reemplazados por un grupo funcional hidroxilo o alcohol
- Éteres (R-O-R ‘)
-
- éteres – dos grupos de hidrocarburos están unidos a un oxígeno
- formado a partir de dos moléculas de alcohol al dividir una molécula de agua
- reacción de condensación – reacción donde el agua se separa de dos sustancias
- usado en solventes
25.6: Compuestos con un grupo carbonilo
-
- enlaces dobles de oxígeno de carbono
- Aldehídos y cetonas
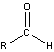
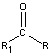
-
- el grupo carbonilo en aldehídos tiene al menos un átomo de hidrógeno unido

formaldehído
-
- el grupo carbonilo en las cetonas se produce en el interior de una cadena de carbono
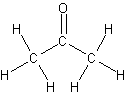
Acetona
-
- preparado por oxidación de alcoholes
- Ácidos carboxílicos
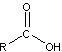
-
- los ácidos carboxílicos contienen un grupo funcional carboxilo (COOH)
- importante para la fabricación de polímeros
- producido por oxidación en la que el grupo OH está unido al CH 2
- Ésteres
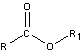
-
- ácidos carboxílicos que sufren condensación con alcoholes
- tienen olores agradables
- saponificación – hidrólisis de un éster en una base
- Aminas y amidas
-
- aminas – bases orgánicas; fórmula general R 3 N
- amidas – aninas que contienen un hidrógeno unido a nitrógeno que se condensa
25.8: Introducción a la bioquímica
- biosfera – parte de la tierra donde se forman y viven los organismos vivos
- incluye influencias en la vida de la atmósfera, aguas naturales, tierra sólida
- los organismos vivos requieren una gran cantidad de energía
- biopolímeros – tres categorías: proteínas, polisacáridos (carbohidratos) y ácidos nucleicos
25.9: Proteínas
- sustancias macromoleculares
- El 50% del peso seco del cuerpo son proteínas
- compuesto de aminoácidos
- Aminoácidos
- difieren en el grupo R
- componente básico de todas las proteínas – a -aminoácido
- forma general:

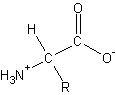
-
- quiral – cualquier molécula que contiene un carbono con cuatro grupos unidos diferentes
- enantiómeros – imagen especular de quiral
- enantiómeros y quirales tienen las mismas propiedades físicas
- difieren en la reactividad química hacia otras moléculas quirales
- Polipéptidos y proteínas
- enlace peptídico – reacción de condesación entre el grupo carboxilo de un aminoácido y el grupo amino de otro aminoácido
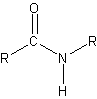
- polipéptidos – gran número de aminoácidos que están unidos por enlaces peptídicos
- las proteínas son moléculas de polipéptidos
- pesa entre 6000 y más de 50 millones de amu
- Estructura de la proteína
-
- estructura primaria – disposición de aminoácidos a lo largo de una cadena de proteínas
- hace que la proteína sea única
- estructura secundaria – la forma en que los segmentos de la cadena de proteínas se orientan en un patrón regular
- a -helix – disposición de estructura secundaria más importante y común
- propuesto por Linus Pauling y R. B. Corey
- estructura terciaria – forma general de una proteína
- proteína globular – una proteína que se pliega en una forma esférica compacta
- soluble en agua, móvil dentro de las células
- enzimas – moléculas de proteínas grandes que sirven como catalizadores
25.10: Carbohidratos
-
- escrito como C x (H 2 O) y
- glucosa el carbohidrato más abundante C 6 H 12 O 6
- no realmente hidratos de carbono sino polihidroxly aldehídos y cetonas
- Disacáridos
-
- monosacáridos – azúcares simples que no se pueden dividir en moléculas más pequeñas por hidrólisis con ácidos acuosos
- disacárido – dos monosacáridos unidos
- dos disacáridos comunes: sacarosa, lactosa
- Polisacáridos
-
- compuesto por varias unidades de monosacáridos
- almidón – grupo de polisacáridos
- almacenamiento de alimentos en semillas y tuers de plantas
- glucógeno – sustancia similar al almidón sintetizada en el cuerpo
- 5000 a más de 5 millones de amu
- banco de energía en el cuerpo; músculos e hígado
- celulosa – principal unidad estructural de plantas
- cadenas rectas de unidades de glucosa
- más de 500,000 amu
25.11: Ácidos nucleicos
- ácidos nucleicos – biopolímeros que son portadores químicos de la información genética de un organismo
- ácidos desoxirribonucleicos (ADN) – moléculas enormes con pesos molares de 6-16 millones de amu
- ácidos ribonucleicos (ARN) – moléculas más pequeñas con pesos moleculares de 20,000 a 40,000 amu
- ADN encontrado dentro del núcleo de una célula, ARN encontrado fuera del núcleo en el citoplasma
- El ADN almacena la información genética de la célula y controla la producción de proteínas
- El ARN transporta información del ADN fuera del núcleo
- Los monómeros de ácidos nucleicos (nucleótidos) tienen tres partes:
- Una molécula de ácido fosfórico, H 3 PO 4
- Un azúcar de cinco carbonos
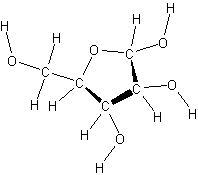
ribosa
- Una base orgánica que contiene nitrógeno
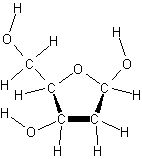
desoxirribosa
-
- la desoxirribosa tiene un átomo de oxígeno menos en el carbono 2 que la ribosa
- los ácidos nucleicos son polinucleótidos
- Moléculas de ADN formadas por dos cadenas de ADN que forman una doble hélice