Sustancias polares
Como se muestra en la Figura ( PageIndex {1} ), la molécula de agua individual consta de dos átomos de hidrógeno unidos a un átomo de oxígeno en una estructura doblada (en forma de V). Como es típico de los elementos del grupo 16, el átomo de oxígeno en cada enlace covalente O-H atrae electrones con más fuerza que el átomo de hidrógeno. En consecuencia, los núcleos de oxígeno e hidrógeno no comparten electrones por igual. En cambio, los átomos de hidrógeno son pobres en electrones en comparación con un átomo de hidrógeno neutro y tienen una carga positiva parcial, que se indica por δ + . El átomo de oxígeno, en contraste, es más rico en electrones que un átomo de oxígeno neutro, por lo que tiene una carga negativa parcial. Esta carga debe ser dos veces mayor que la carga positiva parcial en cada hidrógeno para que la molécula tenga una carga neta de cero. Por lo tanto, su carga se indica con 2δ – . Esta distribución desigual de la carga crea un enlace polar en el que una porción de la molécula lleva una carga negativa parcial, mientras que la otra porción lleva una carga positiva parcial (Figura ( PageIndex {1} )). Debido a la disposición de los enlaces polares en una molécula de agua, el agua se describe como una sustancia polar.

Debido a la distribución de carga asimétrica en la molécula de agua, las moléculas de agua adyacentes se mantienen unidas por interacciones electrostáticas atractivas (δ + … δ – ) entre el átomo de oxígeno parcialmente cargado negativamente de una molécula y los átomos de hidrógeno parcialmente cargados positivamente de moléculas adyacentes (Figura ( PageIndex {2} )). Se necesita energía para superar estas atracciones electrostáticas. De hecho, sin ellos, el agua se evaporaría a una temperatura mucho más baja, ¡y ni los océanos de la Tierra ni nosotros existiríamos!
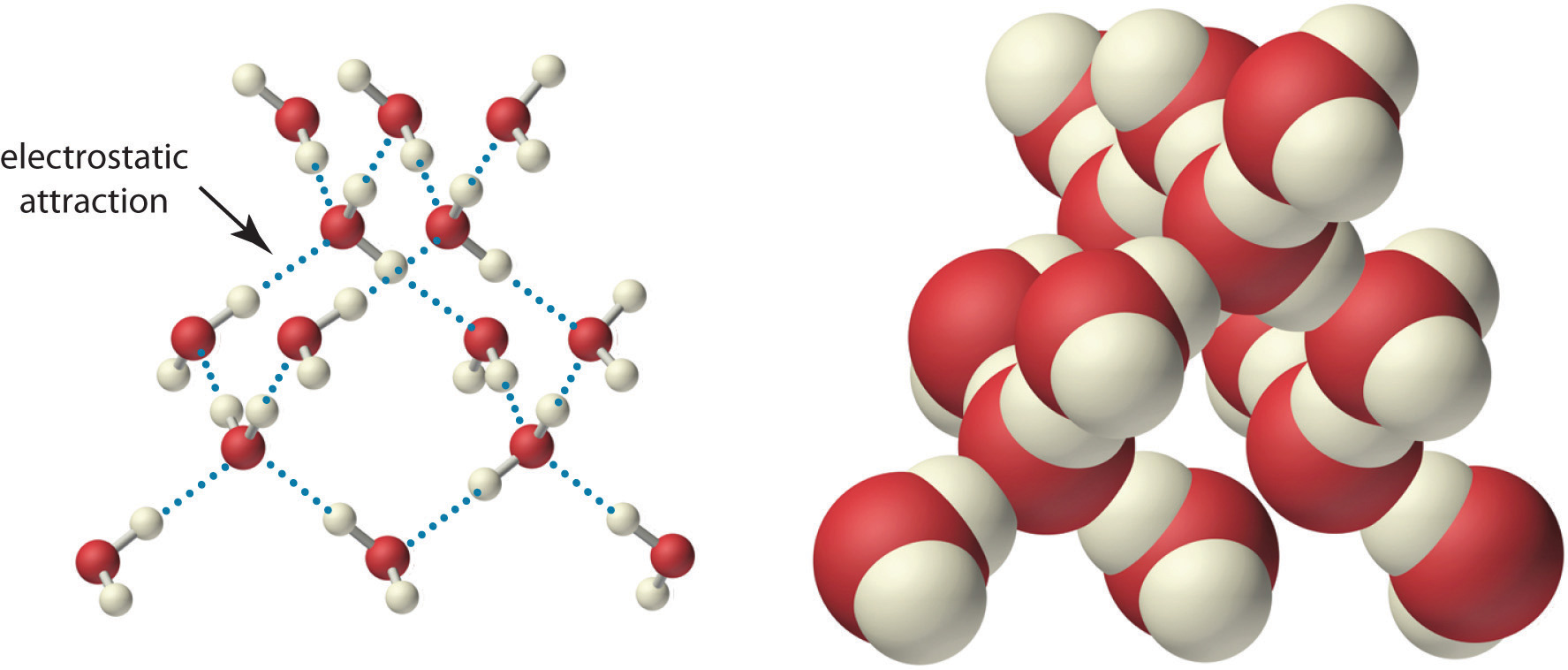
Como aprendiste anteriormente, los compuestos iónicos como el cloruro de sodio (NaCl) también se mantienen unidos mediante interacciones electrostáticas, en este caso, entre iones con carga opuesta en el sólido altamente ordenado, donde cada ión está rodeado por iones del opuesto. cargar en un arreglo fijo. A diferencia de un sólido iónico, la estructura del agua líquida no está completamente ordenada porque las interacciones entre las moléculas en un líquido se rompen y reforman constantemente.
La distribución desigual de la carga en líquidos polares como el agua los convierte en buenos disolventes para compuestos iónicos. Cuando un sólido iónico se disuelve en agua, los iones se disocian . Es decir, los átomos de oxígeno parcialmente cargados negativamente de las moléculas de H 2 O rodean los cationes (Na + en el caso de NaCl), y los átomos de hidrógeno parcialmente cargados positivamente en H [ 19459019] 2 O rodean los aniones (Cl – ; Figura ( PageIndex {3} )). Los cationes y aniones individuales que están rodeados por su propia capa de moléculas de agua se denominan iones hidratados . Podemos describir la disolución de NaCl en agua como
[NaCl (s) xrightarrow {H_2O (l)} Na ^ + (aq) + Cl ^ – (aq) label {4.1.1} ]
donde (aq) indica que Na + y Cl – son iones hidratados.
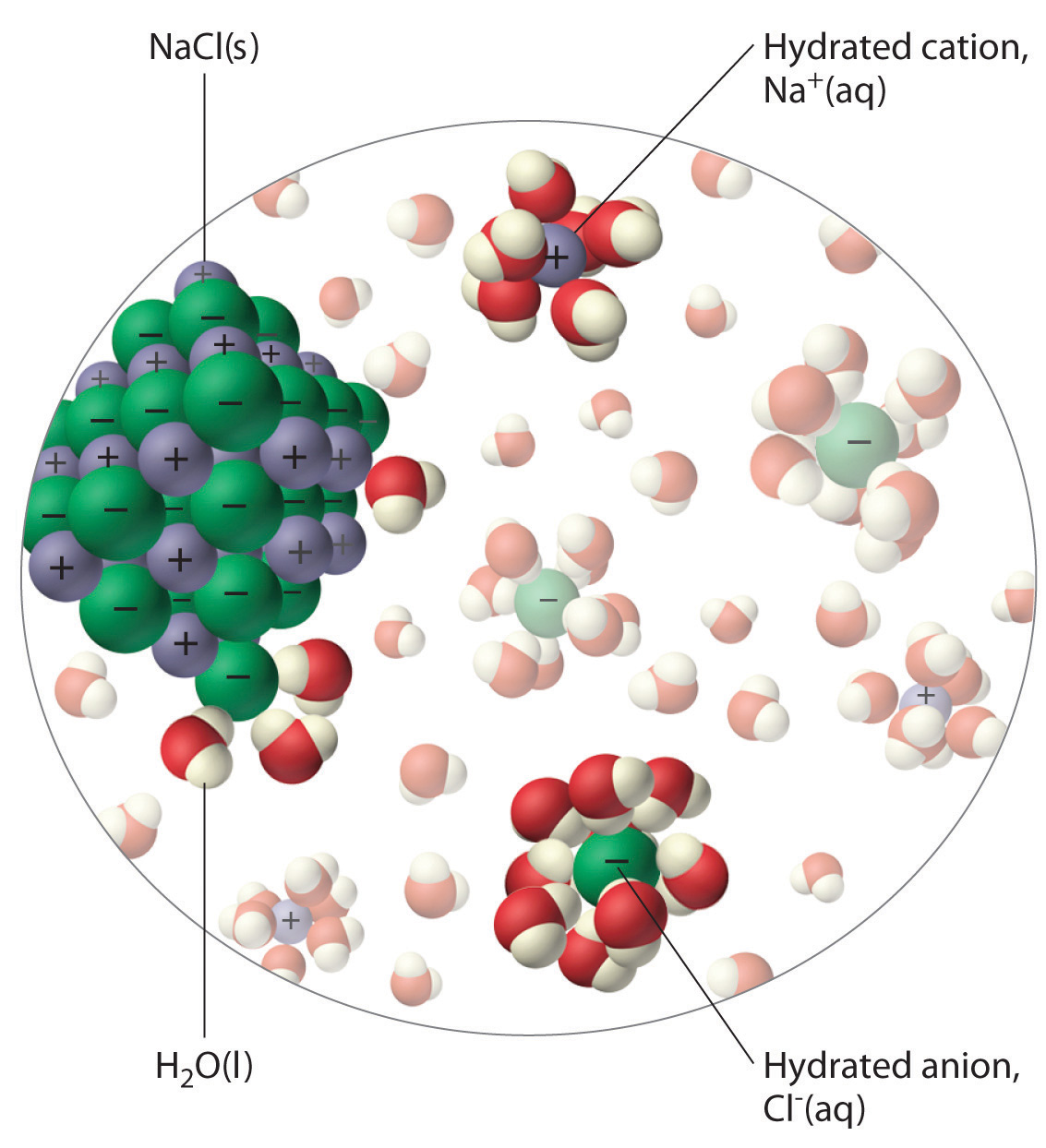
Los líquidos polares son buenos solventes para compuestos iónicos.