Hemos declarado que el cambio en la energía ( (ΔU )) es igual a la suma del calor producido y el trabajo realizado. El trabajo realizado por un gas en expansión se llama trabajo de presión-volumen , (o simplemente (PV ) trabajo ) . Considere, por ejemplo, una reacción que produce un gas, como disolver un trozo de cobre en ácido nítrico concentrado. La ecuación química para esta reacción es la siguiente:
[ ce {Cu (s) + 4HNO3 (aq) rightarrow Cu (NO3) 2 (aq) + 2H_2O (l) + 2NO2 (g)} label {5.4.1} ]
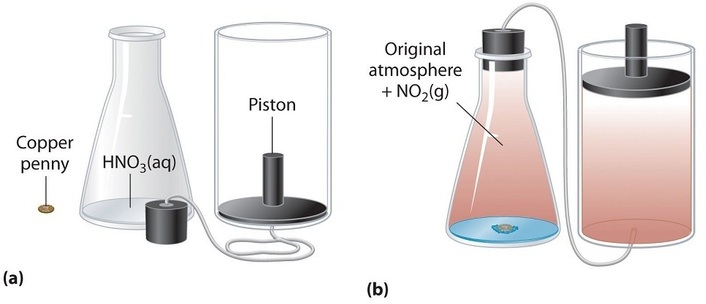
Si la reacción se lleva a cabo en un sistema cerrado que se mantiene a presión constante mediante un pistón móvil, el pistón se elevará a medida que se forme dióxido de nitrógeno (Figura ( PageIndex {1} )). El sistema realiza el trabajo levantando el pistón contra la fuerza descendente ejercida por la atmósfera (es decir, presión atmosférica ). Encontramos la cantidad de trabajo (PV ) realizado multiplicando la presión externa (P ) por el cambio en el volumen causado por el movimiento del pistón ( (ΔV )). A una presión externa constante (aquí, presión atmosférica),
[w = −PΔV label {5.4.2} ]
El signo negativo asociado con el trabajo de (PV ) realizado indica que el sistema pierde energía cuando aumenta el volumen. Si el volumen aumenta a presión constante ( (ΔV> 0 )), el trabajo realizado por el sistema es negativo, lo que indica que un sistema ha perdido energía al realizar trabajos en su entorno. Por el contrario, si el volumen disminuye ( (ΔV <0 )), el trabajo realizado por el sistema es positivo, lo que significa que los alrededores han realizado trabajos en el sistema, aumentando así su energía.
La energía interna (U ) de un sistema es la suma de la energía cinética y la energía potencial de todos sus componentes. Es el cambio en la energía interna que produce calor más trabajo. Para medir los cambios de energía que ocurren en las reacciones químicas, los químicos usualmente usan una cantidad termodinámica relacionada llamada enthalp y ( (H )) (del griego enthalpeína [19459011 ], que significa “calentar”). La entalpía de un sistema se define como la suma de su energía interna (U ) más el producto de su presión (P ) y volumen (V ):
[H = U + PV etiqueta {5.4.3} ]
Debido a que la energía interna, la presión y el volumen son funciones de estado, la entalpía también es una función de estado . Entonces podemos definir un cambio en la entalpía ( ( Delta H )) en consecuencia
[ΔH = H_ {final} – H_ {inicial} nonumber ]
Si se produce un cambio químico a presión constante (es decir, para un determinado (P ), (ΔP = 0 )), el cambio en la entalpía ( (ΔH )) es
[ begin {align} ΔH & = Δ (U + PV) \ [4pt] & = ΔU + ΔPV \ [4pt] & = ΔU + PΔV label {5.4.4} end {align } ]
Sustituyendo (q + w ) por (ΔU ) (Primera ley de la termodinámica) y (- w ) por (PΔV ) (Ecuación ( ref {5.4.2} )) en la ecuación ( ref {5.4.4} ), obtenemos
[ begin {align} ΔH & = ΔU + PΔV \ [4pt] & = q_p + cancel {w} – cancel {w} \ [4pt] & = q_p label {5.4.5 } end {align} ]
El subíndice (p ) se usa aquí para enfatizar que esta ecuación es verdadera solo para un proceso que ocurre a presión constante. De la ecuación ( ref {5.4.5} ) vemos que a presión constante el cambio en la entalpía, (ΔH ) del sistema, es igual al calor ganado o perdido.
[ begin {align} ΔH & = H_ {final} – H_ {initial} \ [4pt] & = q_p label {5.4.6} end {align} ]
Al igual que con (ΔU ), debido a que la entalpía es una función de estado, la magnitud de (ΔH ) depende solo de los estados inicial y final del sistema, no de la ruta tomada. Lo más importante, el cambio de entalpía es el mismo incluso si el proceso no ocurre a presión constante.
Para encontrar (ΔH ) para una reacción , mida (q_p ).
Cuando estudiamos los cambios de energía en las reacciones químicas, la cantidad más importante suele ser la entalpía de reacción ( (ΔH_ {rxn} )), el cambio en la entalpía que ocurre durante una reacción ( como la disolución de una pieza de cobre en ácido nítrico). Si el calor fluye de un sistema a su entorno, la entalpía del sistema disminuye, por lo que (ΔH_ {rxn} ) es negativo. Por el contrario, si el calor fluye desde los alrededores hacia un sistema, la entalpía del sistema aumenta, por lo que (ΔH_ {rxn} ) es positivo. Así:
- (ΔH_ {rxn} <0 ) para una reacción exotérmica y
- (ΔH_ {rxn}> 0 ) para una reacción endotérmica .
En las reacciones químicas, la ruptura de enlaces requiere un aporte de energía y, por lo tanto, es un proceso endotérmico, mientras que la creación de enlaces libera energía, que es un proceso exotérmico. Las convenciones de signos para el flujo de calor y los cambios de entalpía se resumen en la siguiente tabla:
| Tipo de reacción | q | ΔH rxn |
|---|---|---|
| exotérmico | <0 | <0 (el calor fluye de un sistema a su entorno) |
| endotérmico | > 0 | > 0 (el calor fluye desde los alrededores a un sistema) |
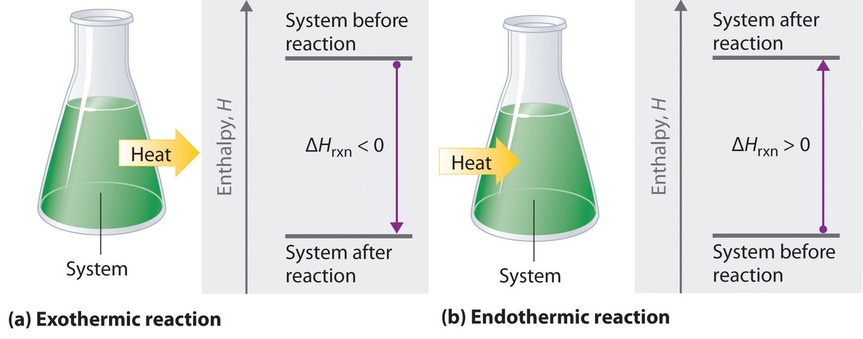
Si Δ H rxn es negativo, entonces la entalpía de los productos es menor que la entalpía de los reactivos; es decir, una reacción exotérmica es enérgicamente cuesta abajo (Figura ( PageIndex {2} a )). Por el contrario, si Δ H rxn es positivo, entonces la entalpía de los productos es mayor que la entalpía de los reactivos; así, una reacción endotérmica es energéticamente cuesta arriba (Figura ( PageIndex {2b} )). En la siguiente discusión se resumen dos características importantes de la entalpía y los cambios en la entalpía.
La ruptura de enlaces SIEMPRE requiere un aporte de energía; creación de enlaces SIEMPRE libera energía.
-
Revertir una reacción o un proceso cambia el signo de Δ H . El hielo absorbe calor cuando se derrite (las interacciones electrostáticas se rompen), por lo que el agua líquida libera calor cuando se congela (se forman interacciones electrostáticas):
( begin {matrix}
calor + H_ {2} O (s) rightarrow H_ {2} O (l) & Delta H> 0
end {matrix} label {5.4.7} )( begin {matrix}
H_ {2} O (l) rightarrow H_ {2} O (s) + calor & Delta H <0
end {matrix} label {5.4.8} )En ambos casos, la magnitud del cambio de entalpía es la misma; solo el signo es diferente.
-
La entalpía es una propiedad extensa (como la masa). La magnitud de Δ H para una reacción es proporcional a las cantidades de las sustancias que reaccionan. Por ejemplo, un gran incendio produce más calor que un solo fósforo, a pesar de que la reacción química (la combustión de la madera) es la misma en ambos casos. Por esta razón, el cambio de entalpía para una reacción generalmente se da en kilojulios por mol de un reactivo o producto particular. Considere la ecuación ( ref {5.4.9} ), que describe la reacción del aluminio con óxido de hierro (III) (Fe 2 O 3 ) a presión constante. De acuerdo con la estequiometría de reacción, se producen 2 mol de Fe, 1 mol de Al 2 O 3 , y se producen 851,5 kJ de calor por cada 2 mol de Al y 1 mol de Fe [ 19459018] 2 O 3 consumido:
[2Al left (s right) + Fe_ {2} O_ {3} left (s right) rightarrow 2Fe left (s right) + Al_ {2} O_ {3} left (s right) + 815.5 ; kJ label {5.4.9} ]
Así Δ H = −851.5 kJ / mol de Fe 2 O 3 . También podemos describir Δ H para la reacción como −425.8 kJ / mol de Al: como se consumen 2 mol de Al en la ecuación química equilibrada, dividimos −851.5 kJ por 2. Cuando un valor para Δ H , en kilojulios en lugar de kilojulios por mol, se escribe después de la reacción, como en la Ecuación ( ref {5.4.10} ), es el valor de Δ H correspondiente a la reacción de las cantidades molares de reactivos como se da en la ecuación química equilibrada:
[2Al left (s right) + Fe_ {2} O_ {3} left (s right) rightarrow 2Fe left (s right) + Al_ {2} O_ {3} left (s right) ; ; ; ; Delta H_ {rxn} = – 851.5 ; kJ label {5.4.10} ]
Si reaccionan 4 mol de Al y 2 mol de Fe 2 O 3 , el cambio en la entalpía es 2 × (−851.5 kJ) = −1703 kJ. Podemos resumir la relación entre la cantidad de cada sustancia y el cambio de entalpía para esta reacción de la siguiente manera:
[- dfrac {851.5 ; kJ} {2 ; mol ; Al} = – dfrac {425.8 ; kJ} {1 ; mol ; Al} = – dfrac {1703 ; kJ} {4 ; mol ; Al} label {5.4.6a} ]
La relación entre la magnitud del cambio de entalpía y la masa de reactivos se ilustra en el Ejemplo ( PageIndex {1} ).
Entalpías de reacción
Una forma de informar el calor absorbido o liberado sería compilar un conjunto masivo de tablas de referencia que enumeren los cambios de entalpía para todas las posibles reacciones químicas, lo que requeriría una increíble cantidad de esfuerzo. Afortunadamente, dado que la entalpía es una función de estado, todo lo que tenemos que saber es el estado inicial y final de la reacción. Esto nos permite calcular el cambio de entalpía para prácticamente cualquier reacción química concebible utilizando un conjunto relativamente pequeño de datos tabulados, como los siguientes:
- Entalpía de combustión (ΔH peine ) El cambio en la entalpía que ocurre durante una reacción de combustión. Los cambios de entalpía se han medido para la combustión de prácticamente cualquier sustancia que se queme en oxígeno; estos valores generalmente se informan como la entalpía de combustión por mol de sustancia.
- Entalpía de fusión (ΔH fus ) El cambio de entalpía que acompaña a la fusión (fusión) de 1 mol de una sustancia. El cambio de entalpía que acompaña a la fusión o fusión de 1 mol de una sustancia; Estos valores se han medido para casi todos los elementos y para la mayoría de los compuestos simples.
- Entalpía de vaporización (ΔH vap ) El cambio de entalpía que acompaña a la vaporización de 1 mol de una sustancia. El cambio de entalpía que acompaña a la vaporización de 1 mol de una sustancia; Estos valores también se han medido para casi todos los elementos y para la mayoría de los compuestos volátiles.
- Entalpía de solución (ΔH soln ) El cambio en la entalpía que ocurre cuando una cantidad específica de soluto se disuelve en una cantidad dada de solvente. La entalpía cambia cuando una cantidad específica de soluto se disuelve en una cantidad dada de solvente.
| Sustancia | ΔH vap (kJ / mol) | ΔH fus (kJ / mol) |
|---|---|---|
| argón (Ar) | 6,3 | 1.3 |
| metano (CH 4 ) | 9,2 | 0,84 |
| etanol (CH 3 CH 2 OH) | 39,3 | 7,6 |
| benceno (C 6 H 6 ) | 31,0 | 10,9 |
| agua (H 2 O) | 40,7 | 6,0 |
| mercurio (Hg) | 59,0 | 2,29 |
| hierro (Fe) | 340 | 14 |
Resumen
Para una reacción química, la entalpía de reacción ( (ΔH_ {rxn} )) es la diferencia en la entalpía entre productos y reactivos; Las unidades de (ΔH_ {rxn} ) son kilojulios por mol. Revertir una reacción química invierte el signo de (ΔH_ {rxn} ).
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )