Debido a que la entalpía es una función de estado, el cambio de entalpía para una reacción depende solo de dos cosas: (1) las masas de las sustancias que reaccionan y (2) los estados físicos de los reactivos y productos. No depende de la ruta por la cual los reactivos se convierten en productos. Si subió una montaña, por ejemplo, el cambio de altitud no dependerá de si subió todo el camino sin detenerse o si se detuvo muchas veces para tomar un descanso. Si se detuvo a menudo, el cambio general en la altitud sería la suma de los cambios en la altitud para cada tramo corto escalado. De manera similar, cuando agregamos dos o más ecuaciones químicas equilibradas para obtener una ecuación química neta, ΔH para la reacción neta es la suma de los valores de ΔH para las reacciones individuales. Este principio se llama la ley de Hess , en honor al químico ruso nacido en Suiza Germain Hess (1802-1850), pionero en el estudio de la termoquímica. La ley de Hess nos permite calcular los valores de ΔH para reacciones que son difíciles de llevar a cabo directamente al sumar los valores de ΔH conocidos para los pasos individuales que dan la reacción general, a pesar de que la reacción general puede no ocurrir realmente a través de esos pasos.
La Ley de Hess argumenta que ΔH para la reacción neta es la suma de los valores de ΔH para las reacciones individuales. Esto no es más que argumentar que ΔH es una función de estado.
Podemos ilustrar la ley de Hess usando la reacción de termita. La reacción general que se muestra en la Ecuación ( ref {5.6.1} ) puede verse como ocurrida en tres pasos distintos con valores de ΔH conocidos. Como se muestra en la figura 5.6.1, la primera reacción produce 1 mol de óxido de aluminio sólido (Al 2 O 3 ) y 2 mol de hierro líquido en su punto de fusión de 1758 ° C (parte (a) en la ecuación ( ref {5.6.1} )); El cambio de entalpía para esta reacción es -732.5 kJ / mol de Fe 2 O 3 . La segunda reacción es la conversión de 2 mol de hierro líquido a 1758 ° C en 2 mol de hierro sólido a 1758 ° C (parte (b) en la ecuación 5.6.1); El cambio de entalpía para esta reacción es −13.8 kJ / mol de Fe (−27.6 kJ por 2 mol de Fe). En la tercera reacción, 2 mol de hierro sólido a 1758 ° C se convierten en 2 mol de hierro sólido a 25 ° C (parte (c) en la Ecuación ( ref {5.6.1} )); El cambio de entalpía para esta reacción es -45.5 kJ / mol de Fe (-91.0 kJ por 2 mol de Fe). Como puede ver en la Figura 5.6.1, la reacción general viene dada por la flecha más larga (que se muestra a la izquierda), que es la suma de las tres flechas más cortas (que se muestra a la derecha). Al agregar las partes (a), (b) y (c) en la Ecuación 5.6.1 se obtiene la reacción general, que se muestra en la parte (d):
[ small begin {matrix}
2Al left (s, ; 25 ^ {o} C right) + 2Fe_ {2} O_ {3} left (s, ; 25 ^ {o} C right) & rightarrow & 2Fe left ( l, ; 1758 ^ {o} C right) + 2Al_ {2} O_ {3} left (s, ; 1758 ^ {o} C right) & Delta H = -732.5 ; kJ & left (a right) \
2Fe left (l, ; 1758 ^ {o} C right) & rightarrow & 2Fe left (s, ; 1758 ^ {o} C right) & Delta H = – ; ; 27,6 ; kJ & left (b right) \
2Fe left (s, ; 1758 ^ {o} C right) + 2Al_ {2} O_ {3} left (s, ; 1758 ^ {o} C right) & rightarrow & 2Fe left ( l, ; 25 ^ {o} C right) + 2Al_ {2} O_ {3} left (s, ; 25 ^ {o} C right) & Delta H = – ; ; 91.0 ; kJ & left (c right) \
2Al left (s, ; 25 ^ {o} C right) + 2Fe_ {2} O_ {3} left (s, ; 25 ^ {o} C right) & rightarrow & 2Al_ {2} O_ {3} left (s, ; 25 ^ {o} C right) + 2Fe left (s, ; 25 ^ {o} C right) & Delta H = -851.1 ; kJ & left (d right)
end {matrix} label {5.6.1} ]
La reacción neta en la parte (d) en la ecuación ( ref {5.6.1} ) es idéntica a la ecuación para la reacción de termita que vimos en una sección anterior. Según la ley de Hess, el cambio de entalpía para la parte (d) es la suma de los cambios de entalpía para las partes (a), (b) y (c). En esencia, la ley de Hess nos permite calcular el cambio de entalpía para la suma de una serie de reacciones sin tener que dibujar un diagrama como ese en la Figura ( PageIndex {1} ).
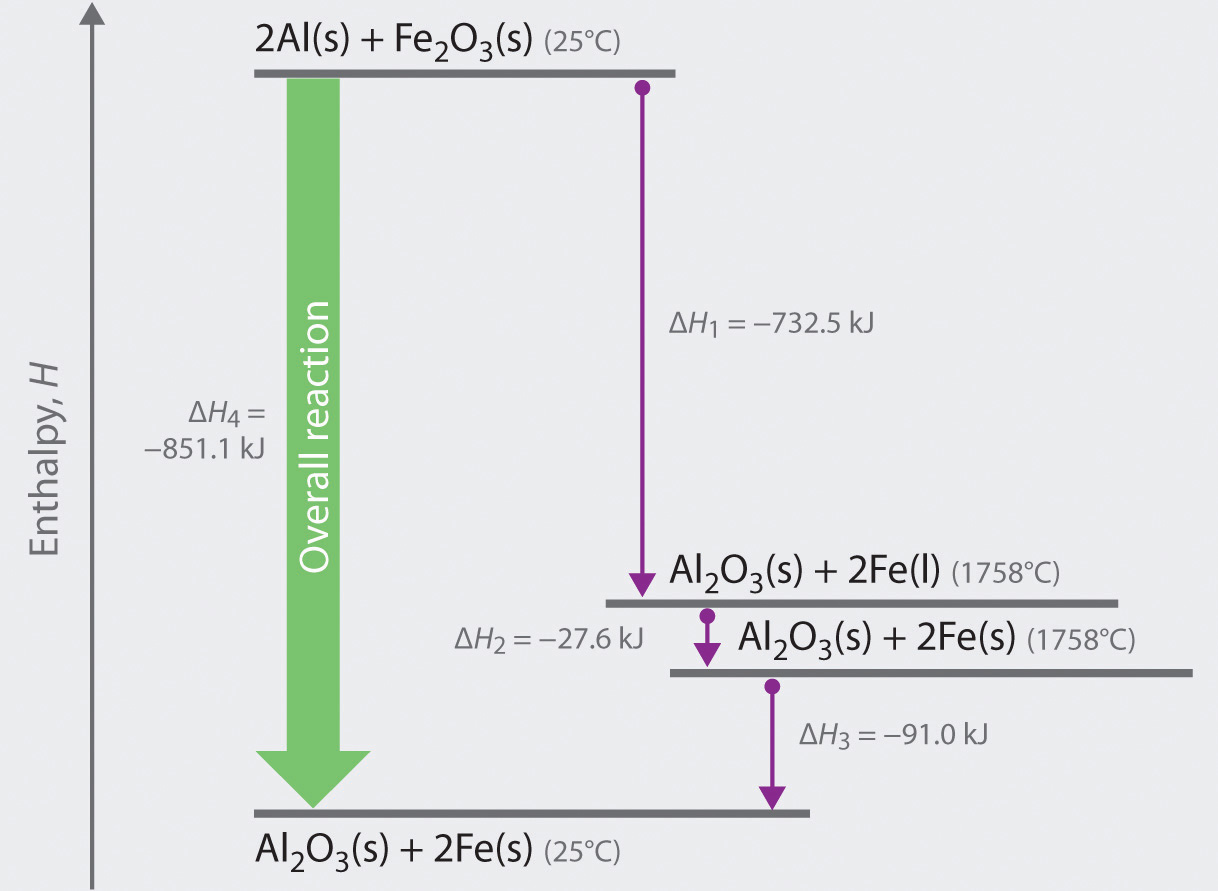
La comparación de las partes (a) y (d) en la ecuación ( ref {5.6.1} ) también ilustra un punto importante: la magnitud de ΔH para una reacción depende de los estados físicos de los reactivos y los productos ( gas, líquido, sólido o solución). Cuando el producto es hierro líquido en su punto de fusión (parte (a) en la Ecuación ( ref {5.6.1} )), solo se liberan 732.5 kJ de calor a los alrededores en comparación con 852 kJ cuando el producto es hierro sólido a 25 ° C (parte (d) en la ecuación ( ref {5.6.1} )). La diferencia, 120 kJ, es la cantidad de energía que se libera cuando 2 mol de hierro líquido se solidifica y se enfría a 25 ° C. Es importante especificar el estado físico de todos los reactivos y productos al escribir una ecuación termoquímica.
Cuando use la ley de Hess para calcular el valor de ΔH para una reacción, siga este procedimiento:
- Identifique la ecuación cuyo valor de ΔH es desconocido y escriba reacciones individuales con valores de ΔH conocidos que, cuando se sumen, darán la ecuación deseada. Ilustramos cómo usar este procedimiento en el Ejemplo ( PageIndex {1} ).
- Organice las ecuaciones químicas de modo que la reacción de interés sea la suma de las reacciones individuales.
- Si se debe revertir una reacción, cambie el signo de ΔH para esa reacción. Además, si una reacción debe multiplicarse por un factor para obtener el número correcto de moles de una sustancia, multiplique su valor ΔH por ese mismo factor.
- Sume las reacciones individuales y sus valores de ΔH correspondientes para obtener la reacción de interés y la ΔH desconocida.
Resumen
La ley de Hess está argumentando que el cambio general de entalpía para una serie de reacciones es la suma de los cambios de entalpía para las reacciones individuales. Para una reacción química, la entalpía de reacción (Δ H rxn ) es la diferencia en la entalpía entre productos y reactivos ; las unidades de ΔH rxn son kilojulios por mol. Revertir una reacción química invierte el signo de ΔH rxn . La magnitud de ΔH rxn también depende del estado físico de los reactivos y los productos porque los procesos como la fusión de sólidos o líquidos de vaporización también van acompañados de cambios de entalpía: la entalpía de fusión (Δ ] H fus ) y la entalpía de vaporización (Δ H vap [ 19459030]) , respectivamente. El cambio general de entalpía para una serie de reacciones es la suma de los cambios de entalpía para las reacciones individuales, que es la ley de Hess . La entalpía de combustión (Δ H peine ) es el cambio de entalpía que ocurre cuando una sustancia se quema en exceso de oxígeno.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )