Para un átomo o un ion con un solo electrón, podemos calcular la energía potencial considerando solo la atracción electrostática entre el núcleo con carga positiva y el electrón con carga negativa. Sin embargo, cuando hay más de un electrón presente, la energía total del átomo o del ion depende no solo de las atractivas interacciones electrón-núcleo sino también de las interacciones repulsivas electrón-electrón. Cuando hay dos electrones, las interacciones repulsivas dependen de las posiciones de ambos electrones en un instante dado, pero debido a que no podemos especificar las posiciones exactas de los electrones, es imposible calcular exactamente las interacciones repulsivas. En consecuencia, debemos usar métodos aproximados para tratar el efecto de las repulsiones electrón-electrón en las energías orbitales. Estos efectos son la base subyacente de las tendencias periódicas en las propiedades elementales que exploraremos en este capítulo.
Blindaje de electrones y carga nuclear efectiva
Si un electrón está lejos del núcleo (es decir, si la distancia (r ) entre el núcleo y el electrón es grande), en cualquier momento dado, muchos de los otros electrones estarán entre entre [ 19459011] ese electrón y el núcleo (Figura ( PageIndex {1} )). Por lo tanto, los electrones cancelarán una parte de la carga positiva del núcleo y, por lo tanto, disminuirán la interacción atractiva entre él y el electrón más lejos. Como resultado, el electrón más alejado experimenta una carga nuclear efectiva ( (Z_ {eff} )) que es menor que la carga nuclear real (Z ). Este efecto se llama blindaje de electrones .

A medida que la distancia entre un electrón y el núcleo se aproxima al infinito, (Z_ {eff} ) se aproxima a un valor de 1 porque todos los otros electrones ( (Z – 1 )) en el átomo neutro están, en el promedio, entre él y el núcleo. Si, por otro lado, un electrón está muy cerca del núcleo, entonces, en cualquier momento dado, la mayoría de los otros electrones están más lejos del núcleo y no protegen la carga nuclear. En (r ≈ 0 ), la carga positiva experimentada por un electrón es aproximadamente la carga nuclear completa, o (Z_ {eff} ≈ Z ). A valores intermedios de (r ), la carga nuclear efectiva se encuentra entre 1 y (Z ):
[1 ≤ Z_ {eff} ≤ Z. ]
Observe que (Z_ {eff} = Z ) solo para hidrógeno y solo para helio son (Z_ {eff} ) y (Z ) de magnitud comparable (Figura ( PageIndex {2} )).
(Z_ {eff} ) puede calcularse restando la magnitud del blindaje de la carga nuclear total y la carga nuclear efectiva de un átomo viene dada por la ecuación:
[Z_ {eff} = Z-S label {4} ]
donde (Z ) es el número atómico (número de protones en el núcleo) y (S ) es la constante de blindaje. El valor de (Z_ {eff} ) proporcionará información sobre la carga que realmente experimenta un electrón.
Podemos ver en la ecuación ref {4} que la carga nuclear efectiva de un átomo aumenta a medida que aumenta el número de protones en un átomo (Figura ( PageIndex {2} )). Por lo tanto, a medida que avanzamos de izquierda a derecha en la tabla periódica, la carga nuclear efectiva de un átomo aumenta en fuerza y mantiene los electrones externos más cerca y más apretados del núcleo. Como discutiremos más adelante en el capítulo, este fenómeno puede explicar la disminución en los radios atómicos que vemos a medida que avanzamos a través de la tabla periódica a medida que los electrones se mantienen más cerca del núcleo debido al aumento en el número de protones y el aumento en la carga nuclear efectiva.

La constante de blindaje se puede estimar sumando la detección en todos los electrones ( (n )) excepto el en cuestión.
[S = sum_ {i} ^ {n-1} S_i label {2.6.0} ]
donde (S_i ) es el blindaje del electrón i th .
Los electrones que están protegidos de la carga completa del núcleo experimentan una carga nuclear efectiva ( (Z_ {eff} )) del núcleo, que es un grado menor que la carga nuclear completa el electrón se sentiría en un átomo de hidrógeno o en un ion similar al hidrógeno.
De las ecuaciones ref {4} y ref {2.6.0}, (Z_ {eff} ) para un electrón específico se puede estimar si se conocen las constantes de protección para ese electrón de todos los demás electrones de las especies. Una aproximación simple es que todos los demás electrones se protegen igual y completamente:
[S_i = 1 label {simple} ]
Esta aproximación cruda se demuestra en el Ejemplo ( PageIndex {1} ).
Penetración de electrones
La aproximación en la ecuación ref {simple} es una buena descripción de primer orden del blindaje de electrones, pero el (Z_ {eff} ) real experimentado por un electrón en un orbital dado depende no solo de la distribución espacial del electrón en ese orbital pero también en la distribución de todos los otros electrones presentes. Esto conduce a grandes diferencias en (Z_ {eff} ) para diferentes elementos, como se muestra en la Figura ( PageIndex {2} ) para los elementos de las primeras tres filas de la tabla periódica.
La penetración describe la proximidad a la que un electrón puede acercarse al núcleo. En un sistema de múltiples electrones, la penetración de electrones se define por la densidad relativa de electrones de un electrón (densidad de probabilidad) cerca del núcleo de un átomo (Figura ( PageIndex {3} )). Los electrones en diferentes orbitales tienen diferentes densidades de electrones alrededor del núcleo. En otras palabras, la penetración depende del shell ( (n )) y del subshell ( (l )).
Por ejemplo, un electrón 1s (Figura ( PageIndex {3} ); curva púrpura) tiene mayor densidad de electrones cerca del núcleo que un electrón 2p (Figura ( PageIndex {3} ); curva roja) y tiene una mayor penetración. Esto se relacionó con las constantes de protección ya que los electrones 1s están más cerca del núcleo que un electrón 2p, por lo tanto, el 1s detecta un electrón 2p casi perfectamente ( (S = 1 ). Sin embargo, el electrón 2s tiene una constante de protección más baja ( (S <1 ) porque puede penetrar cerca del núcleo en el área pequeña de densidad de electrones dentro del primer nodo esférico (Figura ( PageIndex {3} ); curva verde). De esta manera, el electrón 2s puede " evitar "algunos de los efectos de blindaje del electrón interno de 1s.
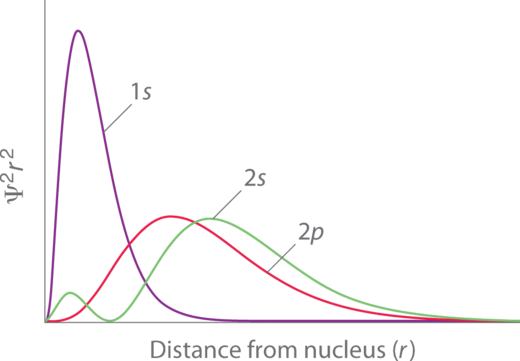
Para el mismo valor de capa ( (n )), el poder de penetración de un electrón sigue esta tendencia en subcapas (Figura ( PageIndex {3} )):
[s> p> d aprox. F. label {better1} ]
para diferentes valores de shell (n) y subshell (l), el poder de penetración de un electrón sigue esta tendencia:
[ ce {1s> 2s> 2p> 3s> 3p> 4s> 3d> 4p> 5s> 4d> 5p> 6s> 4f …} label {better2} ]
| Átomo | Subnivel | Z | Z ef |
|---|---|---|---|
| H | 1s | 1 | 1 |
| Él | 1s | 2 | 1,69 |
| Li | 1s, 2s | 3 | 2,69, 1,28 |
| Sé | 1s, 2s | 4 | 3.68, 1.91 |
| B | 1s, 2s, 2p | 5 | 4.68, 2.58, 2.42 |
| F | 1s, 2s, 2p | 9 | 8.65, 5.13, 5.10 |
| Na | 1s, 2s, 2p, 3s | 11 | 10.63, 6.57, 6.80, 2.51 |
Datos de E. Clementi y D. L. Raimondi; The Journal of Chemical Physics 38, 2686 (1963).
Debido a los efectos del blindaje y las diferentes distribuciones radiales de orbitales con el mismo valor de n pero diferentes valores de l , las diferentes subcapas no se degeneran en un átomo multielectrónico . Para un valor dado de n , el orbital ns siempre es más bajo en energía que los orbitales np , que son más bajos en energía que el nd [ 19459011] orbitales, y así sucesivamente. Como resultado, algunas subcapas con números cuánticos principales más altos son en realidad más bajas en energía que las subcapas con un valor más bajo de n ; por ejemplo, el orbital 4 s es más bajo en energía que los orbitales 3 d para la mayoría de los átomos.
Resumen
El cálculo de las energías orbitales en átomos o iones con más de un electrón (átomos o iones multielectrónicos) se complica por las interacciones repulsivas entre los electrones. El concepto de blindaje de electrones , en el que los electrones que intervienen actúan para reducir la carga nuclear positiva experimentada por un electrón, permite el uso de orbitales similares al hidrógeno y una carga nuclear efectiva ( ( Z_ {eff} )) para describir distribuciones de electrones en átomos o iones más complejos. El grado en que los orbitales con diferentes valores de l y el mismo valor de n se superponen o penetran en los depósitos internos llenos resulta en energías ligeramente diferentes para diferentes subcapas en el mismo caparazón principal en la mayoría de los átomos .