Aunque algunas personas caen en la trampa de visualizar átomos e iones como esferas pequeñas y duras similares a pelotas de tenis de mesa en miniatura o canicas, el modelo de mecánica cuántica nos dice que sus formas y límites son mucho menos definidos de lo que sugieren esas imágenes. Como resultado, no se puede decir que los átomos e iones tengan tamaños exactos; sin embargo, algunos átomos son más grandes o más pequeños que otros, y esto influye en su química. En esta sección, discutimos cómo se definen y obtienen los “tamaños” atómicos e iónicos.
Radios atómicos
Recuerde que la probabilidad de encontrar un electrón en los diversos orbitales disponibles disminuye lentamente a medida que aumenta la distancia desde el núcleo. Este punto se ilustra en la Figura ( PageIndex {1} ) que muestra una gráfica de la densidad total de electrones para todos los orbitales ocupados para tres gases nobles en función de su distancia del núcleo. La densidad de electrones disminuye gradualmente con el aumento de la distancia, lo que hace que sea imposible dibujar una línea nítida que marque el límite de un átomo.
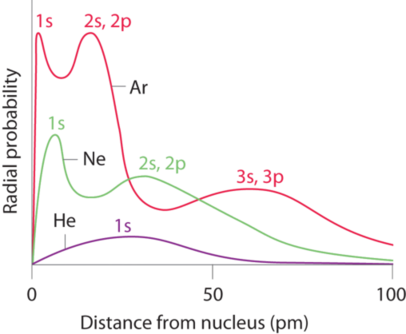
La Figura ( PageIndex {1} ) también muestra que hay picos distintos en la densidad total de electrones a distancias particulares y que estos picos ocurren a diferentes distancias del núcleo para cada elemento. Cada pico en una gráfica dada corresponde a la densidad de electrones en una capa principal dada. Debido a que el helio tiene solo una cubierta llena ( n = 1), muestra solo un pico. En contraste, el neón, con relleno n = 1 y 2 capas principales, tiene dos picos. El argón, con n lleno = 1, 2 y 3 capas principales, tiene tres picos. El pico para el relleno n = 1 capa ocurre a distancias sucesivamente más cortas para neón ( Z = 10) y argón ( Z = 18) porque, con un mayor número de protones, sus núcleos están más cargados positivamente que el del helio. Debido a que la capa 1 s 2 está más cerca del núcleo, sus electrones están muy mal protegidos por los electrones en capas llenas con valores mayores de n . En consecuencia, los dos electrones en la capa n = 1 experimentan casi la carga nuclear completa, lo que resulta en una fuerte interacción electrostática entre los electrones y el núcleo. La energía del n = 1 caparazón también disminuye enormemente (el orbital 1 s lleno se vuelve más estable) a medida que aumenta la carga nuclear. Por razones similares, el relleno n = 2 en argón se encuentra más cerca del núcleo y tiene una energía menor que el n = 2 en neón.
La figura ( PageIndex {1} ) ilustra la dificultad de medir las dimensiones de un átomo individual. Sin embargo, debido a que las distancias entre los núcleos en pares de átomos unidos covalentemente se pueden medir con bastante precisión, los químicos usan estas distancias como base para describir los tamaños aproximados de los átomos. Por ejemplo, se sabe que la distancia internuclear en la molécula diatómica Cl 2 es 198 pm. Asignamos la mitad de esta distancia a cada átomo de cloro, dando al cloro un radioma atómico covalente us ( (r_ {cov} )), que es la mitad la distancia entre los núcleos de dos átomos similares unidos por un enlace covalente en la misma molécula, de 99 pm o 0.99 Å (Figura ( PageIndex {2a} )). Los radios atómicos a menudo se miden en angstroms (Å), una unidad que no es del SI: 1 Å = 1 × 10 −10 m = 100 pm.
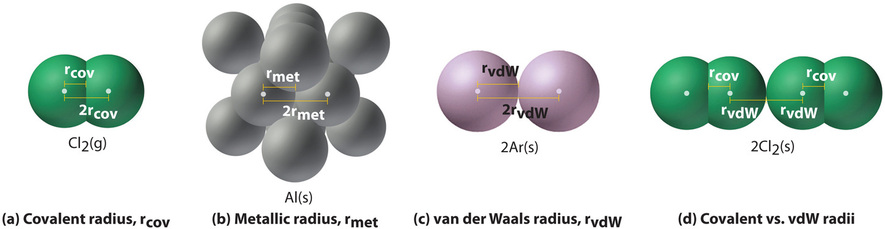
En un enfoque similar, podemos usar las longitudes de enlaces simples carbono-carbono en compuestos orgánicos, que son notablemente uniformes a las 154 pm, para asignar un valor de 77 pm como el radio atómico covalente para el carbono. Si estos valores reflejan los tamaños reales de los átomos, entonces deberíamos poder predecir las longitudes de los enlaces covalentes formados entre los diferentes elementos agregándolos. Por ejemplo, predeciríamos una distancia de carbono-cloro de 77 pm + 99 pm = 176 pm para un enlace C-Cl, que está muy cerca del valor promedio observado en muchos compuestos organoclorados. Un enfoque similar para medir el tamaño de los iones se discute más adelante en esta sección.
Los radios atómicos covalentes se pueden determinar para la mayoría de los no metales, pero ¿cómo obtienen los químicos radios atómicos para los elementos que no forman enlaces covalentes? Para estos elementos, se han desarrollado una variedad de otros métodos. Con un metal, por ejemplo, el radio atómico metálico ( (r_ {met} )) se define como la mitad de la distancia entre los núcleos de dos átomos metálicos adyacentes en el sólido (Figura ( PageIndex {2b} )). Para elementos como los gases nobles, la mayoría de los cuales no forman compuestos estables, podemos usar lo que se llama el radio atómico van der Waals ( (r_ {vdW} )), que es la mitad del internuclear distancia entre dos átomos no unidos en el sólido (Figura ( PageIndex {2c} )). Esto es algo difícil para el helio que no forma un sólido a ninguna temperatura. Un átomo como el cloro tiene un radio covalente (la distancia entre los dos átomos en una molécula ( ce {Cl2} )) y un radio de van der Waals (la distancia entre dos átomos de Cl en diferentes moléculas, por ejemplo , ( ce {Cl2 (s)} ) a bajas temperaturas). Estos radios generalmente no son los mismos (Figura ( PageIndex {2d} )).
Tendencias periódicas en radios atómicos
Debido a que es imposible medir los tamaños de los elementos metálicos y no metálicos utilizando un método cualquiera, los químicos han desarrollado una forma autoconsistente de calcular los radios atómicos utilizando las funciones mecánicas cuánticas. Aunque los valores de radio obtenidos mediante tales cálculos no son idénticos a ninguno de los conjuntos de valores medidos experimentalmente, proporcionan una forma de comparar los tamaños intrínsecos de todos los elementos y muestran claramente que el tamaño atómico varía de manera periódica (Figura ( PageIndex {3} )).
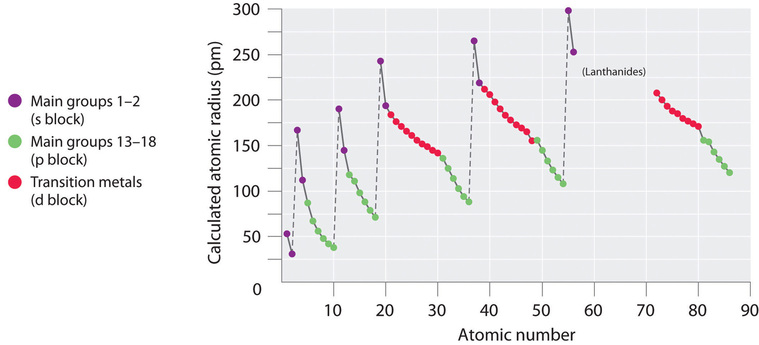
En la tabla periódica, los radios atómicos disminuyen de izquierda a derecha en una fila y aumentan de arriba abajo en una columna. Debido a estas dos tendencias, los átomos más grandes se encuentran en la esquina inferior izquierda de la tabla periódica, y los más pequeños se encuentran en la esquina superior derecha (Figura ( PageIndex {4} )).
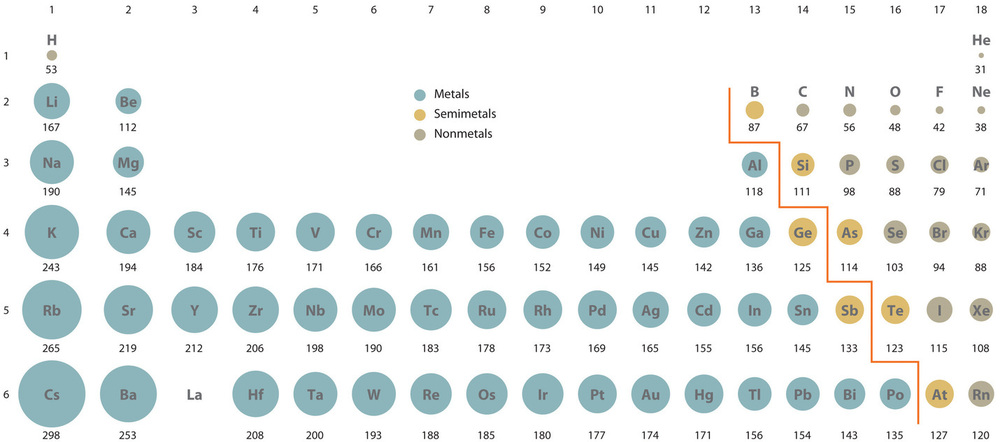
Las tendencias en el tamaño atómico son el resultado de las diferencias en las cargas nucleares efectivas ( (Z_ {eff} )) experimentadas por los electrones en los orbitales más externos de los elementos. Para todos los elementos excepto H, la carga nuclear efectiva es siempre menor que la carga nuclear real debido a los efectos de blindaje. Cuanto mayor es la carga nuclear efectiva, más fuertemente se atraen los electrones más externos al núcleo y más pequeño es el radio atómico.
Los radios atómicos disminuyen de izquierda a derecha en una fila y aumentan de arriba abajo en una columna.
Los átomos en la segunda fila de la tabla periódica (Li a Ne) ilustran el efecto del blindaje de electrones. Todos tienen una cubierta interna llena de 1 s 2 , pero a medida que avanzamos de izquierda a derecha en la fila, la carga nuclear aumenta de +3 a +10. Aunque los electrones se agregan a los orbitales 2 s y 2 p , los electrones en la misma capa principal no son muy efectivos para protegerse entre sí de la carga nuclear . Por lo tanto, el solo electrón de 2 s en litio experimenta una carga nuclear efectiva de aproximadamente +1 porque los electrones en la cubierta llena de 1 2 neutralizan efectivamente dos de los Tres cargas positivas en el núcleo. (Los cálculos más detallados dan un valor de Z eff = +1,26 para Li.) En contraste, los dos electrones 2 s en berilio no se protegen entre sí muy bien, aunque la cubierta de 1 s 2 llena efectivamente neutraliza dos de las cuatro cargas positivas en el núcleo. Esto significa que la carga nuclear efectiva experimentada por los electrones 2 s en el berilio está entre +1 y +2 (el valor calculado es +1,66). En consecuencia, el berilio es significativamente más pequeño que el litio. Del mismo modo, a medida que avanzamos a través de la fila, la carga nuclear creciente no se neutraliza de manera efectiva mediante la adición de electrones a los orbitales 2 s y 2 p . El resultado es un aumento constante de la carga nuclear efectiva y una disminución constante del tamaño atómico (Figura ( PageIndex {5} )).
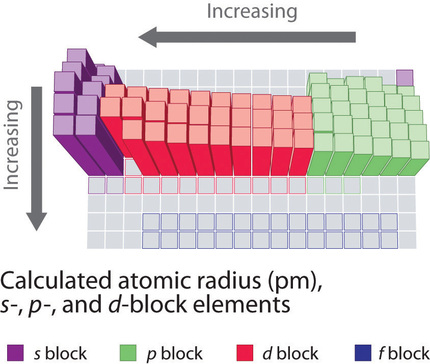
El aumento en el tamaño atómico que baja por una columna también se debe al blindaje de electrones, pero la situación es más compleja porque el número cuántico principal n no es constante. Como vimos en el Capítulo 2, el tamaño de los orbitales aumenta a medida que aumenta n , siempre que la carga nuclear siga siendo la misma . En el grupo 1, por ejemplo, el tamaño de los átomos aumenta sustancialmente bajando la columna. Al principio puede parecer razonable atribuir este efecto a la adición sucesiva de electrones a orbitales ns con valores crecientes de n . Sin embargo, es importante recordar que el radio de un orbital depende dramáticamente de la carga nuclear. A medida que avanzamos por la columna de los elementos del grupo 1, el número cuántico principal n aumenta de 2 a 6, ¡pero la carga nuclear aumenta de +3 a +55!
Como consecuencia, los radios de los orbitales de electrones inferiores en cesio son mucho más pequeños que los de litio y los electrones en esos orbitales experimentan una fuerza de atracción mucho mayor hacia el núcleo. Esa fuerza depende de la carga nuclear efectiva experimentada por los electrones internos. Si los electrones más externos en el cesio experimentaran la carga nuclear completa de +55, un átomo de cesio sería muy pequeño. De hecho, la carga nuclear efectiva que sienten los electrones más externos en el cesio es mucho menor de lo esperado (6 en lugar de 55). Esto significa que el cesio, con una configuración de electrones de valencia de 6 s 1 , es mucho más grande que el litio, con una valencia de 2 s 1 configuración electronica. La carga nuclear efectiva cambia relativamente poco para los electrones en la capa externa, o capa de valencia, de litio a cesio porque los electrones en capas internas llenas son altamente efectivos para proteger electrones en capas externas de la carga nuclear . Aunque el cesio tiene una carga nuclear de +55, tiene 54 electrones llenos 1 s 2 2 s 2 2 [ 19459020] p 6 3 s 2 3 p 6 4 s [19459021 ] 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 conchas, abreviadas como [Xe] 5 s [19459024 ] 2 4 d 10 5 p 6 , que neutralizan efectivamente la mayoría de las 55 cargas positivas en el núcleo. La misma dinámica es responsable del aumento constante del tamaño observado a medida que avanzamos por las otras columnas de la tabla periódica. Las irregularidades generalmente pueden explicarse por variaciones en la carga nuclear efectiva.
Radios iónicos y series isoelectrónicas
Se forma un ion cuando uno o más electrones se eliminan de un átomo neutro para formar un ion positivo (catión) o cuando electrones adicionales se unen a átomos neutros para formar uno negativo (anión). Las designaciones catión o anión provienen de los primeros experimentos con electricidad que encontraron que las partículas cargadas positivamente fueron atraídas al polo negativo de una batería, el cátodo, mientras que las cargadas negativamente fueron atraídas al polo positivo, el ánodo.

Los compuestos iónicos consisten en matrices repetitivas regulares de cationes alternados con carga positiva y aniones con carga negativa. Aunque no es posible medir un radio iónico directamente por la misma razón que no es posible medir directamente el radio de un átomo, es posible medir la distancia entre los núcleos de un catión y un anión adyacente en Un compuesto iónico para determinar el radio iónico (el radio de un catión o anión) de uno o ambos. Como se ilustra en la Figura ( PageIndex {6} ), la distancia internuclear corresponde a la suma de los radios del catión y el anión. Se ha desarrollado una variedad de métodos para dividir la distancia medida experimentalmente proporcionalmente entre el catión más pequeño y el anión más grande. Estos métodos producen conjuntos de radios iónicos que son consistentes internamente de un compuesto iónico a otro, aunque cada método proporciona valores ligeramente diferentes. Por ejemplo, el radio del ion Na + es esencialmente el mismo en NaCl y Na 2 S, siempre que se use el mismo método para medirlo. Por lo tanto, a pesar de las pequeñas diferencias debidas a la metodología, se pueden observar ciertas tendencias.
Una comparación de radios iónicos con radios atómicos (Figura ( PageIndex {7} )) muestra que un catión , después de haber perdido un electrón, siempre es más pequeño que su átomo neutro original , y un anión, habiendo ganado un electrón, siempre es más grande que el átomo neutro original . Cuando uno o más electrones se eliminan de un átomo neutro, suceden dos cosas: (1) las repulsiones entre electrones en la misma capa principal disminuyen porque hay menos electrones presentes, y (2) la carga nuclear efectiva que sienten los electrones restantes aumenta porque hay Hay menos electrones para protegerse entre sí del núcleo. En consecuencia, el tamaño de la región del espacio ocupado por los electrones disminuye y el ion se contrae (compare Li a las 167 pm con Li + a las 76 pm). Si se pueden eliminar diferentes números de electrones para producir iones con diferentes cargas, el ión con la mayor carga positiva es el más pequeño (compárese Fe 2 + a las 78 pm con Fe 3 + a las 64.5 pm). Por el contrario, agregar uno o más electrones a un átomo neutro hace que aumenten las repulsiones electrón-electrón y que disminuya la carga nuclear efectiva, por lo que el tamaño de la región de probabilidad aumenta y el ion se expande (compare F a las 42 pm con F – a las 133 pm).
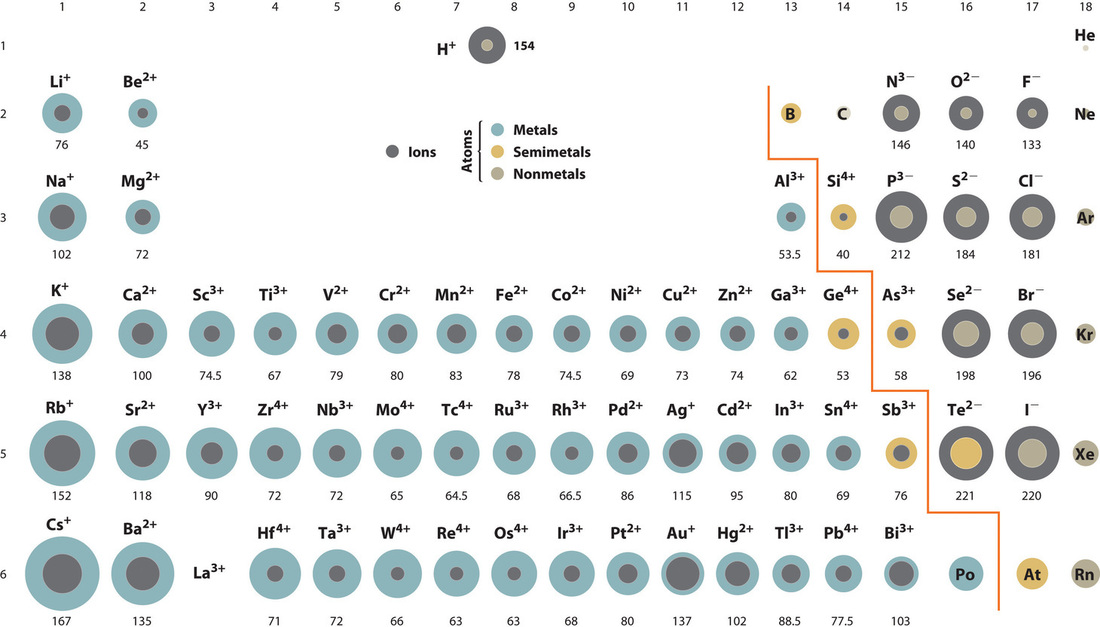
Los cationes son siempre más pequeños que el átomo neutro y los aniones son siempre más grandes.
Debido a que la mayoría de los elementos forman un catión o un anión, pero no ambos, hay pocas oportunidades para comparar los tamaños de un catión y un anión derivado del mismo átomo neutro. Sin embargo, algunos compuestos de sodio contienen el ion Na – , lo que permite comparar su tamaño con el del ion Na + mucho más familiar, que se encuentra en muchos compuestos. El radio de sodio en cada uno de sus tres estados de oxidación conocidos se da en la Tabla ( PageIndex {1} ). Las tres especies tienen una carga nuclear de +11, pero contienen 10 (Na + ), 11 (Na 0 ) y 12 (Na – ) electrones El ion Na + es significativamente más pequeño que el átomo de Na neutro porque el electrón 3 s 1 se ha eliminado para dar una capa cerrada con n [ 19459021] = 2. El ion Na – es más grande que el átomo de Na padre porque el electrón adicional produce una configuración de electrones de valencia de 3 2 2 , mientras que el nuclear La carga sigue siendo la misma.
| Na + | Na 0 | Na – | |
|---|---|---|---|
| Configuración electrónica | 1 s 2 2 s 2 2 p 6 [19459076 ] |
1 s 2 2 s 2 2 p 6 3 [ 19459020] s 1 | 1 s 2 2 s 2 2 p 6 3 [ 19459020] s 2 |
| Radio (pm) | 102 | 154 * | 202 † |
| * El radio metálico medido para Na (s). † Fuente: M. J. Wagner y J. L. Dye, “Alkalides, Electrides, and Expanded Metals”, Annual Review of Materials Science 23 (1993): 225–253. | |||
Los radios iónicos siguen la misma tendencia vertical que los radios atómicos; es decir, para iones con la misma carga, el radio iónico aumenta al descender una columna. La razón es la misma que para los radios atómicos: el blindaje mediante capas internas llenas produce pocos cambios en la carga nuclear efectiva que sienten los electrones más externos. Nuevamente, las capas principales con valores mayores de n se encuentran a distancias sucesivamente mayores del núcleo.
Debido a que los elementos en diferentes columnas tienden a formar iones con diferentes cargas, no es posible comparar iones de la misma carga en una fila de la tabla periódica. En cambio, los elementos que están uno al lado del otro tienden a formar iones con el mismo número de electrones pero con diferentes cargas generales debido a sus diferentes números atómicos. Tal conjunto de especies se conoce como una serie isoelectrónica . Por ejemplo, la serie isoelectrónica de especies con la configuración de caparazón cerrado de neón (1 s 2 2 s 2 2 p 6 ) se muestra en la Tabla ( PageIndex {3} ).
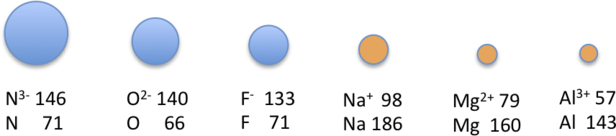
Los tamaños de los iones en esta serie disminuyen suavemente de N 3− a Al 3 + . Los seis iones contienen 10 electrones en los orbitales 1 s , 2 s y 2 p , pero la carga nuclear varía de +7 (N) a +13 (Al). A medida que aumenta la carga positiva del núcleo mientras la cantidad de electrones permanece igual, hay una mayor atracción electrostática entre los electrones y el núcleo, lo que provoca una disminución en el radio. En consecuencia, el ion con la mayor carga nuclear (Al 3 + ) es el más pequeño, y el ion con la carga nuclear más pequeña (N 3− ) es El más largo. El átomo de neón en esta serie isoelectrónica no se enumera en la Tabla ( PageIndex {3} ), porque el neón no forma compuestos covalentes o iónicos y, por lo tanto, su radio es difícil de medir.
| Iones | Radio (pm) | Número atómico |
|---|---|---|
| N 3− | 146 | 7 |
| O 2− | 140 | 8 |
| F – | 133 | 9 |
| Na + | 98 | 11 |
| Mg 2 + | 79 | 12 |
| Al 3 + | 57 | 13 |
Resumen
Los radios iónicos comparten la misma tendencia vertical que los radios atómicos, pero las tendencias horizontales difieren debido a las diferencias en las cargas iónicas. Se han establecido una variedad de métodos para medir el tamaño de un solo átomo o ion. El radio atómico covalente ( r cov ) es la mitad de la distancia internuclear en una molécula con dos átomos idénticos unidos entre sí, mientras que el radio atómico metálico ( r se reunió ) se define como la mitad de la distancia between the nuclei of two adjacent atoms in a metallic element. The van der Waals radius ( r vdW ) of an element is half the internuclear distance between two nonbonded atoms in a solid. Atomic radii decrease from left to right across a row because of the increase in effective nuclear charge due to poor electron screening by other electrons in the same principal shell. Moreover, atomic radii increase from top to bottom down a column because the effective nuclear charge remains relatively constant as the principal quantum number increases. The ionic radii of cations and anions are always smaller or larger, respectively, than the parent atom due to changes in electron–electron repulsions, and the trends in ionic radius parallel those in atomic size. A comparison of the dimensions of atoms or ions that have the same number of electrons but different nuclear charges, called an isoelectronic series , shows a clear correlation between increasing nuclear charge and decreasing size.
Contributors
-
Modified by Joshua Halpern ( Howard University )