Un elemento es la forma más simple de materia que no puede dividirse en sustancias más simples ni construirse a partir de sustancias más simples mediante ningún método químico o físico ordinario. Conocemos 118 elementos, de los cuales 92 son de origen natural, mientras que el resto se ha preparado artificialmente. Los elementos se clasifican además en metales, no metales y metaloides en función de sus propiedades, que se correlacionan con su ubicación en la tabla periódica.
| Elementos metálicos | Elementos no metálicos |
|---|---|
| Distinguiendo brillo (brillo) | No lustroso, varios colores |
| Maleable y dúctil (flexible) como sólidos | Frágil, duro o blando |
| Conducir calor y electricidad | Conductores pobres |
| Los óxidos metálicos son básicos, iónicos | Los óxidos no metálicos son ácidos, covalentes |
| Forma cationes en solución acuosa | Forma aniones, oxianiones en solución acuosa |
Metales
Con la excepción del hidrógeno, todos los elementos que forman iones positivos al perder electrones durante las reacciones químicas se denominan metales. Por lo tanto, los metales son elementos electropositivos con energías de ionización relativamente bajas. Se caracterizan por un brillo brillante, dureza, capacidad de resonar el sonido y son excelentes conductores de calor y electricidad. Los metales son sólidos en condiciones normales, excepto Mercurio.
Propiedades físicas de los metales
Los metales son brillantes, maleables, dúctiles, buenos conductores de calor y electricidad. Otras propiedades incluyen:
- Estado : Los metales son sólidos a temperatura ambiente con la excepción del mercurio, que es líquido a temperatura ambiente (el galio es líquido en los días calurosos).
- Lustre : Los metales tienen la calidad de reflejar la luz de su superficie y pueden pulirse, por ejemplo, oro, plata y cobre.
- Maleabilidad: Los metales tienen la capacidad de resistir el martilleo y pueden convertirse en láminas delgadas conocidas como láminas. Por ejemplo, un trozo de oro del tamaño de un cubo de azúcar se puede golpear en una lámina delgada que cubrirá un campo de fútbol.
- Ductilidad: Los metales se pueden dibujar en los cables. Por ejemplo, se pueden extraer 100 g de plata en un cable delgado de unos 200 metros de largo.
- Dureza: Todos los metales son duros, excepto el sodio y el potasio, que son blandos y se pueden cortar con un cuchillo.
- Valencia: Los metales tienen típicamente de 1 a 3 electrones en la capa más externa de sus átomos.
- Conducción : Los metales son buenos conductores porque tienen electrones libres. La plata y el cobre son los dos mejores conductores de calor y electricidad. El plomo es el conductor de calor más pobre. El bismuto, el mercurio y el hierro también son malos conductores
- Densidad : Los metales tienen alta densidad y son muy pesados. El iridio y el osmio tienen las densidades más altas, mientras que el litio tiene la densidad más baja.
- Puntos de fusión y ebullición : Los metales tienen altos puntos de fusión y ebullición. El tungsteno tiene los puntos de fusión y ebullición más altos, mientras que el mercurio tiene los más bajos. El sodio y el potasio también tienen bajos puntos de fusión.
Propiedades químicas de los metales
Los metales son elementos electropositivos que generalmente forman óxidos básicos u anfóteros con oxígeno. Otras propiedades químicas incluyen:
- Carácter electropositivo : Los metales tienden a tener bajas energías de ionización, y típicamente pierden electrones (es decir, se oxidan ) cuando se someten a reacciones químicas [ 19459040] Normalmente no aceptan electrones. Por ejemplo:
- Los metales alcalinos son siempre 1 + (pierden el electrón en s subshell)
- Los metales alcalinotérreos son siempre 2 + (pierden ambos electrones en s subshell)
- Los iones metálicos de transición no siguen un patrón obvio, 2 + es común (pierden ambos electrones en s subshell), y 1 + y 3 [ 19459041] + también se observan
[ ce {Na ^ 0 rightarrow Na ^ + + e ^ {-}} label {1.1} nonumber ]
[ ce {Mg ^ 0 rightarrow Mg ^ {2+} + 2e ^ {-}} label {1.2} nonumber ]
[ ce {Al ^ 0 rightarrow Al ^ {3+} + 3e ^ {-}} label {1.3} nonumber ]
Los compuestos de metales con no metales tienden a ser iónicos en la naturaleza. La mayoría de los óxidos metálicos son óxidos básicos y se disuelven en agua para formar hidróxidos metálicos :
[ ce {Na2O (s) + H2O (l) rightarrow 2NaOH (aq)} label {1.4} nonumber ]
[ ce {CaO (s) + H2O (l) rightarrow Ca (OH) 2 (aq)} label {1.5} nonumber ]
Los óxidos metálicos exhiben su naturaleza química básica al reaccionar con ácidos para formar sales de metal ] y agua:
[ ce {MgO (s) + HCl (aq) rightarrow MgCl2 (aq) + H2O (l)} label {1.6} nonumber ]
[ ce {NiO (s) + H2SO4 (aq) rightarrow NiSO4 (aq) + H2O (l)} label {1.7} nonumber ]
No metales
Los elementos que tienden a ganar electrones para formar aniones durante las reacciones químicas se denominan no metales. Estos son elementos electronegativos con altas energías de ionización. Son conductores no lustrosos, frágiles y pobres de calor y electricidad (excepto grafito). Los no metales pueden ser gases, líquidos o sólidos.
Propiedades físicas de los no metales
- Estado físico : La mayoría de los no metales existen en dos de los tres estados de la materia a temperatura ambiente: gases (oxígeno) y sólidos (carbono). Solo el bromo existe como líquido a temperatura ambiente.
- No maleable y dúctil : Los no metales son muy frágiles y no pueden enrollarse en alambres ni golpearse en láminas.
- Conducción : Son malos conductores de calor y electricidad.
- Brillo: Estos no tienen brillo metálico y no reflejan la luz.
- Puntos de fusión y ebullición : Los puntos de fusión de los no metales son generalmente más bajos que los metales, pero son muy variables.
- Existen siete no metales en condiciones estándar como moléculas diatómicas : ( ce {H2 (g)} ), ( ce {N2 (g)} ), ( ce {O2 (g)} ), ( ce {F2 (g)} ), ( ce {Cl2 (g)} ), ( ce {Br2 (l)} ), ( ce {I2 (s)} ).
Propiedades químicas de los no metales
Los no metales tienden a ganar o compartir electrones con otros átomos. Son de carácter electronegativo. Los no metales, cuando reaccionan con metales, tienden a ganar electrones (típicamente alcanzando la configuración de electrones de gas noble) y se convierten en aniones:
[ ce {3Br2 (l) + 2Al (s) rightarrow 2AlBr3 (s)} nonumber ]
Los compuestos compuestos enteramente de no metales son sustancias covalentes. Generalmente forman óxidos ácidos o neutros con oxígeno que se disuelven en agua para formar ácidos:
[ ce {CO2 (g) + H2O (l)} rightarrow underset { text {ácido carbónico}} { ce {H2CO3 (aq)}} nonumber ]
Como sabrá, el agua carbonatada es ligeramente ácida (ácido carbónico).
Los óxidos no metálicos pueden combinarse con bases para formar sales.
[ ce {CO2 (g) + 2NaOH (aq) rightarrow Na2CO3 (aq) + H2O (l)} nonumber ]
Metaloides
Los metaloides tienen propiedades intermedias entre los metales y los no metales. Los metaloides son útiles en la industria de semiconductores. Los metaloides son todos sólidos a temperatura ambiente. Pueden formar aleaciones con otros metales. Algunos metaloides, como el silicio y el germanio, pueden actuar como conductores eléctricos en las condiciones adecuadas, por lo que se denominan semiconductores. El silicio, por ejemplo, parece brillante, pero no es maleable ni dúctil (es quebradizo , una característica de algunos no metales). Es un conductor de calor y electricidad mucho más pobre que los metales. Las propiedades físicas de los metaloides tienden a ser metálicas, pero sus propiedades químicas tienden a ser no metálicas. El número de oxidación de un elemento en este grupo puede variar de +5 a -2, dependiendo del grupo en el que se encuentre.
| Metales | No metales | Metaloides |
|---|---|---|
| Oro | Oxígeno | Silicio |
| Plata | Carbono | Boro |
| Cobre | Hidrógeno | Arsénico |
| Hierro | Nitrógeno | Antimonio |
| Mercurio | Azufre | Germanio |
| Zinc | Fósforo |
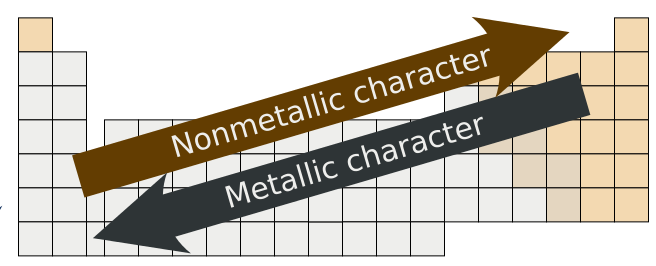
Tendencias en caracteres metálicos y no metálicos
El carácter metálico es más fuerte para los elementos en la parte más a la izquierda de la tabla periódica, y tiende a disminuir a medida que nos movemos hacia la derecha en cualquier período (el carácter no metálico aumenta con el aumento de los valores de electronegatividad y energía de ionización). Dentro de cualquier grupo de elementos (columnas), el carácter metálico aumenta de arriba a abajo (los valores de electronegatividad y energía de ionización generalmente disminuyen a medida que avanzamos por un grupo). Esta tendencia general no se observa necesariamente con los metales de transición.
Colaboradores
-
Mike Blaber ( Florida State University )
-
Binod Shrestha (Universidad de Lorena)