Los iones son átomos o moléculas que tienen carga eléctrica. Los cationes están cargados positivamente y los aniones tienen una carga negativa. Los iones se forman cuando los átomos ganan o pierden electrones. Como los electrones tienen carga negativa, un átomo que pierde uno o más electrones se cargará positivamente; Un átomo que gana uno o más electrones se carga negativamente. Enlace iónico es la atracción entre iones con carga positiva y negativa. Estos iones con carga opuesta se atraen entre sí para formar redes iónicas (o retículas ). La electrostática explica por qué sucede esto: las cargas opuestas se atraen y las cargas similares se repelen. Cuando muchos iones se atraen entre sí, forman grandes redes de cristal ordenadas en las que cada ión está rodeado por iones de la carga opuesta. En general, cuando los metales reaccionan con los no metales, los electrones se transfieren de los metales a los no metales. Los metales forman iones cargados positivamente y los no metales forman iones cargados negativamente.
Generando enlaces iónicos
Los enlaces iónicos se forman cuando los metales y los no metales reaccionan químicamente. Por definición, un metal es relativamente estable si pierde electrones para formar una capa de valencia completa y se carga positivamente. Del mismo modo, un no metal se estabiliza ganando electrones para completar su capa de valencia y cargarse negativamente. Cuando los metales y los no metales reaccionan, los metales pierden electrones transfiriéndolos a los no metales, que los ganan. En consecuencia, se forman iones, que se atraen instantáneamente entre sí: enlaces iónicos.
En el compuesto iónico general, las cargas positivas y negativas deben estar equilibradas, porque los electrones no pueden crearse ni destruirse, solo transferirse. Por lo tanto, el número total de electrones perdidos por las especies catiónicas debe ser igual al número total de electrones ganados por las especies aniónicas.
Energética de la formación de enlaces iónicos
Los enlaces iónicos se forman cuando los iones cargados positiva y negativamente se mantienen unidos por fuerzas electrostáticas. Considere un solo par de iones, un catión y un anión. ¿Qué tan fuerte será la fuerza de su atracción? Según Ley de Coulomb , la energía de la atracción electrostática ( (E )) entre dos partículas cargadas es proporcional a la magnitud de las cargas e inversamente proporcional a la distancia internuclear entre las partículas ( (r )):
[E propto dfrac {Q_ {1} Q_ {2}} {r} label {Eq1a} ]
[E = k dfrac {Q_ {1} Q_ {2}} {r} label {Eq1b} ]
donde la carga de cada ion está representada por el símbolo Q . La constante de proporcionalidad k es igual a 2,31 × 10 −28 J · m. Este valor de k incluye la carga de un solo electrón (1.6022 × 10 −19 C) para cada ion. La ecuación también se puede escribir usando la carga de cada ion, expresada en culombios (C), incorporada en la constante. En este caso, la constante de proporcionalidad, k , es igual a 8.999 × 109 J · m / C 2 . En el ejemplo dado, Q 1 = +1 (1.6022 × 10 −19 C) y Q 2 [19459029 ] = −1 (1.6022 × 10 −19 C). Si Q 1 y Q 2 tienen signos opuestos (como en NaCl, por ejemplo, donde Q [ 19459025] 1 es +1 para Na + y Q 2 es −1 para Cl – ), entonces E es negativo, lo que significa que la energía se libera cuando los iones con carga opuesta se juntan desde una distancia infinita para formar un par de iones aislado.
La energía siempre se libera cuando se forma un enlace y, en consecuencia, siempre requiere energía para romper un enlace.
Como se muestra en la curva verde en la mitad inferior de la Figura ( PageIndex {1} ), la energía máxima se liberaría cuando los iones están infinitamente cerca uno del otro, en r = 0. Como los iones ocupan espacio y tienen una estructura con el núcleo positivo rodeado de electrones, sin embargo, no pueden estar infinitamente juntos. A distancias muy cortas, las interacciones repulsivas electrón-electrón entre electrones en iones adyacentes se vuelven más fuertes que las interacciones atractivas entre iones con cargas opuestas, como lo muestra la curva roja en la mitad superior de la Figura ( PageIndex {1} ). La energía total del sistema es un equilibrio entre las interacciones atractivas y repulsivas. La curva púrpura en la Figura ( PageIndex {1} ) muestra que la energía total del sistema alcanza un mínimo en r 0 , el punto donde están las repulsiones electrostáticas y las atracciones exactamente equilibrado Esta distancia es la misma que la distancia de enlace medida experimentalmente .
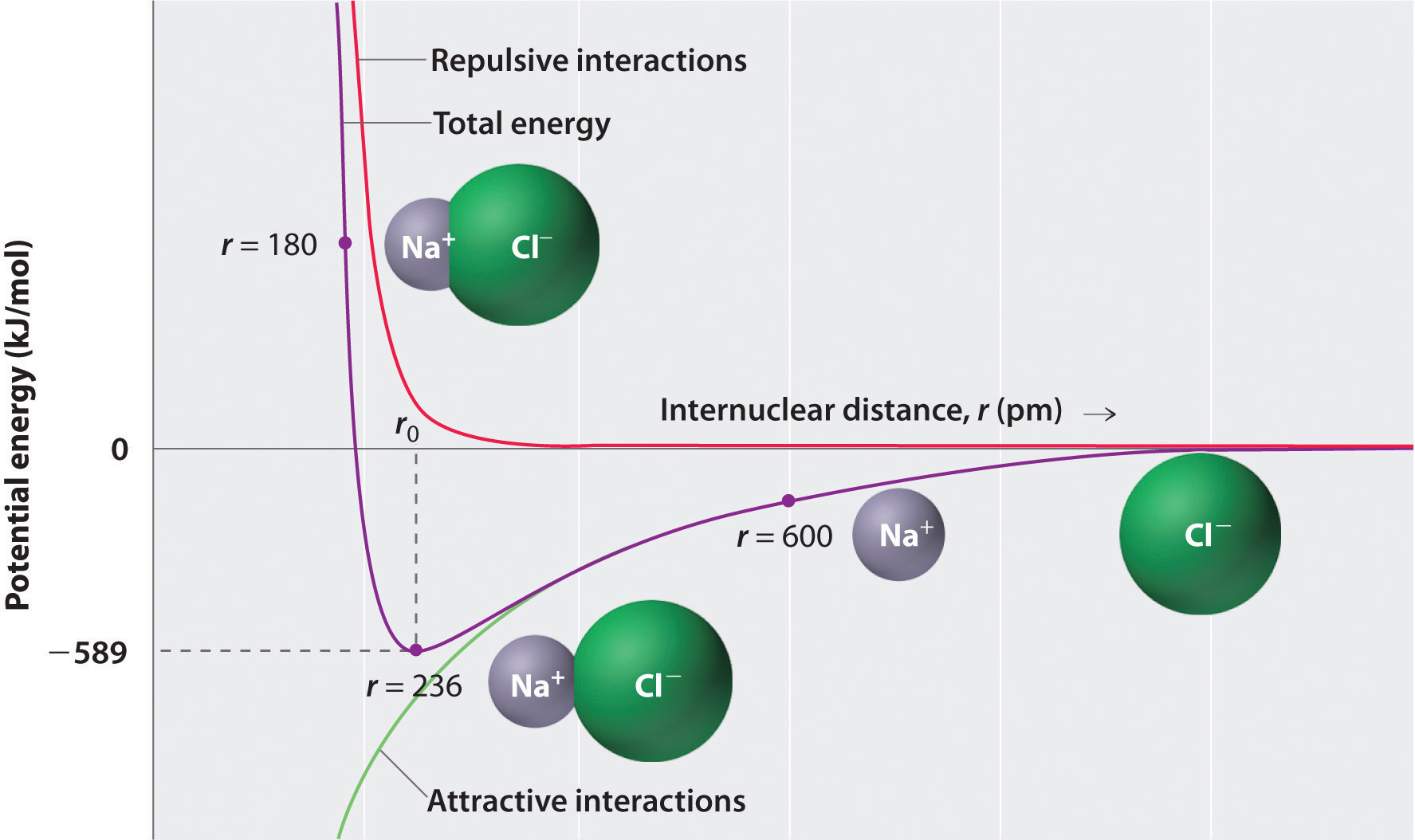
Considere la energía liberada cuando un ion gaseoso (Na ^ + ) y un ion gaseoso (Cl ^ – ) se juntan de r = ∞ a r = r 0 . Dado que la distancia internuclear observada en fase gaseosa es 236 pm, el cambio de energía asociado con la formación de un par iónico a partir de un ion (Na ^ + _ {(g)} ) y un (Cl ^ -_ {( g)} ) el ion es el siguiente:
[ begin {align *} E & = k dfrac {Q_ {1} Q_ {2}} {r_ {0}} \ [4pt] & = (2.31 times {10 ^ {- 28 }} rm {J} cdot cancel {m}) left ( dfrac {(+ 1) (- 1)} {236 ; cancel {pm} times 10 ^ {- 12} cancel { m / pm}} right) \ [4pt] & = – 9.79 times 10 ^ {- 19} ; J / ion ; par etiqueta {Eq2} end {align *} ]
El valor negativo indica que se libera energía. Nuestra convención es que si un proceso químico proporciona energía al mundo exterior, el cambio de energía es negativo. Si requiere energía, el cambio de energía es positivo. Para calcular el cambio de energía en la formación de un mol de pares de NaCl, necesitamos multiplicar la energía por par de iones por el número de Avogadro:
[E = left (-9.79 times 10 ^ {- 19} ; J / cancel {ion pair} right) left (6.022 times 10 ^ {23} ; cancel {ion ; pair} / mol right) = – 589 ; kJ / mol label {Eq3} ]
Esta es la energía liberada cuando se forma 1 mol de pares de iones gaseosos, no cuando se condensa 1 mol de iones positivos y negativos para formar una red cristalina. Debido a las interacciones de largo alcance en la estructura reticular, esta energía no se corresponde directamente con la energía reticular del sólido cristalino. Sin embargo, el gran valor negativo indica que reunir iones positivos y negativos es energéticamente muy favorable, ya sea que se forme un par de iones o una red cristalina.
Resumimos los puntos importantes sobre la unión iónica:
- En r 0 , los iones son más estables (tienen una energía potencial menor) que a una distancia internuclear infinita. Cuando los iones con carga opuesta se juntan de r = ∞ a r = r 0 , la energía del sistema se reduce (energía en lanzamiento).
- Debido a la baja energía potencial en r 0 , se debe agregar energía al sistema para separar los iones. La cantidad de energía necesaria es la energía de enlace.
- La energía del sistema alcanza un mínimo a una distancia internuclear particular (la distancia de enlace).
Configuración electrónica de iones
¿Cómo se compara la energía liberada en la formación de la red con la energía requerida para quitar un segundo electrón del ion Na + ? Dado que el ion Na + tiene una configuración de electrones de gas noble, eliminar el siguiente electrón de esta disposición estable requeriría más energía de la que se libera durante la formación de la red (Sodio I 2 = 4,560 kJ / mol). Por lo tanto, el sodio está presente en los compuestos iónicos como Na + y no como Na 2+ . Del mismo modo, agregar un electrón para llenar una capa de valencia (y lograr una configuración de electrones de gas noble) es exotérmico o solo ligeramente endotérmico. Para agregar un electrón adicional en una subshell nueva se requiere una energía tremenda, más que la energía de la red. Por lo tanto, encontramos Cl – en compuestos iónicos, pero no Cl 2- .
| Compuesto | Energía de celosía (kJ / mol) |
|---|---|
| LiF | 1024 |
| LiI | 744 |
| NaF | 911 |
| NaCl | 788 |
| NaI | 693 |
| KF | 815 |
| KBr | 682 |
| KI | 641 |
| MgF 2 | 2910 |
| SrCl 2 | 2130 |
| MgO | 3938 |
Esta cantidad de energía puede compensar valores tan grandes como I 3 para electrones de valencia (es decir, puede eliminar hasta 3 electrones de valencia). Debido a que la mayoría de los metales de transición requerirían la eliminación de más de 3 electrones para lograr un núcleo de gas noble, no se encuentran en compuestos iónicos con un núcleo de gas noble. Un metal de transición siempre pierde electrones primero de la subshell ‘s’ superior, antes de perder de la subshell ‘d’ subyacente. (¡Los electrones restantes en el subshell d sin relleno son la razón de los colores brillantes observados en muchos compuestos de metales de transición!) Por ejemplo, los iones de hierro no formarán un núcleo de gas noble:
- Fe: [Ar] 4s 2 3d 6
- Fe 2+ : [Ar] 3d 6
- Fe 3+ : [Ar] 3d 5
Algunos iones metálicos pueden formar un núcleo de gas pseudo noble (y ser incoloro), por ejemplo:
- Ag: [Kr] 5s 1 4d 10 Ag + [Kr] 4d 10 Compuesto: AgCl
- Cd: [Kr] 5s 2 4d 10 Cd 2+ [Kr] 4d 10 Compuesto: CdS
Los electrones de valencia no se adhieren a la “regla del octeto” en este caso (una limitación de la utilidad de esta regla). Nota: Los átomos de plata y cadmio perdieron los electrones 5s para alcanzar el estado iónico.
Cuando se forma un ion positivo a partir de un átomo, los electrones siempre se pierden primero de la subcapa con el número cuántico principal más grande
Iones poliatómicos
No todos los compuestos iónicos se forman a partir de solo dos elementos. Existen muchos iones poliatómicos , en los que dos o más átomos están unidos por enlaces covalentes. Forman una agrupación estable que lleva una carga (positiva o negativa). El grupo de átomos en su conjunto actúa como una especie cargada al formar un compuesto iónico con un ion con carga opuesta. Los iones poliatómicos pueden ser positivos o negativos, por ejemplo:
- NH 4 + (amonio) = catión
- SO 4 2- (sulfato) = anión
Los principios de la unión iónica con iones poliatómicos son los mismos que los de los iones monoatómicos. Los iones con carga opuesta se unen para formar una red cristalina, liberando una energía de red. En base a las formas y cargas de los iones poliatómicos, estos compuestos pueden formar redes cristalinas con estructuras interesantes y complejas.
Resumen
La cantidad de energía necesaria para separar un par de iones gaseosos es su energía de enlace. La formación de compuestos iónicos suele ser extremadamente exotérmica . La fuerza de la atracción electrostática entre iones con cargas opuestas es directamente proporcional a la magnitud de las cargas en los iones e inversamente proporcional a la distancia internuclear. La energía total del sistema es un equilibrio entre las interacciones repulsivas entre electrones en iones adyacentes y las interacciones atractivas entre iones con cargas opuestas.
Colaboradores
- http://en.wikibooks.org/wiki/User:Jplego/Collections
-
Mike Blaber ( Florida State University )
-
Modificado por Joshua Halpern ( Universidad de Howard )