Al proponer su teoría de que los octetos se pueden completar con dos átomos que comparten pares de electrones, Lewis proporcionó a los científicos la primera descripción del enlace covalente. En esta sección, ampliaremos esto y describiremos algunas de las propiedades de los enlaces covalentes. Las propiedades generales de las sustancias iónicas son:
- generalmente frágil
- alto punto de fusión
- organizado en una red ordenada de átomos, que puede dividirse a lo largo de una línea suave
Sin embargo, la gran mayoría de las sustancias químicas son no iónicas en la naturaleza. G.N. Lewis razonó que un átomo podría alcanzar una configuración de electrones de gas noble mediante compartiendo electrones.
Un enlace químico formado al compartir un par de electrones se llama enlace covalente
Estructuras de Lewis
Las estructuras de Lewis (también conocidas como diagramas de puntos de Lewis, diagramas de puntos de electrones, fórmulas de puntos de Lewis, estructuras de puntos de Lewis y estructuras de puntos de electrones) son diagramas que muestran la unión entre los átomos de una molécula y los pares de electrones solitarios que pueden existir en la molécula Las estructuras de Lewis muestran cada átomo y su posición en la estructura de la molécula utilizando su símbolo químico. Las líneas se dibujan entre los átomos que están unidos entre sí (se pueden usar pares de puntos en lugar de líneas). El exceso de electrones que forman pares solitarios se representan como pares de puntos y se colocan al lado de los átomos.
La molécula de hidrógeno diatómico (H 2 ) es el modelo más simple de un enlace covalente, y se representa en las estructuras de Lewis como:
El par compartido de electrones proporciona átomo de hidrógeno con dos electrones en su capa de valencia (el 1 s ) orbital. En cierto sentido, cada átomo de hidrógeno tiene la configuración electrónica del helio gaseoso noble. Cuando dos átomos de cloro se unen covalentemente para formar (Cl_2 ), se produce el siguiente intercambio de electrones:
Cada átomo de cloro comparte el par de electrones de enlace y logra la configuración electrónica del argón de gas noble. En las estructuras de Lewis, el par de electrones de enlace generalmente se muestra como una línea, y los electrones no compartidos como puntos:
Los electrones compartidos no están ubicados en una posición fija entre los núcleos. En el caso del compuesto (H_2 ), la densidad de electrones se concentra entre los dos núcleos:
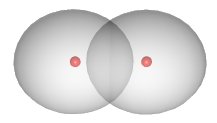
Los dos átomos están unidos a la molécula (H_2 ) principalmente debido a la atracción de los núcleos cargados positivamente para la nube de electrones cargada negativamente ubicada entre ellos. Ejemplos de compuestos de hidruro de los elementos anteriores (enlaces covalentes con hidrógeno:
Enlaces múltiples
El intercambio de un par de electrones representa un enlace covalente único, generalmente denominado enlace simple . Sin embargo, en muchas moléculas, los átomos alcanzan octetos completos al compartir más de un par de electrones entre ellos:
- Dos pares de electrones compartieron un doble enlace
- Tres pares de electrones compartieron un triple enlace
Debido a que cada nitrógeno contiene 5 electrones de valencia, necesitan compartir 3 pares para lograr un octeto de valencia. N 2 es bastante inerte, debido al fuerte triple enlace entre los dos átomos de nitrógeno y la distancia de enlace N – N en N 2 es 1.10 Å (bastante corto). De un estudio de varios compuestos que contienen nitrógeno, la distancia de enlace en función del tipo de enlace se puede resumir de la siguiente manera:
- ( ce {N-N} ): 1.47Å
- ( ce {N = N} ): 1.24Å
- ( ce {N: = N} ): 1.10Å
Para los no metales (y los metales de bloque ‘s’) el número de electrones de valencia es igual al número de grupo:
| Elemento | Grupo | Electrones de valencia | Se necesitan enlaces para formar el octeto de valencia |
|---|---|---|---|
| aF | 17 | 7 | 1 |
| O | 16 | 6 | 2 |
| N | 15 | 5 | 3 |
| C | 14 | 4 | 4 |
Por lo tanto, los enlaces de Lewis describen con éxito las interacciones covalentes entre varios elementos no metálicos. Cuando dibujamos estructuras de Lewis, colocamos uno, dos o tres pares de electrones entre átomos adyacentes. En el modelo de enlace de Lewis, el número de pares de electrones que mantienen dos átomos juntos se denomina orden de enlace . Para un enlace simple, como el enlace C – C en H 3 C – CH 3 , el orden de los enlaces es uno. Para un doble enlace (como H 2 C = CH 2 ), el orden de los enlaces es dos. Para un enlace triple, como HC≡CH, el orden de enlace es tres.
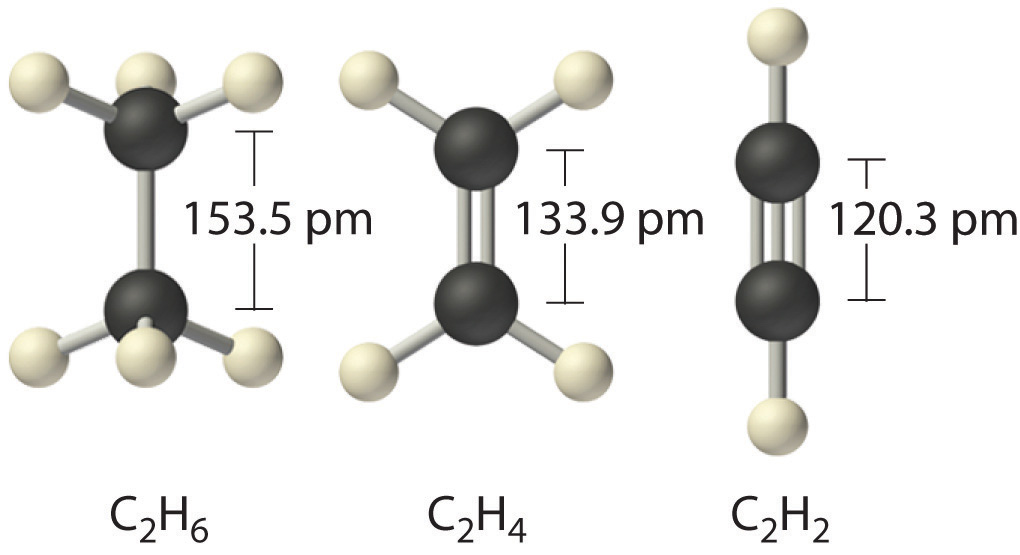
Cuando se comparan enlaces análogos en compuestos similares, la longitud del enlace disminuye a medida que aumenta el orden del enlace. Los datos de longitud de enlace en la Tabla ( PageIndex {1} ), por ejemplo, muestran que la distancia C – C en H 3 C – CH 3 (153.5 pm) es mayor que la distancia en H 2 C = CH 2 (133.9 pm), que a su vez es más larga que en HC≡CH (120.3 pm). Además, como se señaló en la Sección 8.5, las moléculas o iones cuyo enlace debe describirse usando estructuras de resonancia generalmente tienen distancias de enlace intermedias entre las de enlaces simples y dobles, como demostramos con las distancias C – C en benceno. Sin embargo, la relación entre la longitud y el orden de los enlaces no es lineal. Un enlace doble no es la mitad de largo que un enlace simple, y la longitud de un enlace C = C no es el promedio de las longitudes de los enlaces C≡C y C – C. Sin embargo, a medida que aumentan las órdenes de bonos, las duraciones de los bonos generalmente disminuyen.
| Compuesto | Orden de fianza | Longitud de enlace (pm) | Energía de disociación de enlace (kJ / mol) | Compuesto | Orden de fianza | Longitud de enlace (pm) | Energía de disociación de enlace (kJ / mol) |
|---|---|---|---|---|---|---|---|
| H 3 C – CH 3 | 1 | 153,5 | 376 | H 3 C – NH 2 | 1 | 147,1 | 331 |
| H 2 C = CH 2 | 2 | 133,9 | 728 | H 2 C = NH | 2 | 127,3 | 644 |
| HC≡CH | 3 | 120,3 | 965 | HC≡N | 3 | 115,3 | 937 |
| H 2 N – NH 2 | 1 | 144,9 | 275,3 | H 3 C – OH | 1 | 142,5 | 377 |
| HN = NH | 2 | 125,2 | 456 | H 2 C = O | 2 | 120,8 | 732 |
| N≡N | 3 | 109,8 | 945,3 | O = C = O | 2 | 116,0 | 799 |
| HO – OH | 1 | 147,5 | 213 | C≡O | 3 | 112,8 | 1076,5 |
| O = O | 2 | 120,7 | 498,4 | ||||
Fuentes: Datos de CRC Handbook of Chemistry and Physics (2004); Manual de química de Lange (2005); http://cccbdb.nist.gov .
La relación entre el orden de los bonos y la energía de los bonos
Como se muestra en la Tabla ( PageIndex {1} ), los enlaces triples entre átomos similares son más cortos que los enlaces dobles, y debido a que se requiere más energía para romper completamente los tres enlaces que para romper completamente dos, un enlace triple es También más fuerte que un doble enlace. Del mismo modo, los enlaces dobles entre átomos similares son más fuertes y más cortos que los enlaces simples. Sin embargo, los enlaces del mismo orden entre átomos diferentes muestran una amplia gama de energías de enlace.
| Bonos simples | Bonos múltiples | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| H – H | 432 | C – C | 346 | N – N | ≈167 | O – O | ≈142 | F – F | 155 | C = C | 602 |
| H – C | 411 | C – Si | 318 | N – O | 201 | O – F | 190 | F – Cl | 249 | C≡C | 835 |
| H – Si | 318 | C – N | 305 | N – F | 283 | O – Cl | 218 | F – Br | 249 | C = N | 615 |
| H – N | 386 | C – O | 358 | N – Cl | 313 | O – Br | 201 | F – I | 278 | C≡N | 887 |
| H – P | ≈322 | C – S | 272 | N – Br | 243 | O – I | 201 | Cl – Cl | 240 | C = O | 749 |
| H – O | 459 | C – F | 485 | P – P | 201 | S – S | 226 | Cl-Br | 216 | C≡O | 1072 |
| H – S | 363 | C – Cl | 327 | S – F | 284 | Cl – I | 208 | N = N | 418 | ||
| H – F | 565 | C – Br | 285 | S – Cl | 255 | Br – Br | 190 | N≡N | 942 | ||
| H – Cl | 428 | C – I | 213 | S – Br | 218 | Br – I | 175 | N = O | 607 | ||
| H – Br | 362 | Si – Si | 222 | I – I | 149 | O = O | 494 | ||||
| H – I | 295 | Si – O | 452 | S = O | 532 | ||||||
|
Fuente: Datos de J. E. Huheey, E. A. Keiter y R. L. Keiter, Inorganic Chemistry , 4ª ed. (1993)
|
|||||||||||
La tabla ( PageIndex {2} ) enumera los valores promedio de algunos enlaces comúnmente encontrados. Aunque los valores que se muestran varían ampliamente, podemos observar cuatro tendencias:
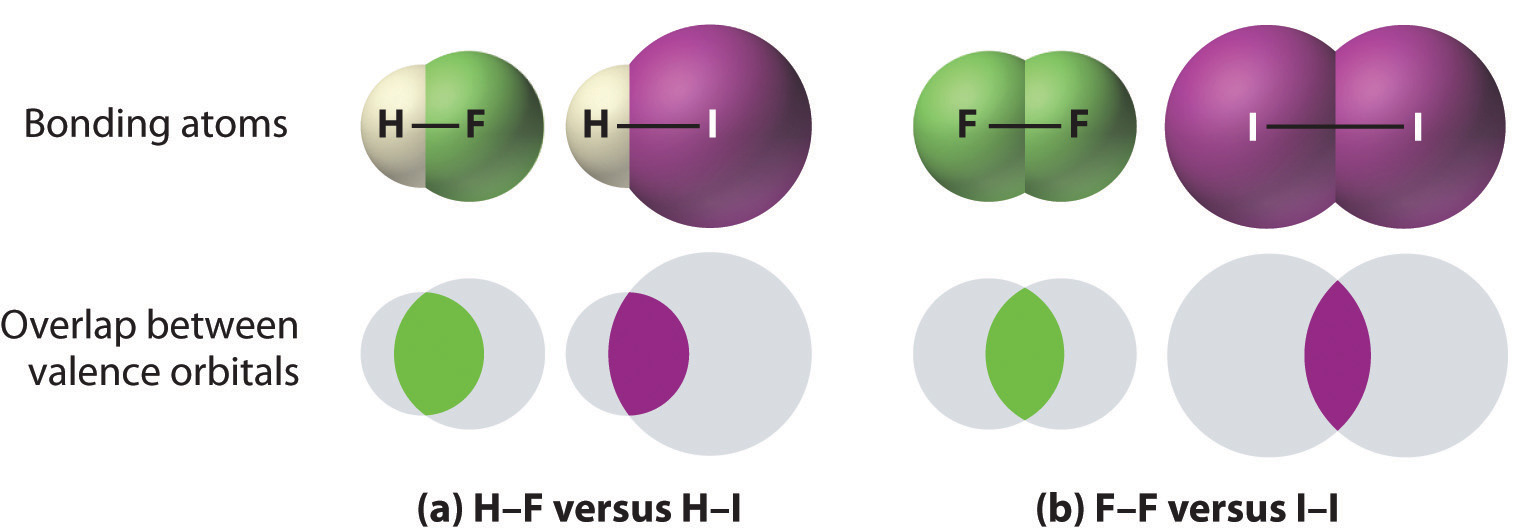
- Los enlaces entre hidrógeno y átomos en la misma columna de la tabla periódica disminuyen en fuerza a medida que avanzamos por la columna. Por lo tanto, un enlace H – F es más fuerte que un enlace H – I, H – C es más fuerte que H – Si, H – N es más fuerte que H – P, H – O es más fuerte que H – S, y así sucesivamente. La razón de esto es que la región del espacio en la que los electrones se comparten entre dos átomos se vuelve proporcionalmente más pequeña a medida que uno de los átomos se hace más grande (parte (a) en la Figura 8.3.1).
- Los enlaces entre átomos similares generalmente se vuelven más débiles a medida que avanzamos por una columna (se observan excepciones importantes más adelante). Por ejemplo, el enlace simple C – C es más fuerte que el enlace simple Si – Si, que es más fuerte que el enlace Ge – Ge, y así sucesivamente. A medida que dos átomos unidos se hacen más grandes, la región entre ellos ocupada por electrones de enlace se vuelve proporcionalmente más pequeña, como se ilustra en la parte (b) en la Figura 8.3.1. Excepciones notables son los enlaces simples entre el período 2 átomos de los grupos 15, 16 y 17 (es decir, N, O, F), que son inusualmente débiles en comparación con los enlaces simples entre sus congéneres más grandes. Es probable que los enlaces simples N – N, O – O y F – F sean más débiles de lo esperado debido a las fuertes interacciones repulsivas entre pares de electrones solitarios en átomos adyacentes. La tendencia en las energías de enlace para los halógenos es, por lo tanto, [ ce {Cl bond {-} Cl> Br bond {-} Br> F bond {-} F> I – I} ] También se observan efectos similares para los enlaces simples O – O versus S – S y N – N versus P – P.
Los enlaces entre hidrógeno y átomos en una columna dada en la tabla periódica son más débiles en la columna; los enlaces entre átomos similares generalmente se debilitan en una columna.
- Debido a que los elementos en los períodos 3 y 4 rara vez forman enlaces múltiples consigo mismos, sus energías de enlace múltiple no se conocen con precisión. No obstante, se supone que son significativamente más débiles que los enlaces múltiples entre átomos más ligeros de las mismas familias. Los compuestos que contienen un enlace doble Si = Si, por ejemplo, se han preparado recientemente, mientras que los compuestos que contienen enlaces dobles C = C son una de las clases de compuestos orgánicos mejor estudiadas y más importantes.
- Los enlaces múltiples entre carbono, oxígeno o nitrógeno y un elemento del período 3 como el fósforo o el azufre tienden a ser inusualmente fuertes. De hecho, los enlaces múltiples de este tipo dominan la química de los elementos del período 3 de los grupos 15 y 16. Los enlaces múltiples a fósforo o azufre se producen como resultado de d interacciones orbitales, por ejemplo, para el ión SO 4 2− . En contraste, el silicio en el grupo 14 tiene poca tendencia a formar dobles enlaces discretos de silicio-oxígeno. En consecuencia, SiO 2 tiene una estructura de red tridimensional en la que cada átomo de silicio forma cuatro enlaces simples de Si-O, lo que hace que las propiedades físicas y químicas de SiO 2 sean muy diferentes de aquellas de CO 2 .
La relación entre la estructura molecular y la energía de enlace
La energía de enlace se define como la energía requerida para romper un enlace particular en una molécula en la fase gaseosa. Su valor depende no solo de la identidad de los átomos unidos sino también de su entorno. Por lo tanto, la energía de enlace de un enlace simple C – H no es igual en todos los compuestos orgánicos. Por ejemplo, la energía requerida para romper un enlace C – H en metano varía hasta en un 25% dependiendo de cuántos otros enlaces en la molécula ya se han roto (Tabla ( PageIndex {2} )); es decir, la energía de enlace C – H depende de su entorno molecular. Excepto para las moléculas diatómicas, las energías de enlace enumeradas en la Tabla ( PageIndex {2} ) son valores promedio para todos los enlaces de un tipo dado en un rango de moléculas. Aun así, no es probable que difieran del valor real de un bono dado en más de aproximadamente un 10%.
| Reacción | D (kJ / mol) |
|---|---|
| CH 4 (g) → CH 3 (g) + H (g) | 439 |
| CH 3 (g) → CH 2 (g) + H (g) | 462 |
| CH 2 (g) → CH (g) + H (g) | 424 |
| CH (g) → C (g) + H (g) | 338 |
|
Fuente: Datos de CRC Handbook of Chemistry and Physics (2004).
|
|
Podemos estimar el cambio de entalpía para una reacción química sumando las energías promedio de los enlaces rotos en los reactivos y las energías promedio de los enlaces formados en los productos y luego calculando la diferencia entre los dos. Si los enlaces formados en los productos son más fuertes que los rotos en los reactivos, entonces se liberará energía en la reacción (Δ H rxn <0):
[ΔH_ {rxn} approx sum { text {(energías de enlace de enlaces rotos)}} – sum { text {(energías de enlace de enlaces formados)}} label {8.3.1} ]
El signo ≈ se usa porque estamos sumando energías de enlace promedio ; por lo tanto, este enfoque no proporciona valores exactos para Δ H rxn .
Consideremos la reacción de 1 mol de n -heptano (C 7 H 16 ) con gas oxígeno para dar dióxido de carbono y agua. Esta es una reacción que ocurre durante la combustión de gasolina:
[CH_3 (CH_2) _5CH_ {3 (l)} + 11 O_ {2 (g)} rightarrow 7 CO_ {2 (g)} + 8 H_2O _ {(g)} label {8.3.2} ]
En esta reacción, se rompen 6 enlaces C – C, 16 enlaces C – H y 11 enlaces O = O por mol de n -heptano, mientras que 14 enlaces C = O (dos por cada Se forman CO 2 ) y 16 enlaces O-H (dos por cada H 2 O). Los cambios de energía se pueden tabular de la siguiente manera:
| Bonos rotos (kJ / mol) | Bonos formados (kJ / mol) | ||
|---|---|---|---|
| 6 C – C | 346 × 6 = 2076 | 14 C = O | 799 × 14 = 11,186 |
| 16 C – H | 411 × 16 = 6576 | 16 O – H | 459 × 16 = 7344 |
| 11 O = O | 494 × 11 = 5434 | Total = 18,530 | |
| Total = 14,086 | |||
Los enlaces en los productos son más fuertes que los enlaces en los reactivos en aproximadamente 4444 kJ / mol. Esto significa que (ΔH_ {rxn} ) es aproximadamente −4444 kJ / mol, y la reacción es altamente exotérmica (lo cual no es demasiado sorprendente para una reacción de combustión).
Si comparamos esta aproximación con el valor obtenido de los valores medidos (ΔH_f ^ o ) ( (ΔH_ {rxn} = −481 ; 7 kJ / mol )), encontramos una discrepancia de solo 8 %, menos del 10% que se encuentra típicamente. Los químicos consideran que este método es útil para calcular entalpías de reacción aproximadas para moléculas cuyos valores reales (ΔH ^ ο_f ) son desconocidos. Estas aproximaciones pueden ser importantes para predecir si una reacción es exotérmica o endotérmica , y en qué grado.
Resumen
La fuerza de un enlace covalente depende de la superposición entre los orbitales de valencia de los átomos unidos. El orden de enlace es el número de pares de electrones que mantienen unidos dos átomos. Los enlaces simples tienen un orden de enlace de uno, y los enlaces múltiples con órdenes de enlace de dos (un enlace doble) y tres (un enlace triple) son bastante comunes. En compuestos estrechamente relacionados con enlaces entre los mismos tipos de átomos, el enlace con el orden de enlace más alto es tanto el más corto como el más fuerte. En los enlaces con el mismo orden de enlace entre diferentes átomos, se observan tendencias que, con pocas excepciones, dan como resultado que se formen los enlaces simples más fuertes entre los átomos más pequeños. Los valores tabulados de las energías de enlace promedio se pueden usar para calcular el cambio de entalpía de muchas reacciones químicas. Si los enlaces en los productos son más fuertes que los de los reactivos, la reacción es exotérmica y viceversa.
Colaboradores
-
Mike Blaber ( Florida State University )
- Wikipedia