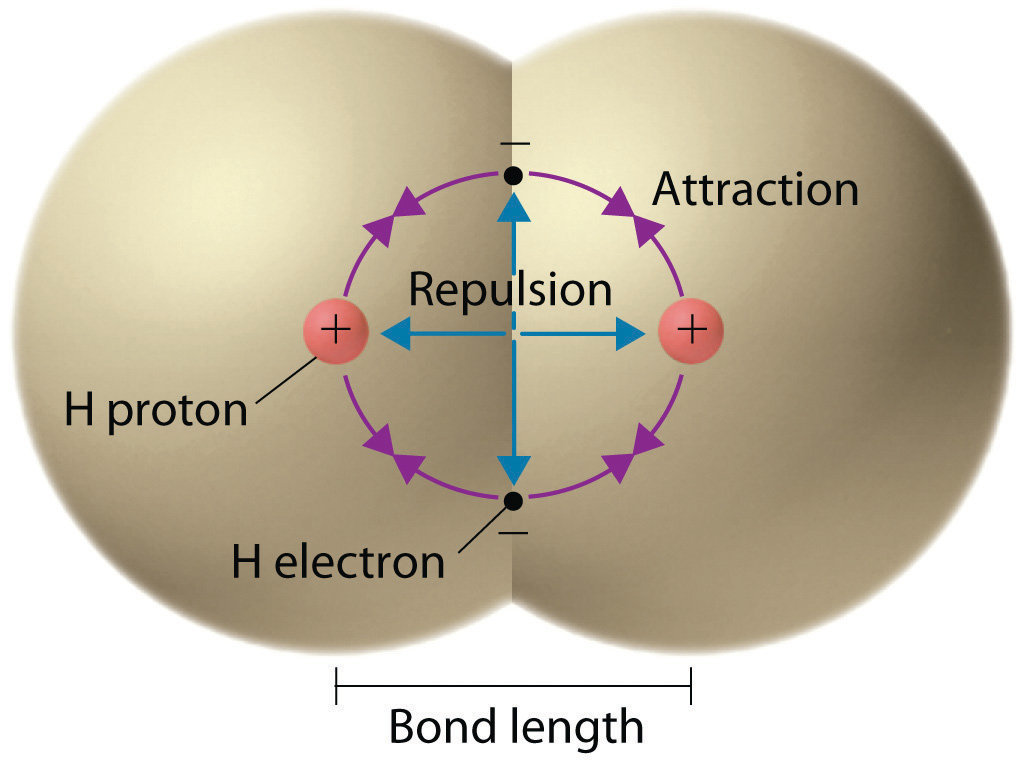
Comenzamos nuestra discusión sobre la relación entre estructura y enlace en compuestos covalentes describiendo la interacción entre dos átomos neutros idénticos, por ejemplo, la molécula H 2 , que contiene un enlace puramente covalente. Cada átomo de hidrógeno en H 2 contiene un electrón y un protón, con el electrón atraído al protón por las fuerzas electrostáticas. A medida que se unen los dos átomos de hidrógeno, se deben considerar interacciones adicionales (Figura ( PageIndex {1} )):
- Los electrones en los dos átomos se repelen entre sí porque tienen la misma carga (E> 0).
- Del mismo modo, los protones en los átomos adyacentes se repelen entre sí ( E > 0).
- El electrón en un átomo es atraído por el protón con carga opuesta en el otro átomo y viceversa ( E <0). Recuerde que es imposible especificar con precisión la posición del electrón en cualquiera de los átomos de hidrógeno. Por lo tanto, se deben utilizar las distribuciones de probabilidad mecánica cuántica.
Una gráfica de la energía potencial del sistema en función de la distancia internuclear (Figura ( PageIndex {2} )) muestra que el sistema se vuelve más estable (la energía del sistema disminuye) a medida que dos átomos de hidrógeno moverse uno hacia el otro desde r = ∞, hasta que la energía alcance un mínimo en r = r 0 (la distancia internuclear observada en H 2 es 74 pm). Por lo tanto, a distancias intermedias, dominan las interacciones atractivas protón-electrón, pero a medida que la distancia se vuelve muy corta, las interacciones repulsivas electrón-electrón y protón-protón hacen que la energía del sistema aumente rápidamente. Observe la similitud entre las Figuras ( PageIndex {1} ) y ( PageIndex {2} ), que describe un sistema que contiene dos iones con carga opuesta . Las formas de las curvas de energía versus distancia en las dos figuras son similares porque ambas resultan de fuerzas atractivas y repulsivas entre entidades cargadas.
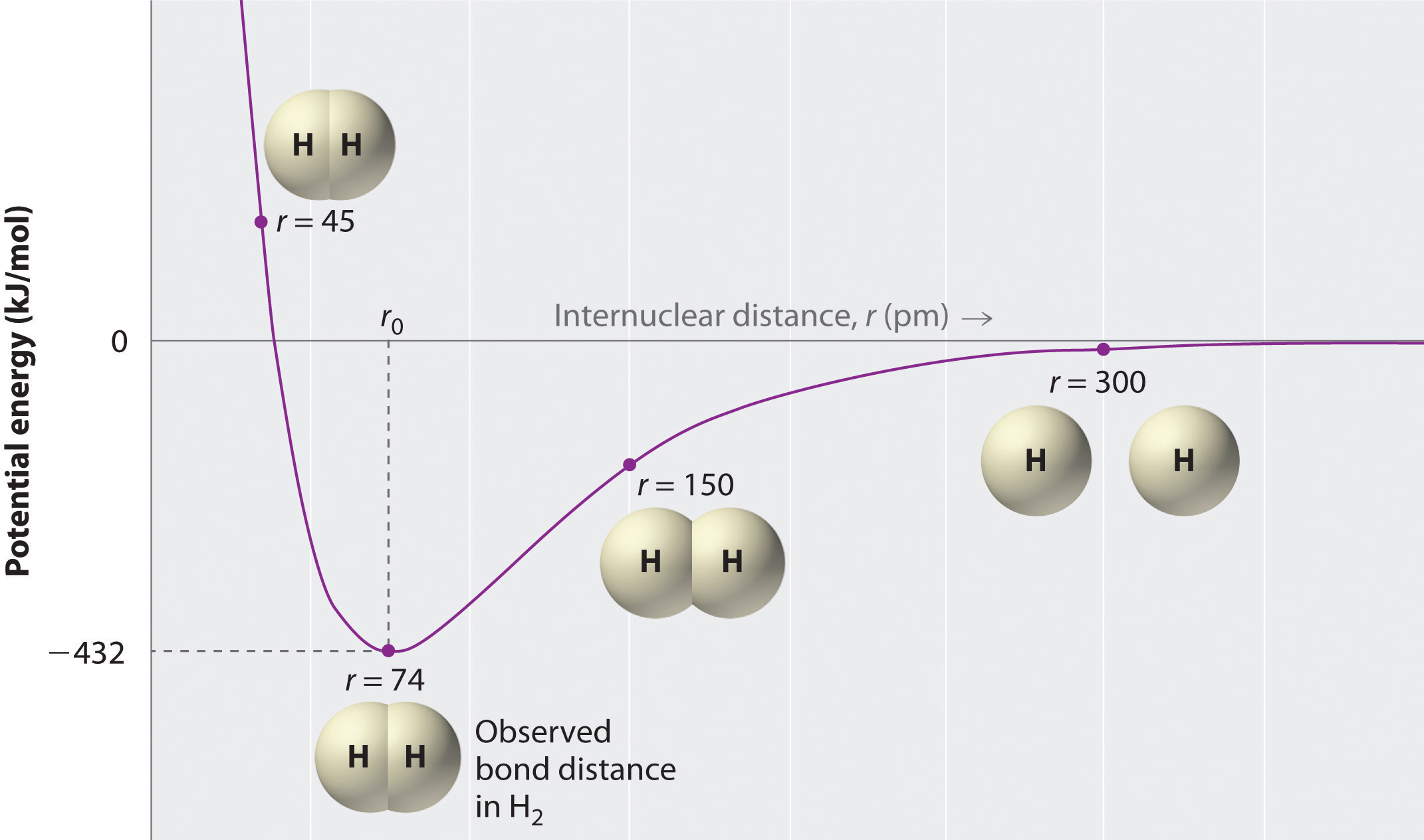
A largas distancias, las interacciones atractivas y repulsivas son pequeñas. A medida que disminuye la distancia entre los átomos, dominan las interacciones atractivas entre electrones y protones, y disminuye la energía del sistema. A la distancia de enlace observada, las interacciones repulsivas electrón-electrón y protón-protón solo equilibran las interacciones atractivas, evitando una mayor disminución en la distancia internuclear. A distancias internucleares muy cortas, dominan las interacciones repulsivas, haciendo que el sistema sea menos estable que los átomos aislados.
Uso de símbolos Lewis Dot para describir la unión covalente
Las configuraciones electrónicas de valencia de los átomos constituyentes de un compuesto covalente son factores importantes para determinar su estructura, estequiometría y propiedades. Por ejemplo, el cloro, con siete electrones de valencia, es un electrón corto de un octeto. Si dos átomos de cloro comparten sus electrones desapareados formando un enlace covalente y formando Cl 2 , cada uno puede completar su capa de valencia:
Cada átomo de cloro ahora tiene un octeto. El par de electrones que comparten los átomos se llama par de enlace; Los otros tres pares de electrones en cada átomo de cloro se llaman pares solitarios. Los pares solitarios no están involucrados en la unión covalente. Si ambos electrones en un enlace covalente provienen del mismo átomo, el enlace se llama enlace covalente coordinado. En la Sección 8.6 se presentan ejemplos de este tipo de enlaces cuando discutimos átomos con menos de un octeto de electrones.
Podemos ilustrar la formación de una molécula de agua a partir de dos átomos de hidrógeno y un átomo de oxígeno utilizando símbolos de puntos de Lewis:
La estructura de la derecha es la estructura de electrones de Lewis , o estructura de Lewis , para H 2 O. Con dos pares de enlace y dos pares solitarios, El átomo de oxígeno ha completado su octeto. Además, al compartir un par de enlace con oxígeno, cada átomo de hidrógeno ahora tiene una capa de valencia completa de dos electrones. Los químicos generalmente indican un par de enlace por una sola línea, como se muestra aquí para nuestros dos ejemplos:
El siguiente procedimiento se puede utilizar para construir estructuras electrónicas de Lewis para moléculas e iones más complejos:
- Organizar los átomos para mostrar conexiones específicas. Cuando hay un átomo central, generalmente es el elemento menos electronegativo del compuesto. Los químicos generalmente enumeran este átomo central primero en la fórmula química (como en CCl 4 y CO 3 2− , que tienen C como átomo central), que es otra pista de la estructura del compuesto. El hidrógeno y los halógenos casi siempre están conectados a otro átomo, por lo que generalmente son terminales en lugar de centrales.
- Determine el número total de electrones de valencia en la molécula o ion. Sume los electrones de valencia de cada átomo. (Recuerde que el número de electrones de valencia está indicado por la posición del elemento en la tabla periódica). Si la especie es un ion poliatómico, recuerde sumar o restar el número de electrones necesarios para dar la carga total en el ion. Para CO 3 2− , por ejemplo, agregamos dos electrones al total debido a la carga de −2.
- Coloque un par de electrones de enlace entre cada par de átomos adyacentes para dar un solo enlace. En H 2 O, por ejemplo, hay un par de electrones de enlace entre el oxígeno y cada hidrógeno.
- Comenzando con los átomos terminales, agregue suficientes electrones a cada átomo para dar a cada átomo un octeto (dos para hidrógeno). Estos electrones generalmente serán pares solitarios.
- Si quedan electrones, colóquelos en el átomo central. Explicaremos más adelante que algunos átomos pueden acomodar más de ocho electrones.
- Si el átomo central tiene menos electrones que un octeto, use pares solitarios de átomos terminales para formar enlaces múltiples (dobles o triples) al átomo central para lograr un octeto. Esto no cambiará el número de electrones en los átomos terminales.
Ahora apliquemos este procedimiento a algunos compuestos particulares, comenzando con uno que ya hemos discutido.
La molécula (H_2O )
- Debido a que los átomos de H son casi siempre terminales, la disposición dentro de la molécula debe ser HOH.
- Cada átomo de H (grupo 1) tiene 1 electrón de valencia, y el átomo de O (grupo 16) tiene 6 electrones de valencia, para un total de 8 electrones de valencia.
- Al colocar un par de electrones de enlace entre el átomo de O y cada átomo de H se obtiene H: O: H, con 4 electrones sobrantes.
- Cada átomo de H tiene una capa de valencia completa de 2 electrones.
- Al agregar los 4 electrones restantes al oxígeno (como dos pares solitarios) se obtiene la siguiente estructura:
Esta es la estructura de Lewis que dibujamos anteriormente. Debido a que le da al oxígeno un octeto y a cada hidrógeno dos electrones, no necesitamos usar el paso 6.
El (OCl ^ – ) Ion
- Con solo dos átomos en la molécula, no hay un átomo central.
- El oxígeno (grupo 16) tiene 6 electrones de valencia, y el cloro (grupo 17) tiene 7 electrones de valencia; debemos agregar uno más para la carga negativa en el ion, dando un total de 14 electrones de valencia.
- Al colocar un par de electrones de enlace entre O y Cl se obtiene O: Cl, con 12 electrones sobrantes.
- Si colocamos seis electrones (como tres pares solitarios) en cada átomo, obtenemos la siguiente estructura:
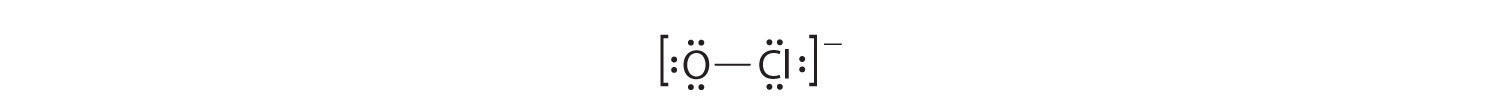
Cada átomo ahora tiene un octeto de electrones, por lo que los pasos 5 y 6 no son necesarios. La estructura de electrones de Lewis se dibuja entre paréntesis como es habitual para un ion, con la carga general indicada fuera de los paréntesis, y el par de electrones de enlace se indica mediante una línea continua. OCl – es el ion hipoclorito, el ingrediente activo en el blanqueador de cloro y desinfectante de piscinas.
La molécula (CH_2O )
1. Debido a que el carbono es menos electronegativo que el oxígeno y el hidrógeno es normalmente terminal, C debe ser el átomo central. Una posible disposición es la siguiente:

2. Cada átomo de hidrógeno (grupo 1) tiene un electrón de valencia, el carbono (grupo 14) tiene 4 electrones de valencia y el oxígeno (grupo 16) tiene 6 electrones de valencia, para un total de [(2) (1) + 4 + 6] = 12 electrones de valencia.
3. Al colocar un par de electrones de enlace entre cada par de átomos unidos se obtiene lo siguiente:

Se utilizan seis electrones y quedan 6.
4. Al agregar los 6 electrones restantes al oxígeno (como tres pares solitarios) se obtiene lo siguiente:

Aunque el oxígeno ahora tiene un octeto y cada hidrógeno tiene 2 electrones, el carbono tiene solo 6 electrones.
5. No quedan electrones para colocar en el átomo central.
6. Para dar al carbono un octeto de electrones, utilizamos uno de los pares de electrones solitarios en el oxígeno para formar un doble enlace carbono-oxígeno:

Tanto el oxígeno como el carbono ahora tienen un octeto de electrones, por lo que esta es una estructura de electrones de Lewis aceptable. El O tiene dos pares de enlaces y dos pares solitarios, y C tiene cuatro pares de enlaces. Esta es la estructura del formaldehído, que se utiliza en el líquido de embalsamamiento.
Se puede dibujar una estructura alternativa con una H unida a O. Las cargas formales , discutidas más adelante en esta sección, sugieren que dicha estructura es menos estable que la mostrada anteriormente.
Uso de estructuras de electrones de Lewis para explicar la estequiometría
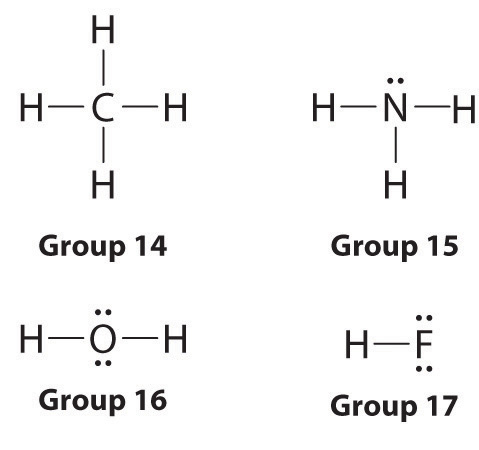
Los símbolos de puntos de Lewis proporcionan una racionalización simple de por qué los elementos forman compuestos con las estequiometrías observadas. En el modelo de Lewis, el número de enlaces formados por un elemento en un compuesto neutro es el mismo que el número de electrones no apareados que debe compartir con otros átomos para completar su octeto de electrones. Para los elementos del Grupo 17 (los halógenos) , este número es uno; para los elementos del Grupo 16 (los calcógenos) , son dos; para elementos del Grupo 15 , tres; y para Grupo 14 elementos cuatro. Estos requisitos se ilustran mediante las siguientes estructuras de Lewis para los hidruros de los miembros más ligeros de cada grupo:
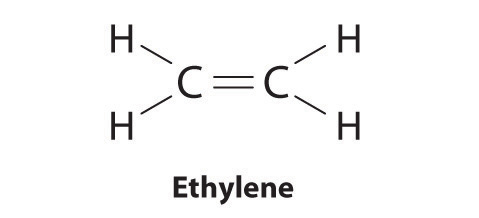
Los elementos pueden formar enlaces múltiples para completar un octeto. En etileno, por ejemplo, cada carbono aporta dos electrones al doble enlace, dando a cada carbono un octeto (dos electrones / enlace × cuatro enlaces = ocho electrones). Existen estructuras neutrales con menos o más enlaces, pero son inusuales y violan la regla del octeto.
Los alótropos de un elemento pueden tener propiedades físicas y químicas muy diferentes debido a las diferentes disposiciones tridimensionales de los átomos; Sin embargo, el número de enlaces formados por los átomos componentes es siempre el mismo. Como se señaló al comienzo del capítulo, el diamante es un sólido duro y transparente; el grafito es un sólido negro suave; y los fullerenos tienen estructuras de jaula abiertas. A pesar de estas diferencias, los átomos de carbono en los tres alótropos forman cuatro enlaces, de acuerdo con la regla del octeto.
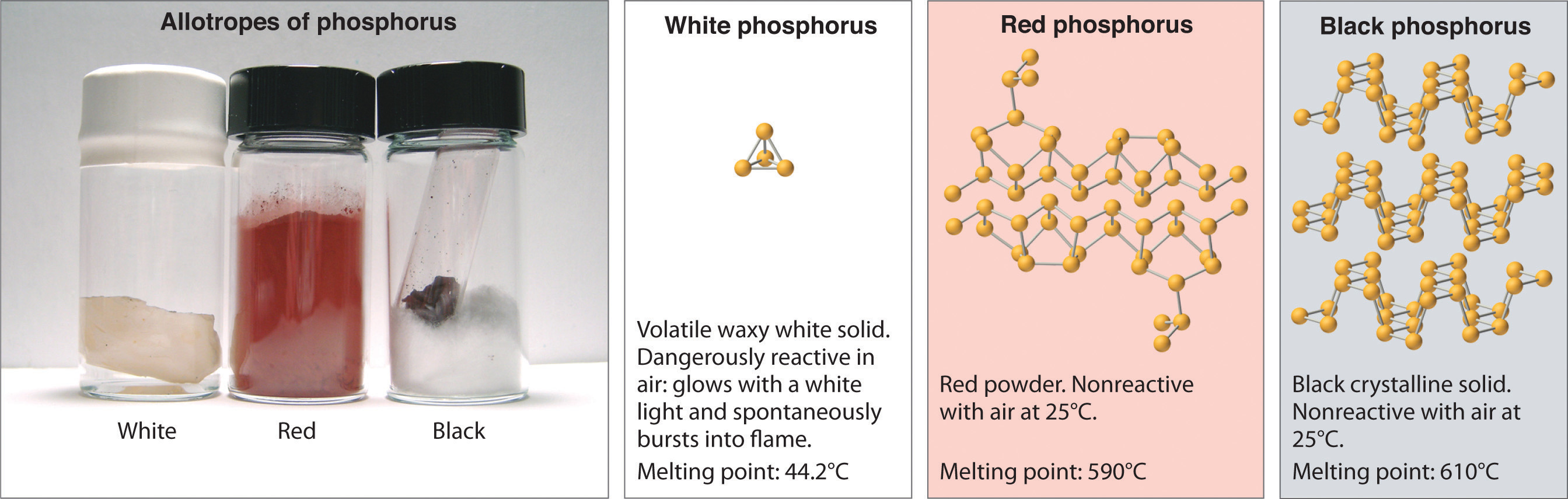
El fósforo elemental también existe en tres formas: fósforo blanco, una sustancia tóxica y cerosa que inicialmente brilla y luego se enciende espontáneamente en contacto con el aire; fósforo rojo, una sustancia amorfa que se usa comercialmente en fósforos de seguridad, fuegos artificiales y bombas de humo; y fósforo negro, un sólido cristalino no reactivo con una textura similar al grafito (Figura ( PageIndex {3} )). No obstante, los átomos de fósforo en las tres formas obedecen la regla del octeto y forman tres enlaces por átomo de fósforo.
Cargos formales
A veces es posible escribir más de una estructura de Lewis para una sustancia que no viola la regla del octeto, como vimos para CH 2 O, pero no todas las estructuras de Lewis pueden ser igualmente razonables. En estas situaciones, podemos elegir la estructura de Lewis más estable considerando la carga formal en los átomos, que es la diferencia entre el número de electrones de valencia en el átomo libre y el número asignado a él en Lewis estructura de electrones. La carga formal es una forma de calcular la distribución de carga dentro de una estructura de Lewis; La suma de las cargas formales en los átomos dentro de una molécula o un ion debe ser igual a la carga total en la molécula o el ion. Una carga formal no representa una carga verdadera en un átomo en un enlace covalente, sino que simplemente se usa para predecir la estructura más probable cuando un compuesto tiene más de una estructura de Lewis válida.
Para calcular las cargas formales, asignamos electrones en la molécula a átomos individuales de acuerdo con estas reglas:
- Los electrones no enlazantes se asignan al átomo en el que se encuentran.
- Los electrones de enlace se dividen en partes iguales entre los átomos unidos.
Para cada átomo, calculamos una carga formal:
( begin {matrix}
formal; carga = & valencia ; e ^ {-} – & left (sin enlace ; e ^ {-} + frac {enlace ; e ^ {-}} {2} right) \
& ^ { left (libre ; átomo derecha)} & ^ { left (átomo ; en ; Lewis ; estructura derecha)}
end {matrix} label {8.5.1} ) (átomo en estructura de Lewis)
Para ilustrar este método, calculemos la carga formal de los átomos en amoníaco (NH 3 ) cuya estructura de electrones de Lewis es la siguiente:
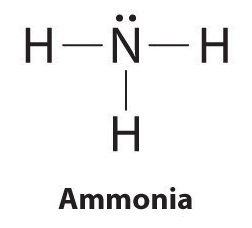
Un átomo de nitrógeno neutro tiene cinco electrones de valencia (está en el grupo 15). A partir de su estructura de electrones de Lewis, el átomo de nitrógeno en el amoníaco tiene un par solitario y comparte tres pares de enlaces con los átomos de hidrógeno, por lo que al nitrógeno se le asigna un total de cinco electrones [2 no unidos e – + (6 enlaces e – / 2)]. Sustituyendo en la ecuación ( ref {8.5.2} ), obtenemos
[formal ; carga izquierda (N derecha) = 5 ; valencia; e ^ {-} – left (2 ; non-bonding ; e ^ {-} + dfrac {6 ; bonding ; e ^ {-}} {2} right) = 0 label {8.5 .2} ]
Un átomo de hidrógeno neutro tiene un electrón de valencia. Cada átomo de hidrógeno en la molécula comparte un par de electrones de enlace y, por lo tanto, se le asigna un electrón [0 no enlazante e – + (2 enlaces e – / 2)]. Usando la ecuación ( ref {8.5.2} ) para calcular la carga formal en hidrógeno, obtenemos
[formal ; carga izquierda (H derecha) = 1 ; valencia; e ^ {-} – left (0 ; non-bonding ; e ^ {-} + dfrac {2 ; bonding ; e ^ {-}} {2} right) = 0 label {8.5 .3} ]
Los átomos de hidrógeno en el amoníaco tienen el mismo número de electrones que los átomos de hidrógeno neutros, por lo que su carga formal también es cero. Sumar las cargas formales debería darnos la carga general de la molécula o ion. En este ejemplo, el nitrógeno y cada hidrógeno tienen una carga formal de cero. Cuando se suma, la carga total es cero, lo que es consistente con la carga general en la molécula NH 3 .
Típicamente, la estructura con más cargas en los átomos más cercanos a cero es la estructura de Lewis más estable. En los casos en que hay cargas formales positivas o negativas en varios átomos, las estructuras estables generalmente tienen cargas formales negativas en los átomos más electronegativos y cargas formales positivas en los átomos menos electronegativos. El siguiente ejemplo demuestra además cómo calcular los cargos formales.
Uso de cargas formales para distinguir estructuras viables de Lewis
Como ejemplo de cómo se pueden usar las cargas formales para determinar la estructura de Lewis más estable para una sustancia, podemos comparar dos estructuras posibles para CO 2 . Ambas estructuras se ajustan a las reglas para las estructuras electrónicas de Lewis.
CO 2
- C es menos electronegativo que O, por lo que es el átomo central.
- C tiene 4 electrones de valencia y cada O tiene 6 electrones de valencia, para un total de 16 electrones de valencia.
- Al colocar un par de electrones entre la C y cada O se obtiene O – C – O, con 12 electrones sobrantes.
- Al dividir los electrones restantes entre los átomos de O se obtienen tres pares solitarios en cada átomo:
Esta estructura tiene un octeto de electrones alrededor de cada átomo de O pero solo 4 electrones alrededor del átomo de C.
- No quedan electrones para el átomo central.
- Para darle al átomo de carbono un octeto de electrones, podemos convertir dos de los pares solitarios en los átomos de oxígeno en pares de electrones de enlace. Sin embargo, hay dos formas de hacer esto. Podemos tomar un par de electrones de cada oxígeno para formar una estructura simétrica o tomar ambos pares de electrones de un solo átomo de oxígeno para dar una estructura asimétrica:
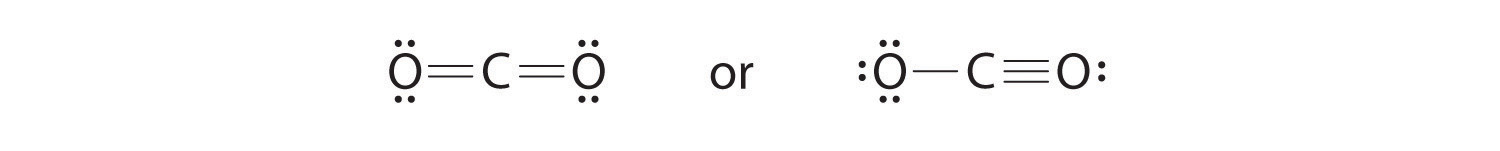
Ambas estructuras electrónicas de Lewis dan a los tres átomos un octeto. ¿Cómo decidimos entre estas dos posibilidades? Los cargos formales para las dos estructuras electrónicas de Lewis de CO 2 son las siguientes:
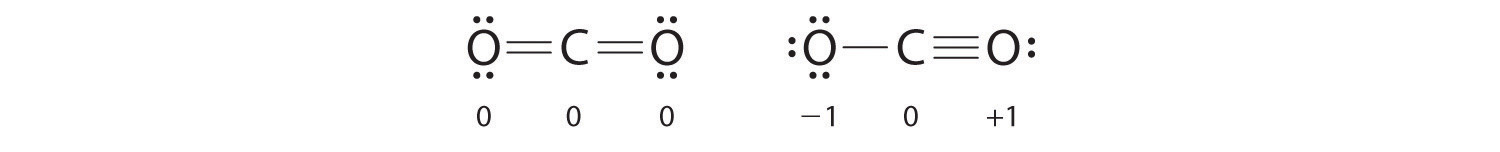
Ambas estructuras de Lewis tienen una carga formal neta de cero, pero la estructura de la derecha tiene una carga +1 en el átomo más electronegativo (O). Por lo tanto, se predice que la estructura simétrica de Lewis a la izquierda será más estable y, de hecho, es la estructura observada experimentalmente. Sin embargo, recuerde que las cargas formales no representan las cargas reales en los átomos de una molécula o ion. Se usan simplemente como un método de contabilidad para predecir la estructura de Lewis más estable para un compuesto.
Resumen
Los símbolos de puntos de Lewis proporcionan una racionalización simple de por qué los elementos forman compuestos con las estequiometrías observadas. Una gráfica de la energía total de un enlace covalente en función de la distancia internuclear es idéntica a una gráfica de un par iónico porque ambos resultan de fuerzas atractivas y repulsivas entre entidades cargadas. En las estructuras electrónicas de Lewis, encontramos pares de enlace , que son compartidos por dos átomos, y pares solitarios , que no son compartidos entre átomos. Si ambos electrones en un enlace covalente provienen del mismo átomo, el enlace se llama enlace covalente coordinado . Las estructuras de Lewis son un intento de racionalizar por qué ciertas estequiometrías se observan comúnmente para los elementos de familias particulares. Los compuestos neutros de los elementos del grupo 14 típicamente contienen cuatro enlaces alrededor de cada átomo (un doble enlace cuenta como dos, un triple enlace como tres), mientras que los compuestos neutros de los elementos del grupo 15 típicamente contienen tres enlaces. En los casos en los que es posible escribir más de una estructura de electrones de Lewis con octetos alrededor de todos los átomos no de hidrógeno de un compuesto, se debe considerar la carga formal en cada átomo en estructuras alternativas para decidir cuál de las estructuras válidas puede ser excluido y cual es el más razonable. La carga formal es la diferencia entre el número de electrones de valencia del átomo libre y el número de electrones asignados a él en el compuesto, donde los electrones de enlace se dividen en partes iguales entre los átomos unidos. La estructura de Lewis con las cargas formales más bajas en los átomos es casi siempre la más estable.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )
Estructuras De Lewis
Estructura De Lewis En línea
Ch4 Composición De Lewis
Una estructura de Lewis es una representación estructural de una molécula donde los puntos se utilizan para mostrar las situaciones de los electrones alrededor de los átomos y las líneas o pares de puntos representan los enlaces covalentes entre los átomos.
El propósito de dibujar una estructura de puntos de Lewis es detectar los pares de electrones solitarios en las moléculas para contribuir a determinar la capacitación de links químicos.
Las construcciones de Lewis tienen la posibilidad de hacerse para moléculas que contienen enlaces covalentes y para compuestos de coordinación.
La razón es que los electrones se distribuyen en un enlace covalente.
En un enlace iónico, es más bien un átomo el que dona un electrón al otro átomo.
Una composición de Lewis es una representación estructural de una molécula donde se usan puntos para mostrar las posiciones de los electrones cerca de los átomos y las líneas o pares de puntos representan enlaces covalentes entre átomos.
Las construcciones de Lewis se pueden realizar para moléculas que contienen enlaces covalentes y para compuestos de coordinación.
En un link iónico, es más tal y como si un átomo donara un electrón al otro átomo.
Determine cuántos electrones se precisan para satisfacer la regla del octeto.La capa de electrones de valencia de hidrógeno y helio se llena con 2 electrones.
Para otros átomos, hasta el período 4 de la tabla periódica, la capa de valencia se llena con 8 electrones.
Cada link químico necesita 2 electrones, conque use dos electrones de valencia para formar cada link entre los átomos en la composición del esqueleto.
Para el NO3–, se utilizaron 6 electrones para dibujar los enlaces sencillos del esqueleto.
Empezando con el átomo mucho más electronegativo, distribuya estos electrones para intentar atestar los octetos de los átomos.
Una estructura de Lewis es un diagrama que exhibe los links químicos entre los átomos de una molécula y los electrones de valencia o pares de electrones solitarios.
El diagrama también lleva por nombre diagrama de puntos de Lewis, fórmula de puntos de Lewis o diagrama de puntos de electrones.
¿qué Es La Estructura De Lewis Y De qué manera Se Representa Con Ejemplos?
Las construcciones de Lewis toman su nombre de Gilbert N. Lewis, quien ingresó la teoría del link de valencia y las construcciones de puntos en el artículo de 1916The Atom and the Molecule.
Recurso educativo sobre enlace covalente, en el que trata la teoría electrónica de Lewis, la teoría de link de valencia, la hibridación de orbitales, la polaridad de los enlaces y de las moléculas y las construcciones de moléculas.
En el apartado de teoría electrónica de Lewis tiene que ver con la geometría molecular usando del modelo de repulsión de los pares electrónicos de la capa de valencia .
Este recurso tiene dentro actividades para asistir al alumno a comprender mejor lo aprendido en los diferentes apartados del mismo.
Contiene una animación sobre sustancias moleculares de Paco Gibanel y Germán Tomás para cuyo acertado funcionamiento se requiere Java.
Esta contiene 26 substancias de las cuales puede mostrar el diagrama de Lewis, su geometría en dependencia de la teoría RPECV o la de link de valencia, la imagen en 3D, la polaridad y las fuerzas intermoleculares.
Este recurso se puede imprimir en formato pdf, bien en su totalidad o un resumen del mismo.
Este último lo tenemos la posibilidad de conseguir también en formato presentación.
Ten en cuenta que hay algunos casos en los que la mejor estructura de Lewis tiene un octeto incompleto en un átomo central.
Dado que a menudo es posible dibujar más de una composición de Lewis válida para una molécula o ión molecular, necesitaremos evaluar cuáles son mucho más plausibles o tienen mejor sentido químico.
Como se apuntó previamente, cargo formal se utiliza como una guía en el sentido de que el total de cargas formales cero o un mínimo es generalmente mejor, y la carga formal de un átomo se considera en relación con su electronegatividad.
Recuerde, una composición de Lewis no es la molécula, sino solo un simbolismo taquigráfico que pretende transmitir alguna información sobre ella.
Ejercicio Enlace Químico 4: Estructuras De Lewis De Algunas Moléculas Covalentes Fáciles Sin Resonancia
Dicha información informa la predicción de las probables propiedades físicas o químicas de la molécula real o de la substancia a granel que se compone de esas moléculas.
Entre los usos más comunes que hacemos de una estructura de Lewis válida (y para ello no necesitamos la mejor composición de Lewis, solo alguno válida ) es adivinar la manera molecular y la polaridad.
La carga formal del átomo es calculada como la diferencia entre el número de electrones de valencia que un átomo neutro podría tener y el número de electrones que pertenecen a el en la composición de Lewis.
Los electrones en los enlaces covalentes son divididos equitativamente entre los átomos involucrados en el enlace.
El total de las cargas formales en un ion ha de ser igual a la carga del ion, y el total de las cargas formales en una molécula neutra debe ser igual a cero.
Se puede dibujar una estructura de Lewis para cualquier covalentemente molécula unida, así como compuestos de coordinación.
La composición de Lewis recibió su nombre Gilbert N. Lewis, quien lo ingresó en su producto de 1916 El átomo y la molécula.
Las estructuras de Lewis amplían el término de diagrama de puntos de electrones añadiendo líneas entre átomos para representar pares compartidos en un link químico.
Las estructuras de Lewis son representaciones electrónicas de una molécula, donde se simboliza mediante diferentes signos, que forman parejas, el número de electrones de la cubierta de valencia de los elementos.
Los electrones que están en zonas comunes a dos átomos son los que forman el link químico.
Estas estructuras nos dan un concepto acerca de los tipos de enlace.
Una estructura de Lewis es una representación muy simplificada de los electrones de la cubierta de valencia de una molécula.
Se utiliza para enseñar cómo están preparados los electrones cerca de los átomos individuales de una molécula.
Los electrones se detallan como «puntos» o, en la situacion de los electrones de link, como una línea entre los dos átomos.
Moléculas En La Composición De Lewis
La meta es obtener la «mejor» configuración de los electrones, o sea, hay que cumplir la regla del octeto y las cargas formales.
Las construcciones de Lewis ayudan a detallar los estados de valencia, link químico y oxidación porque muchos átomos llenan o llenan la mitad de su cubierta de valencia.
El accionar descrito por las estructuras se acerca bastante al comportamiento real de los elementos más ligeros, que tienen ocho electrones de valencia.
Por lo tanto, son particularmente útiles en química orgánica y bioquímica, que se basa en el comportamiento del carbono, el hidrógeno y el oxígeno.
Si bien las estructuras de Lewis no necesariamente muestran geometría, se utilizan para adivinar geometría, reactividad y polaridad.
Las estructuras químicas se pueden escribir en formas más compactas, especialmente en el momento en que se muestran moléculas orgánicas.
En fórmulas estructurales condensadas, muchos o incluso todos los links covalentes pueden omitirse, con subíndices que indican el número de conjuntos idénticos unidos a un átomo en particular.
Otro diagrama estructural abreviado es el fórmula esquelética (asimismo conocido como fórmula de línea de link o diagrama de esqueleto de carbono).
En una fórmula esquelética, los átomos de carbono no están representados por el símbolo C sino por el vértices de las líneas.
Para algunas moléculas y también iones, es bien difícil saber qué pares solitarios deben moverse para formar links dobles o triples, y 2 o mucho más distintas.
Resonancia las construcciones se pueden escribir para exactamente la misma molécula o ion.
En semejantes casos, es frecuente escribirlos todos con flechas de 2 direcciones en el medio (consulte el ejemplo ahora).
Teoría De Lewis Link Químico Teoría De Lewis Enlace Iónico Enlac Enlac Co V Co Al A Y también L Nte
Este es en ocasiones el caso en el momento en que varios átomos del mismo tipo rodean al átomo central, y es en especial común para los iones poliatómicos.
La carga formal de un átomo se calcula como la diferencia entre el número de electrones de valencia que tendría un átomo neutro y el número de electrones que le pertenecen en la estructura de Lewis.
Los electrones en links covalentes se dividen por igual entre los átomos comprometidos en el link.
El total de las cargas formales de un ion debe ser igual a la carga del ion, y el total de las cargas formales de una molécula neutra ha de ser igual a cero.
Agrega los pares sobrantes de electrones al átomo central para que su octeto esté terminado (si aún no lo está).
¡Jamás excedas un octeto para un átomo de período 2!
Para períodos 3 y mayores, los átomos son suficientemente enormes como para acomodar más de un octeto en su capa de enlace de valencia.
Si no hay más electrones libres y el central todavía no posee un octeto terminado, unos cuantos solitario en un átomo periférico puede ser empujado hacia un segundo link con el átomo central.
El carbono y el nitrógeno son elementos del segundo período que generalmente forman links dobles y triples como átomos centrales, y el oxígeno como átomo periférico está a menudo en un enlace doble con el átomo central.
Las construcciones químicas tienen la posibilidad de ser escritas de formas mucho más compactas, especialmente en el momento en que se está mostrando moléculas orgánicas.
En fórmulas estructurales condensadas, muchas o aun todas los enlaces covalentes tienen la posibilidad de ser dejados afuera, con los subíndices indicando el número de los conjuntos idénticos socios a un átomo preciso.
Otra forma fácil de diagrama estructural es la fórmula esquelética (asimismo conocida como la fórmula de la línea de enlace o el diagrama esquelético del carbón).
En fórmulas esqueléticas, los átomos de carbón no se escriben con la letra C sino son los vértices de las líneas.
Los dos átomos de oxígeno tienen asignados en la actualidad 8 electrones.
El átomo de nitrógeno tiene asignados solo 6 electrones.
Entre los pares solitarios de un átomo de oxígeno debe conformar un doble link, pero alguno de los dos átomos va a funcionar del mismo modo bien.
En la composición de resonancia de triple link del CO, el O tiene 5 electrones a su alrededor, lo que le da una carga formal +1.
O tiene el semejante a 3 pares de electrones solitarios para formar un enlace.
Si utiliza 1 par solitario de la predisposición 2, 2, 1, 1 para que O forme un enlace simple , entonces el O ha usado 2 electrones para conformar un link dejando 4 electrones no enlazados.
Si separa la O y la C rompiendo el vínculo, la O tendrá su 6 original.
Nuevamente, excede un octeto que no es válido para el período 2, no menos de un octeto.
Para algunas moléculas e iones, resulta bien difícil determinar cuáles pares solitarios han de ser movidos para formar links dobles o triples.
Este es, algunas veces, la situacion en el momento en que átomos múltiples del mismo tipo rodean el átomo central, y esto es en especial común para átomos poliatómicos, o sea átomos no esreocentros.
Cuando reaccionan dos átomos que necesitan electrones para adquirir la configuración electrónica de un gas noble y cumplir la regla del octeto, la única oportunidad es que compartan electrones.
Las construcciones electrónicas resultantes se los conoce como construcciones de Lewis y dejan explicar la capacitación de links covalentes.
Por lo tanto, prosiguen gozando de un empleo generalizado por parte de químicos y educadores de química.
El ion nitrato (NO3−), por ejemplo, debe conformar un doble enlace entre el nitrógeno y entre los oxígenos para agradar la regla del octeto para el nitrógeno.
Sin embargo, debido a que la molécula es simétrica, no importa cuales de los oxígenos forma el doble enlace.
En un caso así, hay tres posibles construcciones de resonancia.