
9.1: Formas moleculares
- ID de página
- 21751
El enfoque de pares de electrones de Lewis descrito anteriormente puede usarse para predecir el número y los tipos de enlaces entre los átomos en una sustancia, e indica qué átomos tienen pares de electrones solitarios. Sin embargo, este enfoque no proporciona información sobre la disposición real de los átomos en el espacio.
Geometría molecular
La disposición tridimensional específica de los átomos en las moléculas se denomina geometría molecular . También definimos la geometría molecular como las posiciones de los núcleos atómicos en una molécula. Existen varias técnicas instrumentales, como la cristalografía de rayos X y otras técnicas experimentales que se pueden utilizar para decirnos dónde se encuentran los átomos en una molécula. Usando técnicas avanzadas, se han determinado estructuras muy complicadas para proteínas, enzimas, ADN y ARN. La geometría molecular está asociada con la química de la visión, el olfato, el sabor, las reacciones a los medicamentos y las reacciones controladas por enzimas, por nombrar algunas.
Geometrías moleculares de moléculas (AB_n )
La geometría molecular está asociada con la orientación específica de los átomos de enlace. Un análisis cuidadoso de las distribuciones de electrones en los orbitales generalmente dará como resultado determinaciones correctas de la geometría molecular. Además, la simple escritura de diagramas de Lewis también puede proporcionar pistas importantes para la determinación de la geometría molecular. Las formas moleculares, o geometrías, son críticas para el reconocimiento molecular y la función. La tabla ( PageIndex {1} ) muestra algunos ejemplos de geometrías en las que un átomo central (A ) está unido a dos o más átomos (X ). Como se indica en varias de las geometrías a continuación, los electrones no unidos ( E) pueden influir fuertemente en la geometría molecular de la molécula; esto se discute con más detalles en Sección 9.2 .
| 6 | 5 | 4 | 3 | 2 |
|---|---|---|---|---|
AX 6 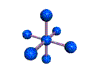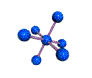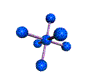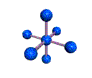 octaédrico |
AX 5 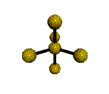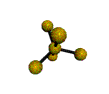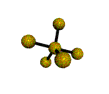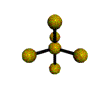 trigonal bipiramidal |
AX 4 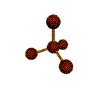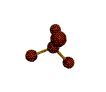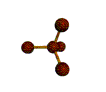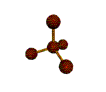 tetraédrica |
AX 3 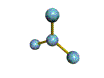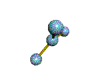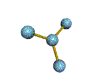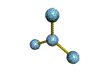 plano trigonal |
AX 2  lineal |
| 1 par solitario de electrones | ||||
AX 5 E 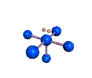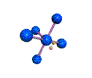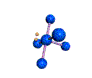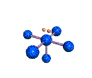 piramidal cuadrada |
AX 4 E 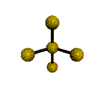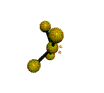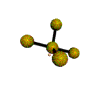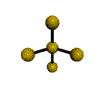 tetraedro distorsionado |
AX 3 E 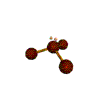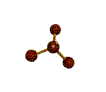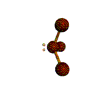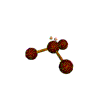 piramidal |
AX 2 E 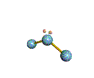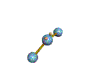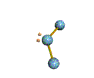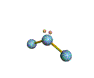 no lineal |
AX  lineal |
| 2 pares de electrones solitarios | ||||
AX 4 E 2 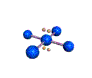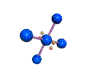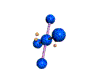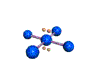 plano cuadrado |
AX 3 E 2 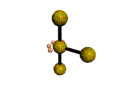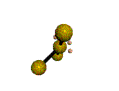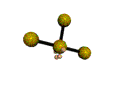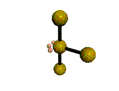 En forma de T |
AX 2 E 2 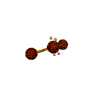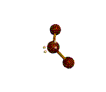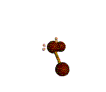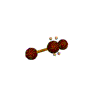 doblado |
AX 2  lineal |
|
Estas estructuras generalmente se pueden predecir, cuando A no es un metal, utilizando el “modelo de repulsión de pares de electrones de capa de valencia (VSEPR) discutido en la siguiente sección.
Colaboradores
-
Mike Blaber ( Florida State University )
- Robyn Rindge (Clase del 98) que ahora trabaja para PDI Dreamworks (busque su nombre en los créditos de Shrek2.). Robyn dibujó estas moléculas giratorias usando Infini-D (MetaCreations).
- Paul Groves, profesor de química en South Pasadena High School y Chemmy Bear