
9.3: Forma molecular y polaridad molecular
- ID de página
- 21753
Anteriormente, describimos los dos extremos idealizados de la unión química:
- enlace iónico , en el que uno o más electrones se transfieren completamente de un átomo a otro, y los iones resultantes se mantienen unidos por fuerzas puramente electrostáticas, y
- enlace covalente , en el que los electrones se comparten por igual entre dos átomos.
Sin embargo, la mayoría de los compuestos tienen enlaces covalentes polares , lo que significa que los electrones se comparten de manera desigual entre los átomos unidos. La Figura ( PageIndex {1} ) compara la distribución de electrones en un enlace covalente polar con aquellos en un enlace idealmente covalente e idealmente iónico. Recuerde que se usa un delta griego en minúscula ( ( delta )) para indicar que un átomo unido posee una carga positiva parcial, indicada por ( delta ^ + ), o una carga negativa parcial, indicada por ( delta ^ – ), y un enlace entre dos átomos que poseen cargas parciales es un enlace polar .
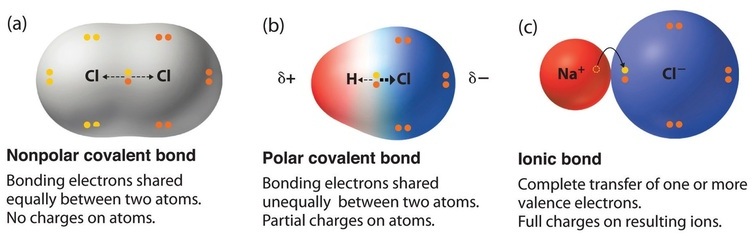
Polaridad de enlace
La polaridad de un enlace —la medida en que es polar— está determinada en gran medida por las electronegatividades relativas de los átomos unidos. Electronegatividad ( ( chi )) se definió como la capacidad de un átomo en una molécula o un ion para atraer electrones hacia sí mismo. Por lo tanto, existe una correlación directa entre la electronegatividad y la polaridad del enlace. Un enlace es no polar si los átomos unidos tienen electronegatividades iguales. Sin embargo, si las electronegatividades de los átomos unidos no son iguales, el enlace está polarizado hacia el átomo más electronegativo. Un enlace en el que la electronegatividad de B ( ( chi_B )) es mayor que la electronegatividad de A ( ( chi_A )), por ejemplo, se indica con la carga negativa parcial en el átomo más electronegativo: [19459015 ]
[ begin {matrix}
_{Menos; electronegativo} & & _ {más ; electronegativo} \
UNA; & – & B ; ; \
^ { delta ^ {+}} & & ^ { delta ^ {-}}
end {matrix} label {9.3.1}
onumber ]
Una forma de estimar el carácter iónico de un enlace, es decir, la magnitud de la separación de carga en un enlace covalente polar, es calcular la diferencia en la electronegatividad entre los dos átomos:
[Δ chi = chi_B – chi_A.
onumber ]
Para predecir la polaridad de los enlaces en Cl 2 , HCl y NaCl, por ejemplo, observamos las electronegatividades de los átomos relevantes ( Tabla A2 ): ( chi_ {Cl} = 3.16 ), ( chi_H = 2.20 ) y ( chi_ {Na} = 0.93 ). ( ce {Cl2} ) debe ser no polar porque la diferencia de electronegatividad ( (Δ chi )) es cero; por lo tanto, los dos átomos de cloro comparten los electrones de enlace por igual. En NaCl, (Δ chi ) es 2.23. Este alto valor es típico de un compuesto iónico ( (Δ chi ≥ ≈1.5 )) y significa que el electrón de valencia del sodio se ha transferido completamente al cloro para formar Na + y Cl – iones. Sin embargo, en HCl, (Δ chi ) es solo 0,96. Los electrones de enlace se sienten más atraídos por el átomo de cloro más electronegativo, por lo que la distribución de carga es
[ begin {matrix}
_ { delta ^ {+}} & & _ { delta ^ {-}} \
H ; ; & – & Cl
end {matriz}
onumber ]
Recuerde que las electronegatividades son difíciles de medir con precisión y las diferentes definiciones producen números ligeramente diferentes. En la práctica, la polaridad de un enlace generalmente se estima en lugar de calcularse.
Al igual que con las energías de enlace, la electronegatividad de un átomo depende en cierta medida de su entorno químico. Por lo tanto, es poco probable que las electronegatividades informadas de un átomo de cloro en ( ce {NaCl} ), ( ce {Cl2} ), ( ce {ClF5} ) y ( ce {HClO4 } ) sería exactamente lo mismo.
Momentos dipolares
La distribución de carga asimétrica en una sustancia polar como ( ce {HCl} ) produce un momento dipolar donde (Qr ) en metros ( (m )). se abrevia con la letra griega mu ( ( mu )). El momento dipolar se define como el producto de la carga parcial (Q ) en los átomos unidos y la distancia (r ) entre las cargas parciales:
[ mu = Qr label {9.3.2} ]
donde (Q ) se mide en culombios ( (C )) y (r ) en metros. La unidad para los momentos dipolares es el debye (D):
[1 ; D = 3.3356 por 10 ^ {- 30} ; C cdot m label {9.7.3} ]
Cuando una molécula con un momento dipolar se coloca en un campo eléctrico, tiende a orientarse con el campo eléctrico debido a su distribución de carga asimétrica (Figura ( PageIndex {2} )).
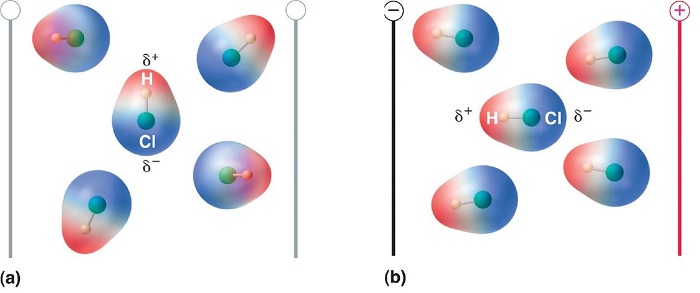
Podemos medir las cargas parciales en los átomos en una molécula como ( ce {HCl} ) usando la ecuación ref {9.3.2}. Si el enlace en ( ce {HCl} ) fuera puramente iónico, se transferiría un electrón de H a Cl, por lo que habría una carga completa de +1 en el átomo de H y una carga completa de −1 en el átomo de Cl . El momento dipolar de ( ce {HCl} ) es 1.109 D, según se determina midiendo el alcance de su alineación en un campo eléctrico, y la distancia H-Cl de fase gaseosa informada es 127.5 pm. Por lo tanto, la carga en cada átomo es
[ begin {align *} Q & = dfrac { mu} {r} \ [4pt] & = 1.109 ; cancel {D} left ( dfrac {3.3356 times 10 ^ { -30} ; C cdot cancel {m}} {1 ; cancel {D}} right) left ( dfrac {1} {127.8 ; cancel {pm}} right) left ( dfrac {1 ; cancel {pm}} {10 ^ {- 12 ;} cancel {m}} right) \ [4pt] & = 2.901 times 10 ^ {- 20} ; C label {9.7.4} end {align *} ]
Al dividir este valor calculado por la carga en un solo electrón (1.6022 × 10 −19 C), encontramos que la distribución de electrones en ( ce {HCl} ) es asimétrica y que efectivamente, parece que hay una carga negativa neta en ( ce {Cl} ) de aproximadamente −0.18, que corresponde a aproximadamente 0.18 e – . Esto ciertamente no significa que haya una fracción de un electrón en el átomo ( ce {Cl} ), sino que la distribución de la probabilidad de electrones favorece el lado del átomo de Cl de la molécula en aproximadamente esta cantidad.
[ dfrac {2.901 veces 10 ^ {- 20} ; cancel {C}} {1.6022 times 10 ^ {- 19} ; cancel {C}} = 0.1811 ; e ^ {-} label {9.7.5}
onumber ]
Para formar un compuesto neutro, la carga en el átomo ( ce {H} ) debe ser igual pero opuesta. Por lo tanto, el momento dipolar medido de ( ce {HCl} ) indica que el enlace H – Cl tiene aproximadamente un 18% de carácter iónico (0.1811 × 100), o un 82% de carácter covalente. En lugar de escribir ( ce {HCl} ) como
( begin {matrix}
_ { delta ^ {+}} & & _ { delta ^ {-}} \
H ; ; & – & Cl
end {matrix} )
por lo tanto, podemos indicar la separación de carga cuantitativamente como
( begin {matrix}
_ {0.18 delta ^ {+}} & & _ {0.18 delta ^ {-}} \
H ; ; & – & Cl
end {matrix} )
Nuestros resultados calculados están de acuerdo con la diferencia de electronegatividad entre hidrógeno y cloro ( ( chi_H = 2.20 ) y ( chi_ {Cl} = 3.16 )) así que
[ chi_ {Cl} – chi_H = 0.96 ]
Este es un valor dentro del rango de los enlaces covalentes polares. Indicamos el momento dipolar escribiendo una flecha sobre la molécula. Matemáticamente, los momentos dipolares son vectores, y poseen una magnitud y una dirección. El momento dipolar de una molécula es la suma vectorial de los dipolos de los enlaces individuales. En HCl, por ejemplo, el momento dipolar se indica de la siguiente manera:
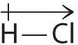
La flecha muestra la dirección del flujo de electrones apuntando hacia el átomo más electronegativo.
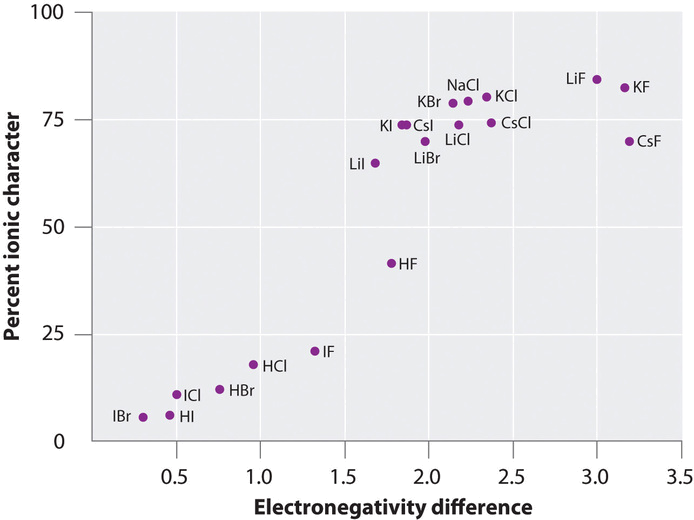
La carga en los átomos de muchas sustancias en la fase gaseosa se puede calcular utilizando momentos dipolares medidos y distancias de enlace. La Figura ( PageIndex {2} ) muestra una gráfica del porcentaje de carácter iónico versus la diferencia en la electronegatividad de los átomos unidos para varias sustancias. De acuerdo con el gráfico, la unión en especies como (NaCl _ {(g)} ) y (CsF _ {(g)} ) es sustancialmente menor al 100% de carácter iónico. Sin embargo, a medida que el gas se condensa en un sólido, las interacciones dipolo-dipolo entre especies polarizadas aumentan las separaciones de carga. En el cristal, por lo tanto, un electrón se transfiere del metal al no metal, y estas sustancias se comportan como compuestos iónicos clásicos. Los datos en la Figura ( PageIndex {2} ) muestran que las especies diatómicas con una diferencia de electronegatividad de menos de 1.5 tienen menos del 50% de carácter iónico, lo que es consistente con nuestra descripción anterior de estas especies que contienen enlaces covalentes polares. El uso de momentos dipolares para determinar el carácter iónico de un enlace polar se ilustra en el Ejemplo ( PageIndex {1} ).
Resumen
La polaridad de enlace y el carácter iónico aumentan con una diferencia creciente en la electronegatividad.
[ mu = Qr
onumber ]
Los compuestos con enlaces covalentes polares tienen electrones que se comparten de manera desigual entre los átomos unidos. La polaridad de dicho enlace está determinada en gran medida por las electronegativitas relativas de los átomos unidos. La distribución de carga asimétrica en una sustancia polar produce un momento dipolar , que es el producto de las cargas parciales en los átomos unidos y la distancia entre ellos.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )