
9.5: Orbitales híbridos
- ID de página
- 21755
La teoría del enlace de valencia localizada utiliza un proceso llamado hibridación , en el que los orbitales atómicos que son similares en energía pero no equivalentes se combinan matemáticamente para producir conjuntos de orbitales equivalentes que son adecuadamente orientado a formar enlaces. Estas nuevas combinaciones se denominan orbitales atómicos híbridos porque se producen combinando ( hibridando ) dos o más orbitales atómicos del mismo átomo.
Hibridación de s y p Orbitales
En BeH 2 , podemos generar dos orbitales equivalentes combinando el orbital 2 s de berilio y cualquiera de los tres orbitales degenerados 2 p . Al tomar la suma y la diferencia de Be 2 s y 2 p z orbitales atómicos, por ejemplo, producimos dos nuevos orbitales orbitales. con lóbulos mayores y menores orientados a lo largo de los ejes z , como se muestra en la Figura ( PageIndex {1} ).

Debido a que la diferencia A – B también se puede escribir como A + (−B), en la Figura ( PageIndex {2} ) y en las figuras posteriores hemos invertido la (s) fase (s) del ser orbital restado, que es lo mismo que multiplicarlo por -1 y sumar. Esto nos da la ecuación ref {9.5.1b}, donde el valor ( frac {1} { sqrt {2}} ) se necesita matemáticamente para indicar que los 2 s y 2 orbitales p contribuyen igualmente a cada orbital híbrido.
[sp = dfrac {1} { sqrt {2}} (2s + 2p_z) label {9.5.1a} ]
y
[sp = dfrac {1} { sqrt {2}} (2s – 2p_z) label {9.5.1b} ]
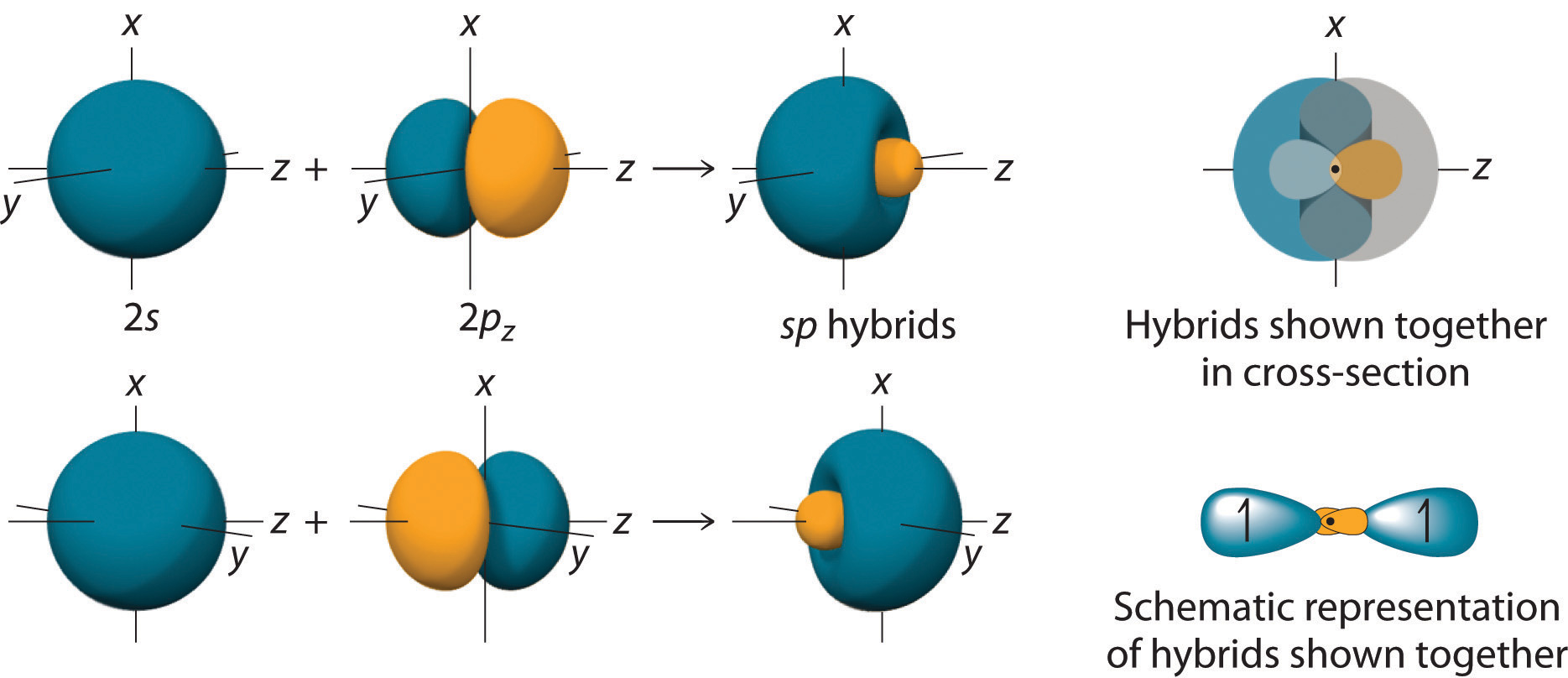
El núcleo reside justo dentro del lóbulo menor de cada orbital. En este caso, los nuevos orbitales se denominan híbridos sp porque están formados por uno s y un p orbital. Los dos nuevos orbitales son equivalentes en energía, y su energía está entre los valores de energía asociados con los orbitales puros s y p , como se ilustra en este diagrama:
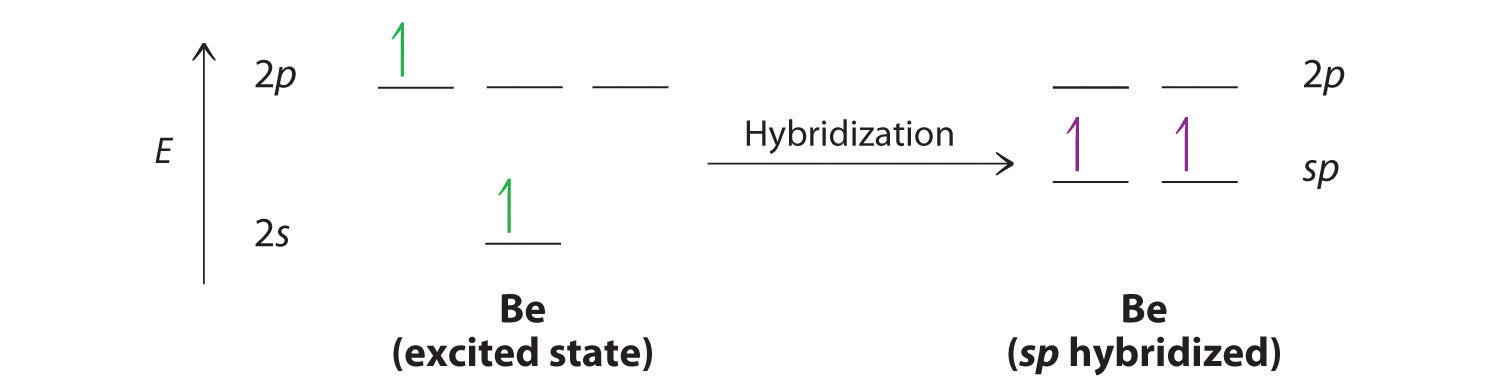
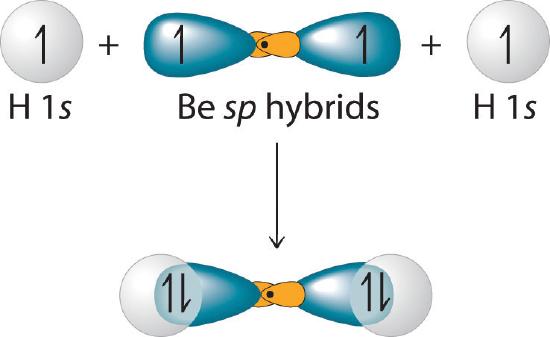
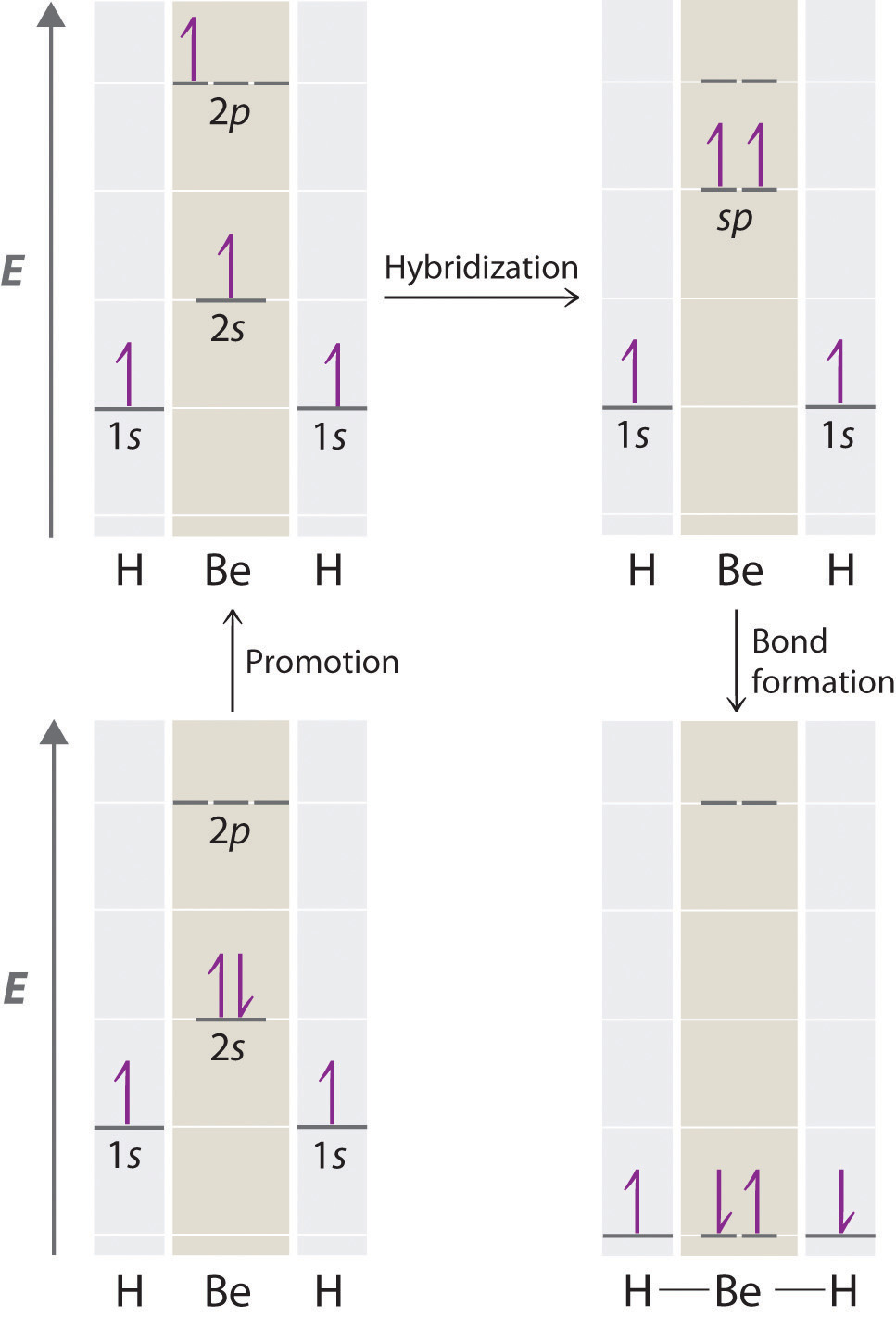
Debido a que tanto la promoción como la hibridación requieren un aporte de energía, la formación de un conjunto de orbitales atómicos híbridos individualmente ocupados es energéticamente cuesta arriba. El proceso general de formación de un compuesto con orbitales híbridos será energéticamente favorable solo si la cantidad de energía liberada por la formación de enlaces covalentes es mayor que la cantidad de energía utilizada para formar los orbitales híbridos (Figura ( PageIndex {4} )). Como veremos, algunos compuestos son altamente inestables o no existen porque la cantidad de energía requerida para formar orbitales híbridos es mayor que la cantidad de energía que se liberaría por la formación de enlaces adicionales.
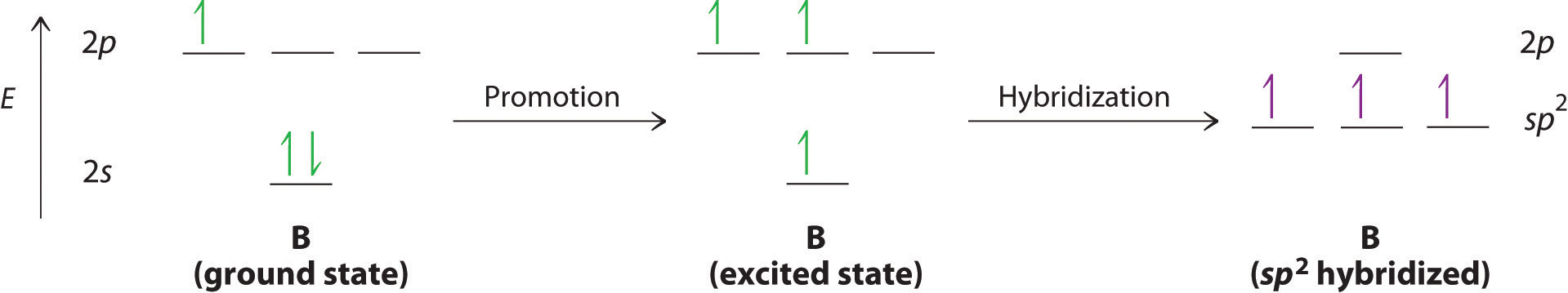
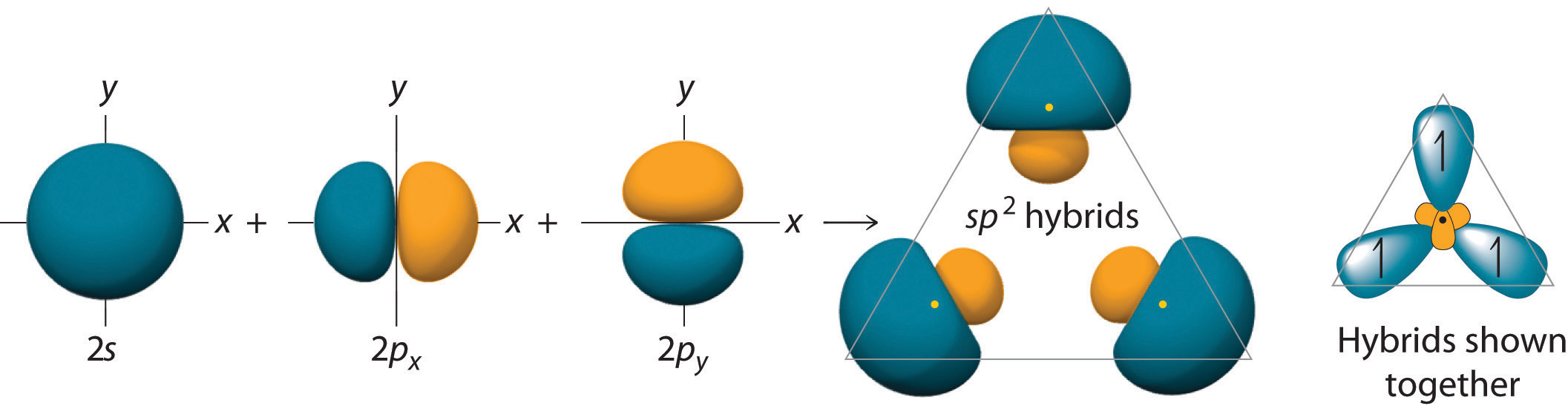
El concepto de hibridación también explica por qué el boro, con un 2 s 2 2 p 1 configuración electrónica de valencia, forma tres se une con flúor para producir BF 3 , según lo previsto por los enfoques de Lewis y VSEPR. Con solo un electrón no apareado en su estado fundamental, el boro debería formar solo un enlace covalente. Sin embargo, mediante la promoción de uno de sus electrones de 2 s a un orbital 2 p desocupado, seguido de la hibridación de los tres orbitales ocupados individualmente (los 2 s ] y dos orbitales 2 p ), el boro adquiere un conjunto de tres orbitales híbridos equivalentes con un electrón cada uno, como se muestra aquí:
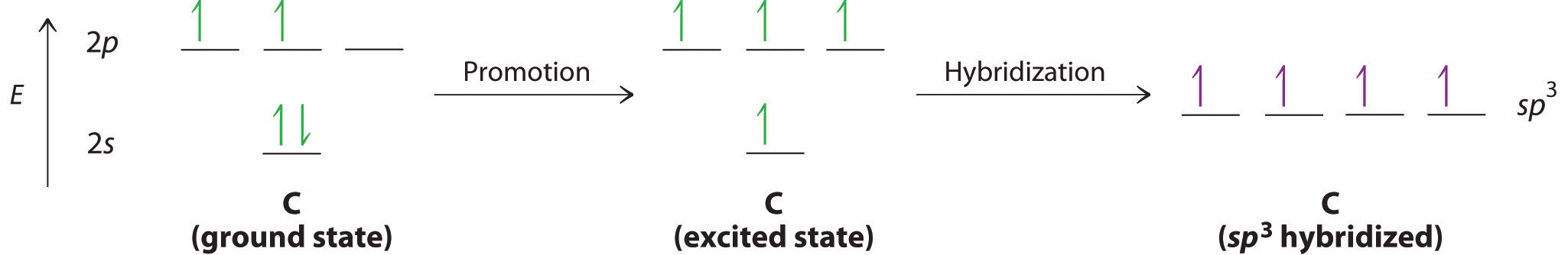
Mirando las 2 s 2 2 p 2 configuración electrónica de valencia de carbono, podríamos esperar que el carbono use sus dos 2 pares p electrones para formar compuestos con solo dos enlaces covalentes. Sin embargo, sabemos que el carbono típicamente forma compuestos con cuatro enlaces covalentes. Podemos explicar esta aparente discrepancia por la hibridación del orbital 2 s y los tres orbitales 2 p en el carbono para dar un conjunto de cuatro degenerados sp ] 3 (“sp-three” o “sp-cubed”) orbitales híbridos, cada uno con un solo electrón:
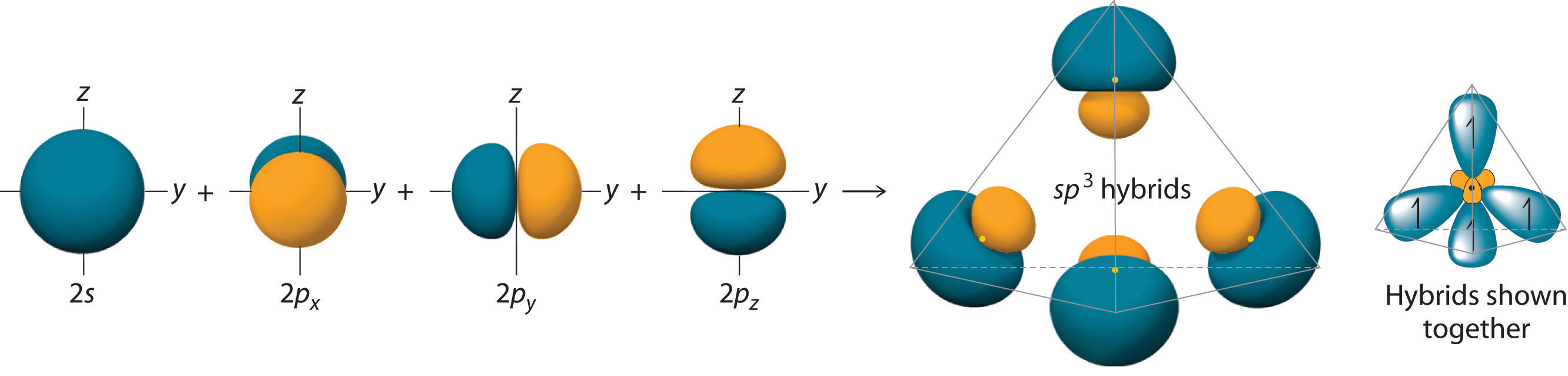
Además de explicar por qué algunos elementos forman más enlaces de lo que cabría esperar en función de sus configuraciones de electrones de valencia, y por qué los enlaces formados son iguales en energía, la teoría del enlace de valencia explica por qué estos compuestos son tan estables: la cantidad de energía liberada aumenta con el número de enlaces formados. En el caso del carbono, por ejemplo, se libera mucha más energía en la formación de cuatro enlaces que dos, por lo que los compuestos de carbono con cuatro enlaces tienden a ser más estables que aquellos con solo dos. El carbono forma compuestos con solo dos enlaces covalentes (como CH 2 o CF 2 ), pero estas especies son intermedios altamente reactivos e inestables que solo se forman en ciertas reacciones químicas.
La teoría del enlace de valencia explica el número de enlaces formados en un compuesto y las fuerzas de enlace relativas.
La unión en moléculas como NH 3 o H 2 O, que tienen pares solitarios en el átomo central, también se puede describir en términos de orbitales atómicos híbridos. En NH 3 , por ejemplo, N, con una configuración de electrones de valencia 2 s 2 2 p 3 , puede hibridar sus 2 s y 2 p orbitales para producir cuatro sp 3 orbitales híbridos. Al colocar cinco electrones de valencia en los cuatro orbitales híbridos, obtenemos tres que están ocupados individualmente y uno con un par de electrones:

Los tres lóbulos ocupados individualmente sp 3 pueden formar enlaces con tres átomos de H, mientras que el cuarto orbital acomoda el par solitario de electrones. De manera similar, H 2 O tiene un sp 3 átomo de oxígeno hibridado que usa dos lóbulos sp 3 para unirse a dos átomos de H, y dos para acomodar los dos pares solitarios predichos por el modelo VSEPR. Dichas descripciones explican la distribución aproximadamente tetraédrica de pares de electrones en el átomo central en NH 3 y H 2 O. Lamentablemente, sin embargo, la evidencia experimental reciente indica que en NH 3 [ 19459174] y H 2 O, los orbitales hibridados son no totalmente equivalentes en energía, haciendo de este modelo de enlace un área activa de investigación.
Hibridación con d orbitales
La hibridación no se limita a los ns y np orbitales atómicos. La unión en compuestos con átomos centrales en el período 3 y siguientes también se puede describir usando orbitales atómicos híbridos. En estos casos, el átomo central puede usar su valencia ( n – 1) d orbitales, así como sus ns y np orbitales para formar orbitales atómicos híbridos, lo que le permite acomodar cinco o más átomos unidos (como en PF 5 y SF 6 ). Usando el orbital ns , los tres orbitales np y uno ( n – 1) d da un conjunto de cinco ] sp 3 d orbitales híbridos que apuntan hacia los vértices de una bipirámide trigonal (parte (a) en la Figura ( PageIndex {7} )). En este caso, los cinco orbitales híbridos son no todos equivalentes: tres forman una matriz triangular orientada en ángulos de 120 °, y los otros dos están orientados a 90 ° con respecto a los tres primeros y a 180 ° entre sí .
Del mismo modo, la combinación del orbital ns , los tres orbitales np y dos nd orbitales da un conjunto de seis equivalentes [19459171 ] sp 3 d 2 orbitales híbridos orientados hacia los vértices de un octaedro (parte (b) en la Figura 9.5.6). En el modelo VSEPR, se predice que PF 5 y SF 6 son trigonales bipiramidales y octaédricos, respectivamente, lo que concuerda con una descripción del enlace de valencia en la que sp [ 19459189] 3 d o sp 3 d 2 orbitales híbridos.
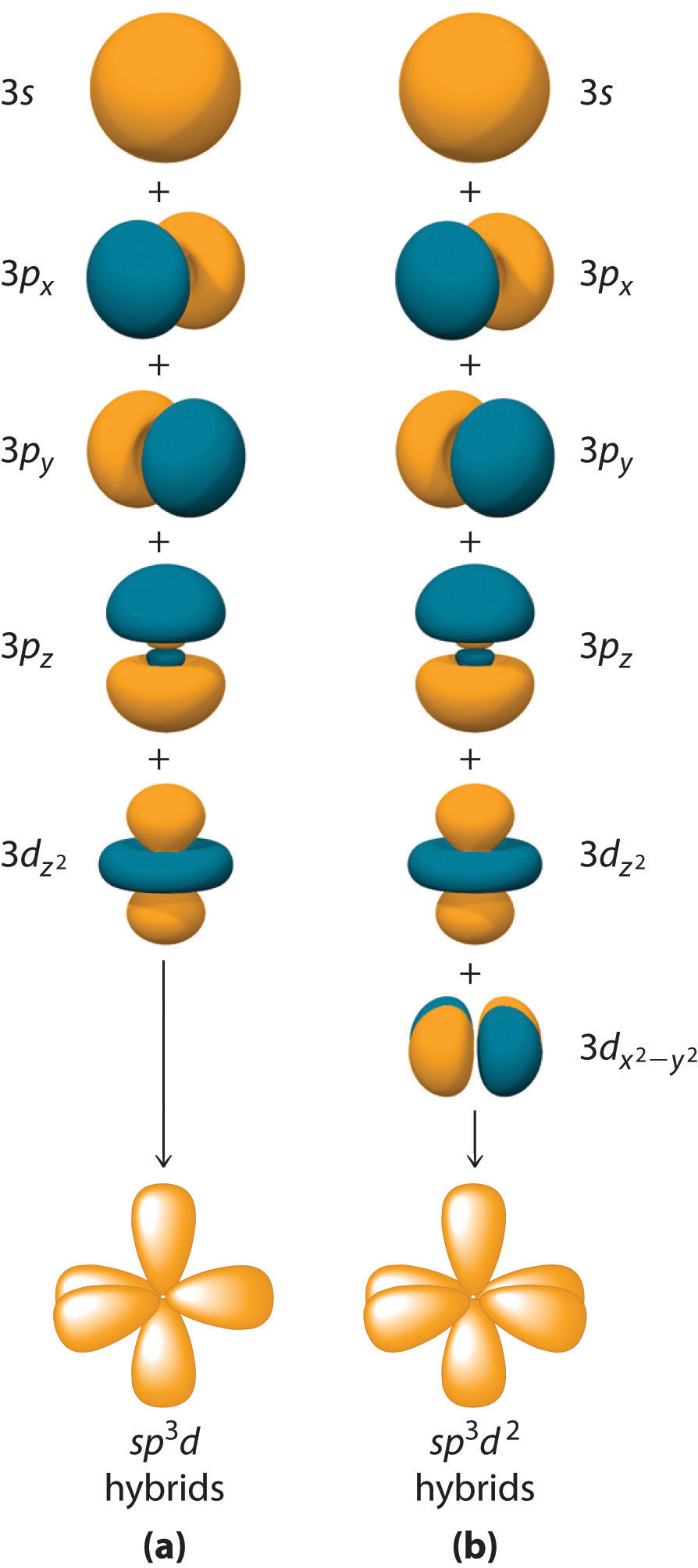
La hibridación usando orbitales d permite a los químicos explicar las estructuras y propiedades de muchas moléculas e iones. Sin embargo, como la mayoría de estos modelos, no se acepta universalmente. No obstante, explica una diferencia fundamental entre la química de los elementos en el período 2 (C, N y O) y los del período 3 y menos (como Si, P y S).
Los elementos del período 2 no forman compuestos en los que el átomo central está unido covalentemente a cinco o más átomos, aunque tales compuestos son comunes para los elementos más pesados. Así, mientras que el carbono y el silicio forman tetrafluoruros (CF 4 y SiF 4 ), solo SiF 4 reacciona con F – para dar un hexafluoro dianion estable, SiF 6 2− . Debido a que no hay orbitales atómicos 2 d , la formación de CF octaédrica 6 2− requeriría orbitales híbridos creados a partir de 2 s , 2 p y 3 d orbitales atómicos. Los 3 d orbitales de carbono son tan altos en energía que la cantidad de energía necesaria para formar un conjunto de sp 3 d [ 19459189] 2 los orbitales híbridos no pueden ser igualados por la energía liberada en la formación de dos enlaces C – F adicionales. Se espera que estos enlaces adicionales sean débiles porque el átomo de carbono (y otros átomos en el período 2) es tan pequeño que no puede acomodar cinco o seis átomos F a longitudes de enlace C-F normales debido a repulsiones entre electrones en átomos de flúor adyacentes. Quizás no sea sorprendente, entonces, especies como CF 6 2− nunca se han preparado.
Resumen
La hibridación aumenta la superposición de los orbitales de enlace y explica las geometrías moleculares de muchas especies cuya geometría no puede explicarse utilizando un enfoque VSEPR. El modelo de enlace localizado (llamado teoría de enlace de valencia ) supone que los enlaces covalentes se forman cuando los orbitales atómicos se superponen y que la fuerza de un enlace covalente es proporcional a la cantidad de solapamiento. También supone que los átomos usan combinaciones de orbitales atómicos ( híbridos ) para maximizar la superposición con los átomos adyacentes. La formación de orbitales atómicos híbridos puede verse como ocurriendo a través de promoción de un electrón de un ns 2 lleno a un subshell vacío [ 19459171] np o ( n – 1) d orbital de valencia, seguido de hibridación , la combinación de los orbitales para dar un nuevo conjunto de ( generalmente) orbitales equivalentes que están orientados adecuadamente para formar enlaces. La combinación de un ns y un np orbital da lugar a dos híbridos sp orientados a 180 °, mientras que la combinación de un ns ] y dos o tres np orbitales producen tres equivalentes sp 2 híbridos o cuatro equivalentes sp 3 híbridos , respectivamente. El enlace en moléculas con más de un octeto de electrones alrededor de un átomo central puede explicarse invocando la participación de uno o dos ( n – 1) d orbitales para dar conjuntos de cinco sp 3 d o seis sp 3 d 2 orbitales híbridos , capaces de formar cinco o seis enlaces, respectivamente. La orientación espacial de los orbitales atómicos híbridos es consistente con las geometrías predichas usando el modelo VSEPR.