
9.6: Bonos múltiples
- ID de página
- 21756
Hasta ahora en nuestras descripciones orbitales de enlace de valencia no hemos tratado con sistemas poliatómicos con enlaces múltiples. Para hacerlo, podemos usar un enfoque en el que describimos el enlace ( sigma ) usando enlaces de pares de electrones localizados formados por orbitales atómicos híbridos, y el enlace ( pi ) usando orbitales moleculares formados por orbitales atómicos no hibridados np .
Enlace múltiple
Comenzamos nuestra discusión considerando la unión en etileno (C 2 H 4 ). Experimentalmente, sabemos que los ángulos H – C – H y H – C – C en etileno son aproximadamente 120 °. Este ángulo sugiere que los átomos de carbono son sp 2 hibridados, lo que significa que un orbital sp 2 ocupado individualmente se solapa con un carbono un orbital s s ocupado en cada H y un lóbulo sp 2 sp sp 2 sp 2 la hibridación se puede representar de la siguiente manera:
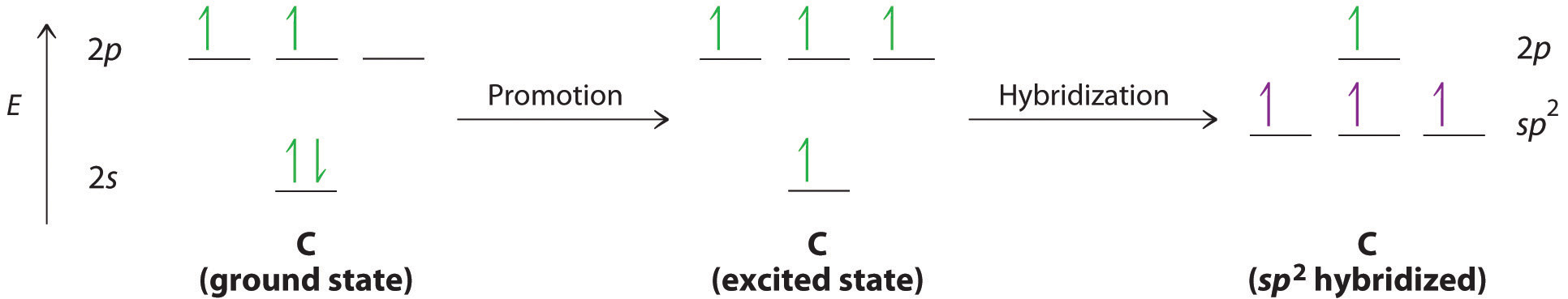
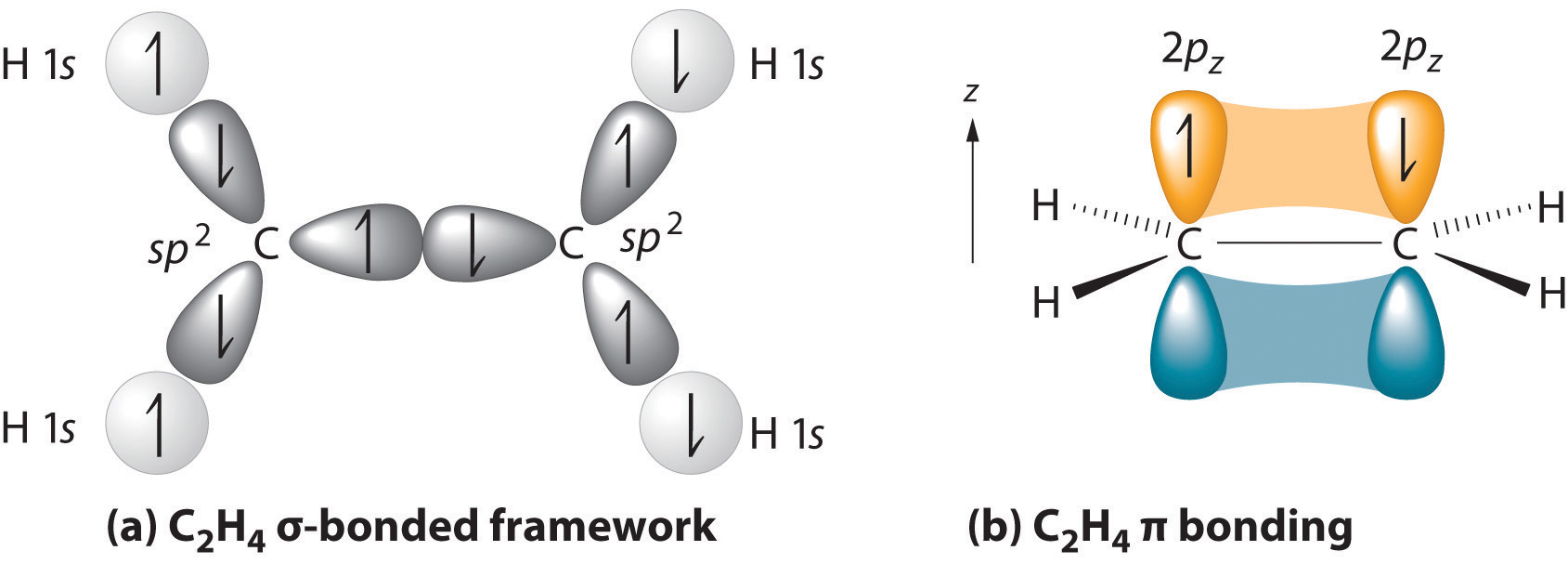
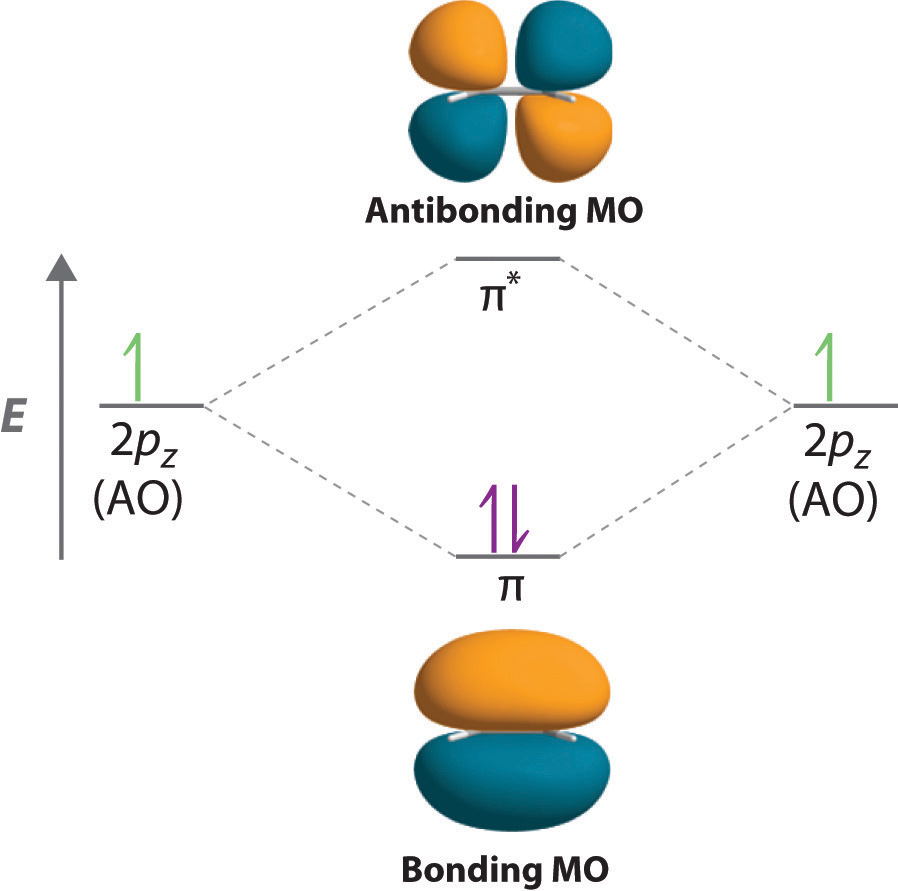
Al considerar enlaces múltiples, podemos introducir la teoría orbital molecular más sofisticada para comprender mejor cómo la superposición orbital crea orbitales de enlace. Recordemos que los orbitales atómicos representan funciones de onda de electrones ; Esto implica que la “superposición orbital” en realidad implica la combinación de esas funciones de onda, que pueden ocurrir a través de interferencias tanto constructivas como destructivas. Por lo tanto, cuando los dos orbitales 2 p z ocupados en etileno se superponen, en realidad crean un orbital de unión ( pi ) (combinación constructiva) y un ( pi ) * orbital antibonding (combinación destructiva), que produce el diagrama de nivel de energía que se muestra en la Figura ( PageIndex {2} ). Con la formación de un orbital de enlace ( pi ), la densidad de electrones aumenta en el plano entre los núcleos de carbono. Los electrones que ocupan este orbital reducen la energía potencial de la combinación y tienden a mantener los dos núcleos juntos (es decir, forman un enlace). El orbital ( pi ) * se encuentra fuera de la región internuclear y tiene un plano nodal perpendicular al eje internuclear; los electrones en este orbital tenderían a separar los núcleos, por lo que se llama un orbital antienvejecimiento. Debido a que cada orbital 2 p z tiene un solo electrón, solo hay dos electrones, suficientes para llenar solo el nivel de enlace ( ( pi )) , dejando el orbital ( pi ) * vacío. En consecuencia, el enlace C – C en etileno consiste en un enlace ( sigma ) y un enlace ( pi ), que juntos dan un doble enlace C = C. Nuestro modelo está respaldado por el hecho de que el enlace carbono-carbono medido es más corto que el del etano (133.9 pm versus 153.5 pm) y el enlace es más fuerte (728 kJ / mol versus 376 kJ / mol en etano). Los dos fragmentos CH 2 son coplanarios, lo que maximiza la superposición de los dos orbitales 2 .
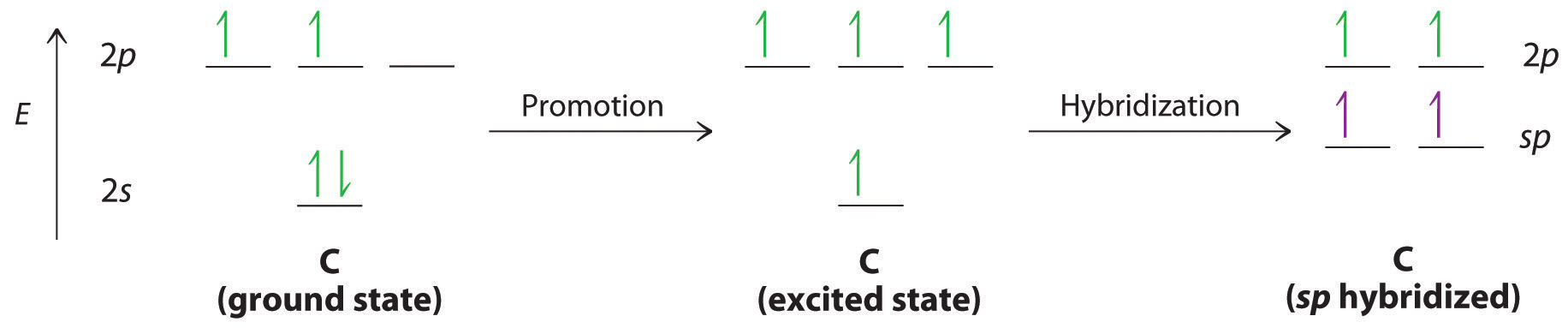
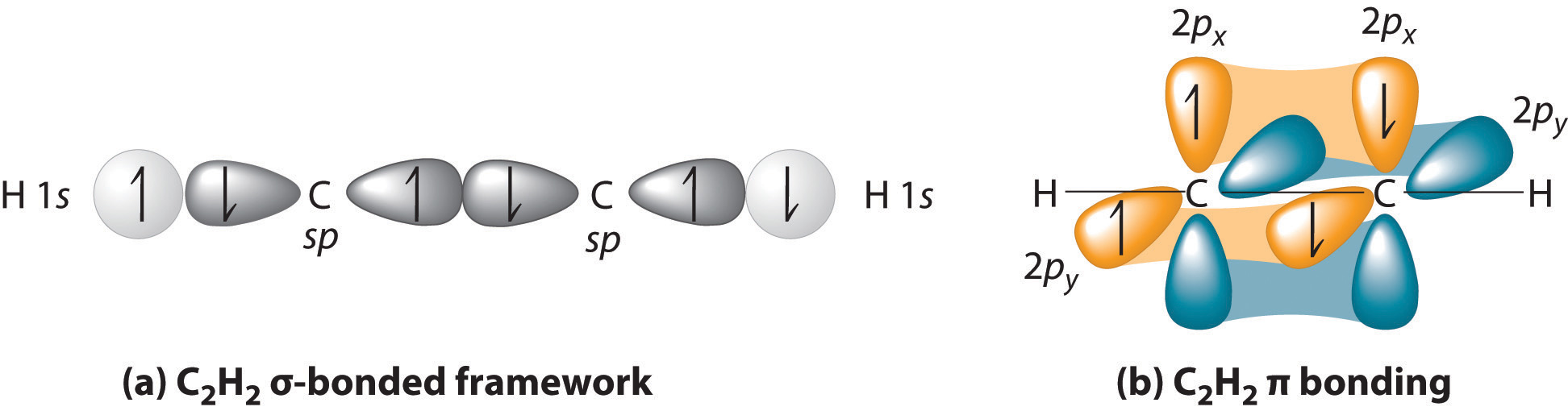
Los enlaces triples, como en el acetileno (C 2 H 2 ), también pueden explicarse utilizando una combinación de orbitales atómicos híbridos y orbitales moleculares. Los cuatro átomos de acetileno son colineales, lo que sugiere que cada carbono está sp hibridado. Si se usa un lóbulo sp en cada átomo de carbono para formar un enlace C – C ( sigma ) y uno se usa para formar el enlace C – H ( sigma ), entonces cada carbono todavía tendrá dos orbitales no hibridados 2 p (a 2 p x, y par), cada uno con un electrón (parte (a ) en la Figura ( PageIndex {3} )).
Orbitales moleculares y estructuras de resonancia
Las estructuras de resonancia se pueden usar para describir la unión en moléculas como el ozono (O 3 ) y el ion nitrito (NO 2 – ). El ozono puede ser representado por cualquiera de estas estructuras electrónicas de Lewis:

Aunque el modelo VSEPR predice correctamente que ambas especies están dobladas, no proporciona información sobre sus órdenes de enlace.
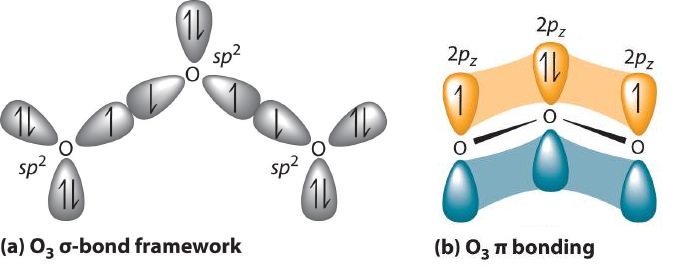
La evidencia experimental indica que el ozono tiene un ángulo de enlace de 117.5 °. Debido a que este ángulo es cercano a 120 °, es probable que el átomo de oxígeno central en el ozono sea trigonal plano e sp 2 hibridado. Si suponemos que los átomos de oxígeno terminales también se hibridan sp 2 , entonces obtenemos el marco enlazado ( sigma ) que se muestra en la Figura ( PageIndex {4} ) Dos de los tres sp 2 lóbulos en el O central se utilizan para formar enlaces O-O sigma, y el tercero tiene un par solitario de electrones. Cada átomo de oxígeno terminal tiene dos pares de electrones solitarios que también están en los lóbulos sp 2 . Además, cada átomo de oxígeno tiene un orbital 2 p no hibridado perpendicular al plano molecular. Los enlaces ( sigma ) y los pares solitarios representan un total de 14 electrones (cinco pares solitarios y dos enlaces ( sigma ), cada uno con 2 electrones). Cada átomo de oxígeno en el ozono tiene 6 electrones de valencia, entonces O 3 tiene un total de 18 electrones de valencia. Restar 14 electrones del total nos da 4 electrones que deben ocupar los tres orbitales no hibridados 2 p .
Con un enfoque orbital molecular para describir el enlace ( pi ), tres orbitales atómicos 2 p nos dan tres orbitales moleculares, como se muestra en la Figura ( PageIndex {5} ). Uno de los orbitales moleculares es un orbital molecular de unión ( pi ), que se muestra como una región en forma de plátano de densidad de electrones por encima y por debajo del plano molecular. Esta región tiene no nodos perpendiculares al plano O 3 . El orbital molecular con la energía más alta tiene dos nodos que bisecan los enlaces O – O ( sigma ); es un ( pi ) * orbital antienvejecimiento. El tercer orbital molecular contiene un solo nodo que es perpendicular al plano O 3 y pasa a través del átomo central de O; debido a que los ganglios orbitales no se tocan directamente, este es un orbital molecular sin unión . Debido a que los electrones en los orbitales que no se unen no se unen ni se unen, se ignoran al calcular los órdenes de enlace.
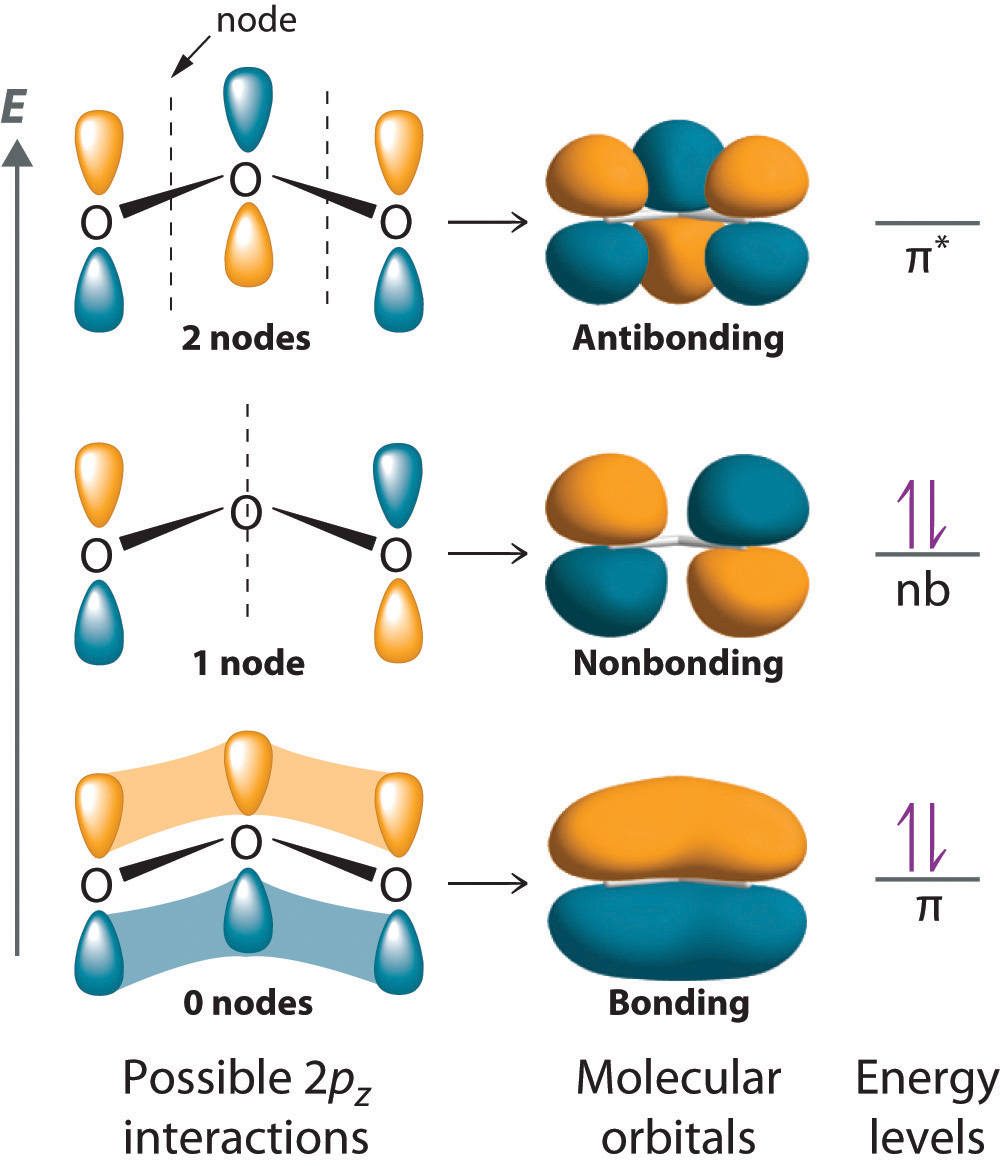
Ahora podemos colocar los cuatro electrones restantes en los tres niveles de energía que se muestran en la Figura ( PageIndex {5} ), llenando así el enlace ( pi ) y los niveles no vinculantes. El resultado es un enlace ( pi ) único que mantiene unidos tres átomos de oxígeno, o enlace (½ pi ) por O – O. Por lo tanto, predecimos que el orden general de enlace O – O es (½ pi ) enlace más 1 ( sigma ) enlace), tal como se predice usando estructuras de resonancia. La descripción orbital molecular, sin embargo, deja más claro que la resonancia realmente significa que los electrones están deslocalizados sobre los tres átomos a la vez. El enfoque orbital molecular también muestra que el orbital no enlazante ( pi ) se localiza en los átomos O terminales, lo que sugiere que son más ricos en electrones que el átomo O central (correspondiente al par solitario “extra” visto en uno de los átomos O terminales en las estructuras de resonancia de Lewis). La reactividad del ozono es consistente con la localización de carga prevista.
Las estructuras de resonancia son una forma cruda de describir orbitales moleculares que se extienden en más de dos átomos.
Resumen
Los sistemas poliatómicos con enlaces múltiples se pueden describir utilizando orbitales atómicos híbridos para la unión ( sigma ) y orbitales moleculares para describir la unión ( pi ). Para describir el enlace en moléculas más complejas con enlaces múltiples, podemos usar un enfoque que usa orbitales atómicos híbridos para describir el enlace ( sigma ) y los orbitales moleculares para describir el enlace ( pi ). En este enfoque, los orbitales no hibridados np en los átomos unidos entre sí pueden interactuar para producir combinaciones de unión, antibondición o no unión. Para enlaces ( pi ) entre dos átomos (como en etileno o acetileno), los orbitales moleculares resultantes son prácticamente idénticos a los orbitales moleculares ( pi ) en moléculas diatómicas como O 2 y N 2 . La aplicación del mismo enfoque a la unión ( pi ) entre tres o cuatro átomos requiere combinar tres o cuatro orbitales np no hibridados en átomos adyacentes para generar orbitales moleculares de unión , pi ) y antiadherente extendiéndose sobre todos los átomos. Llenar el diagrama de nivel de energía resultante con el número apropiado de electrones explica la unión en moléculas o iones que anteriormente requerían el uso de estructuras de resonancia en el enfoque de pares de electrones de Lewis.