
9.8: Moléculas diatómicas de la segunda fila
- ID de página
- 21758
Si combinamos los esquemas de división para los orbitales 2s y 2p, podemos predecir el orden de enlace en todas las moléculas diatómicas e iones compuestos de elementos en la primera fila completa de la tabla periódica. Recuerde que solo se deben considerar los orbitales de valencia de los átomos; Como vimos en los casos de hidruro de litio y dilitio, los orbitales internos permanecen fuertemente unidos y conservan su carácter atómico localizado. Ahora describimos ejemplos de sistemas que involucran moléculas diatómicas homonucleares del período 2, como N 2 , O 2 y F 2 .
Ilustramos cómo usar estos puntos mediante la construcción de un diagrama de nivel de energía orbital molecular para F 2 . Usamos el diagrama en la parte (a) en la Figura ( PageIndex {1} ); el n = 1 orbitales (σ 1 s y σ 1 19459174] * ) se encuentran muy por debajo de los del nivel n = 2 y no se muestran. Como se ilustra en el diagrama, el σ 2 s y σ 2 s * los orbitales moleculares son mucho más bajos en energía que los orbitales moleculares derivados de los 2 p orbitales atómicos debido a la gran diferencia de energía entre los 2 s y 2 p orbitales atómicos de flúor. El orbital molecular de más baja energía derivado de los tres orbitales 2 p en cada F es ( sigma _ {2p_ {z}} ) y los siguientes más estables son los dos orbitales degenerados, ( pi _ {2p_ {x}} ) y ( pi _ {2p_ {y}} ) . Para cada orbital de unión en el diagrama, hay un orbital de antienvejecimiento, y el orbital de antienvejecimiento se desestabiliza aproximadamente tanto como se estabiliza el orbital de unión correspondiente. Como resultado, el orbital ( sigma ^ { star} _ {2p_ {z}} ) tiene mayor energía que cualquiera de los degenerados ( pi _ {2p_ {x}} ^ { star} ) y ( pi _ {2p_ {y}} ^ { star} ) orbitales. Ahora podemos llenar los orbitales, comenzando con el que tenga la energía más baja.
Cada flúor tiene 7 electrones de valencia, por lo que hay un total de 14 electrones de valencia en la molécula F 2 . Comenzando en el nivel de energía más bajo, los electrones se colocan en los orbitales de acuerdo con el principio de Pauli y la regla de Hund. Dos electrones cada uno llenan el σ 2 s y σ 2 s ] * orbitales, 2 llenan el orbital ( sigma _ {2p_ {z}} ), 4 llenan los dos orbitales degenerados π, y 4 llenan los dos orbitales degenerados π * orbitales, para Un total de 14 electrones. Para determinar qué tipo de enlace el enfoque orbital molecular predice que tendrá F 2 , debemos calcular el orden de enlace. De acuerdo con nuestro diagrama, hay 8 electrones de enlace y 6 electrones de antienlace, lo que da un orden de enlace de (8 – 6) ÷ 2 = 1. Por lo tanto, se predice que F 2 tiene un enlace sencillo F-F estable , de acuerdo con los datos experimentales.
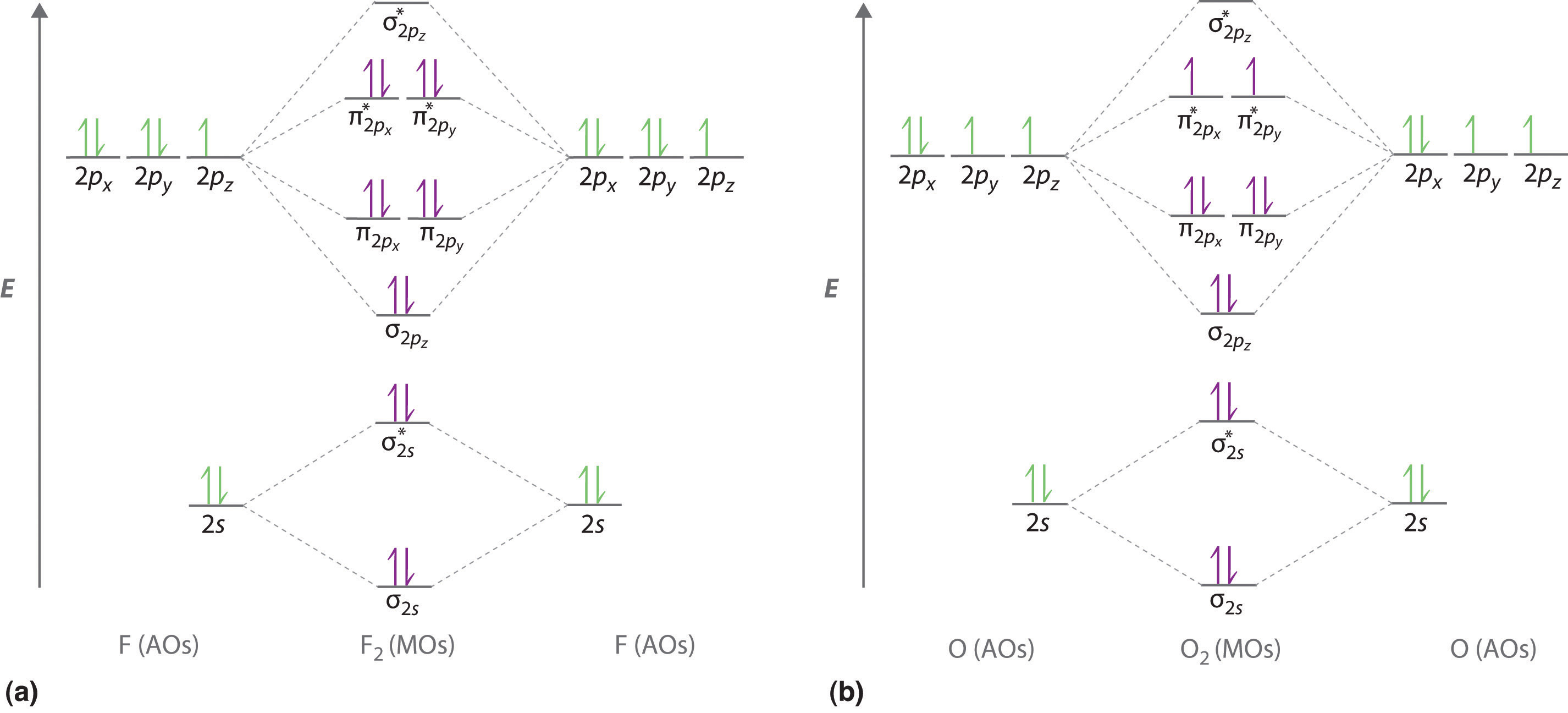
Ahora pasamos a una descripción orbital molecular de la unión en O 2 . Sucede que la descripción orbital molecular de esta molécula proporcionó una explicación para un rompecabezas de larga data que no podría explicarse utilizando otros modelos de enlace. Para obtener el diagrama de nivel de energía orbital molecular para O 2 , necesitamos colocar 12 electrones de valencia (6 de cada átomo de O) en el diagrama de nivel de energía que se muestra en la parte (b) en la Figura ( Índice de página {1} ). Nuevamente llenamos los orbitales de acuerdo con la regla de Hund y el principio de Pauli, comenzando con el orbital que tiene la menor energía. Se necesitan dos electrones cada uno para llenar los σ 2 s y σ 2 s [194591717] ] * orbitales, 2 más para llenar el orbital ( sigma _ {2p_ {z}} ), y 4 para llenar el degenerado ( pi _ {2p_ {x}} ^ { orbitales star} ) y ( pi _ {2p_ {y}} ^ { star} ). Según la regla de Hund, los últimos 2 electrones deben colocarse en orbitales π * separados con sus espines paralelos, dando dos electrones no apareados. Esto conduce a un orden de enlace previsto de (8 – 4) ÷ 2 = 2, que corresponde a un doble enlace, de acuerdo con los datos experimentales (Tabla 4.5): la longitud del enlace O – O es 120.7 pm, y la energía del enlace es 498,4 kJ / mol a 298 K.
Ninguno de los otros modelos de enlace puede predecir la presencia de dos electrones no apareados en O 2 . Los químicos se habían preguntado por qué, a diferencia de la mayoría de las otras sustancias, el líquido O 2 es atraído hacia un campo magnético. Como se muestra en la Figura ( PageIndex {2} ), en realidad permanece suspendido entre los polos de un imán hasta que el líquido se evapora. La única forma de explicar este comportamiento era que O 2 tuviera electrones no apareados, haciéndolo paramagnético, exactamente como lo predice la teoría de los orbitales moleculares. Este resultado fue uno de los primeros triunfos de la teoría de la órbita molecular sobre los otros enfoques de enlace que hemos discutido.
Las propiedades magnéticas de O 2 no son solo una curiosidad de laboratorio; son absolutamente cruciales para la existencia de la vida. Debido a que la atmósfera de la Tierra contiene 20% de oxígeno, todos los compuestos orgánicos, incluidos los que componen los tejidos de nuestro cuerpo, deben reaccionar rápidamente con el aire para formar H 2 O, CO 2 y N [19459170 ] 2 en una reacción exotérmica. Afortunadamente para nosotros, sin embargo, esta reacción es muy, muy lenta. La razón de la inesperada estabilidad de los compuestos orgánicos en una atmósfera de oxígeno es que prácticamente todos los compuestos orgánicos, así como H 2 O, CO 2 y N 2 [19459171 ], solo tienen electrones emparejados, mientras que el oxígeno tiene dos electrones no emparejados. Así, la reacción de O 2 con compuestos orgánicos para dar H 2 O, CO 2 y N 2 requeriría que al menos uno de los electrones en O 2 cambia su giro durante la reacción. Esto requeriría un gran aporte de energía, un obstáculo que los químicos llaman barrera de rotación . En consecuencia, las reacciones de este tipo suelen ser extremadamente lentas. ¡Si no fueran tan lentos, todas las sustancias orgánicas, incluido este libro y usted, desaparecerían en una nube de humo!
Para las moléculas diatómicas del período 2 a la izquierda de N 2 en la tabla periódica, se necesita un diagrama de nivel de energía orbital molecular ligeramente diferente porque el ( sigma _ {2p_ {z}} ) el orbital molecular es ligeramente más alto en energía que el degenerado ( pi ^ { star} _ {np_ {x}} ) y ( pi ^ { star} _ {np_ {y }} ) orbitales. La diferencia de energía entre los 2 s y 2 p orbitales atómicos aumenta de Li 2 a F 2 debido al aumento de la carga nuclear y mala detección de los electrones 2 s por electrones en la subshell 2 p . La interacción de unión entre el orbital 2 s en un átomo y el orbital 2 pz en el otro es más importante cuando los dos orbitales tienen energías similares. Esta interacción disminuye la energía del orbital σ 2 y aumenta la energía del orbital ( sigma _ {2p_ {z}} ). Así, para Li 2 , Be 2 , B 2 , C 2 y N 2 , el El orbital ( sigma _ {2p_ {z}} ) tiene mayor energía que los orbitales ( sigma _ {3p_ {z}} ), como se muestra en la Figura ( PageIndex {3} ) Experimentalmente, se encuentra que la brecha de energía entre los ns y np orbitales atómicos aumenta a medida que aumenta la carga nuclear (Figura ( PageIndex {3} )). Así, por ejemplo, el orbital molecular ( sigma _ {2p_ {z}} ) tiene una energía menor que el par ( pi _ {2p_ {x, y}} ).
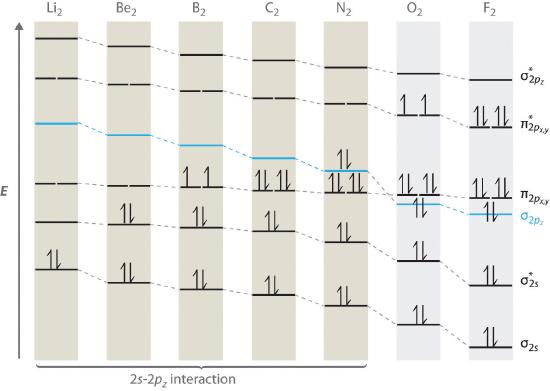
Completando el diagrama para N 2 de la misma manera que se demostró anteriormente, encontramos que los 10 electrones de valencia dan como resultado 8 electrones de enlace y 2 electrones de enlace, para un orden de enlace predicho de 3, un triple enlace. Los datos experimentales muestran que el enlace N – N es significativamente más corto que el enlace F – F (109.8 pm en N 2 versus 141.2 pm en F 2 ), y la energía del enlace es mucho mayor para N 2 que para F 2 (945.3 kJ / mol versus 158.8 kJ / mol, respectivamente). Por lo tanto, el enlace N 2 es mucho más corto y más fuerte que el enlace F 2 , lo que es consistente con lo que esperaríamos al comparar un enlace triple con un enlace simple.
Orbitales moleculares para moléculas diatómicas heteronucleares
Las moléculas diatómicas con dos átomos diferentes se denominan moléculas diatómicas heteronucleares . Cuando dos átomos no idénticos interactúan para formar un enlace químico, los orbitales atómicos que interactúan no tienen la misma energía. Si, por ejemplo, el elemento B es más electronegativo que el elemento A (χ B > χ A ), el resultado neto es un diagrama de nivel de energía orbital molecular “sesgado”, como el que se muestra para una hipotética molécula A – B en la Figura ( PageIndex {4} ). Los orbitales atómicos del elemento B son uniformemente más bajos en energía que los orbitales atómicos correspondientes del elemento A debido a la mayor estabilidad de los electrones en el elemento B. Los orbitales moleculares ya no son simétricos, y las energías de los orbitales moleculares de enlace son más similares a los de los orbitales atómicos de B. Por lo tanto, es probable que la densidad electrónica de los electrones de enlace esté más cerca del átomo más electronegativo. De esta forma, la teoría orbital molecular puede describir un enlace covalente polar.
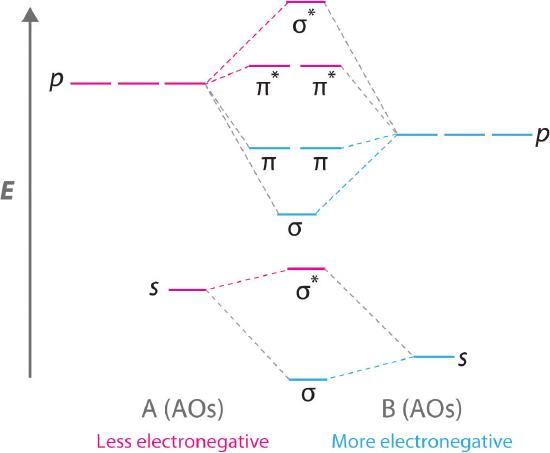
Un diagrama de nivel de energía orbital molecular siempre está sesgado hacia el átomo más electronegativo.
Orbitales moleculares no unidos
La teoría orbital molecular también puede explicar la presencia de pares de electrones solitarios. Considere, por ejemplo, la molécula de HCl, cuya estructura de electrones de Lewis tiene tres pares de electrones solitarios en el átomo de cloro. Usando el enfoque orbital molecular para describir la unión en HCl, podemos ver en la Figura ( PageIndex {6} ) que el orbital 1 s de hidrógeno atómico es el más cercano en energía al 3 p orbitales de cloro. En consecuencia, el orbital atómico lleno de Cl 3 no está involucrado en la unión en ningún grado apreciable, y las únicas interacciones importantes son aquellas entre los H 1 s y Cl 3 p orbitales. De los tres orbitales p , solo uno, designado como 3 p z , puede interactuar con el H 1 s [ 19459174] orbital. Los 3 p x y 3 p y tienen una solapa neta atómica con el orbital 1 s en hidrógeno, por lo que no están involucrados en la unión. Porque las energías del Cl 3 s , 3 p x , y 3 p [ 19459175] y los orbitales no cambian cuando se forma HCl, se llaman orbitales moleculares no unidos . Un orbital molecular no unido ocupado por un par de electrones es el equivalente orbital molecular de un par solitario de electrones. Por definición, los electrones en los orbitales no unidos no tienen ningún efecto en el orden de los enlaces, por lo que no se cuentan en el cálculo del orden de los enlaces. Por lo tanto, el orden de enlace previsto de HCl es (2 – 0) ÷ 2 = 1. Debido a que el orbital molecular de enlace σ tiene una energía más cercana al Cl 3 p z [ 19459171] que al orbital atómico H1 s , los electrones en el orbital σ se concentran más cerca del átomo de cloro que del hidrógeno. Por lo tanto, se puede usar un enfoque orbital molecular para el enlace para describir la polarización del enlace H – Cl para dar (H ^ { delta +} – Cl ^ { delta -} ).
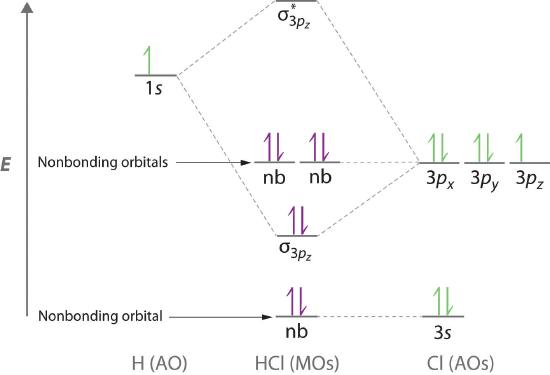
Los electrones en los orbitales moleculares no unidos no tienen efecto sobre el orden de los enlaces.
Aunque el enfoque orbital molecular revela mucho sobre la unión en una molécula dada, el procedimiento se vuelve rápidamente computacionalmente intensivo para moléculas de complejidad incluso moderada. Además, debido a que los orbitales moleculares calculados se extienden por toda la molécula, a menudo son difíciles de representar de una manera fácil de visualizar. Por lo tanto, no usamos un enfoque orbital molecular puro para describir la unión en moléculas o iones con más de dos átomos. En su lugar, utilizamos un enfoque de enlace de valencia y un enfoque orbital molecular para explicar, entre otras cosas, el concepto de resonancia, que no puede explicarse adecuadamente utilizando otros métodos.
Resumen
Se pueden crear diagramas moleculares de nivel de energía orbital para moléculas diatómicas si se conoce la configuración electrónica de los átomos parentales, siguiendo algunas reglas simples. Lo más importante, la cantidad de orbitales moleculares en una molécula es la misma que la cantidad de orbitales atómicos que interactúan. La diferencia entre las combinaciones de orbitales moleculares de unión y antienlace es proporcional a la superposición de los orbitales progenitores y disminuye a medida que aumenta la diferencia de energía entre los orbitales atómicos progenitores. Con este enfoque, se pueden entender las estructuras electrónicas de prácticamente todas las moléculas diatómicas homonucleares , moléculas con dos átomos idénticos. El enfoque orbital molecular predice correctamente que la molécula O 2 tiene dos electrones no apareados y, por lo tanto, es atraída hacia un campo magnético. En contraste, la mayoría de las sustancias solo tienen electrones emparejados. Se puede aplicar un procedimiento similar a las moléculas con dos átomos diferentes, llamadas moléculas diatómicas heteronucleares , utilizando un diagrama de nivel de energía orbital molecular que está sesgado o inclinado hacia el elemento más electronegativo. La teoría orbital molecular es capaz de describir el enlace en una molécula con un número impar de electrones como el NO e incluso predecir algo sobre su química.
Colaboradores
-
Modificado por Joshua Halpern ( Universidad de Howard )