Tabla de contenido
Introducción a ¿Qué son las configuraciones de electrones? Escribir configuraciones de electrones Relleno de orbitales atómicos Ejemplos
Introducción a ¿Qué son las configuraciones de electrones?
La configuración electrónica de un elemento describe cómo se distribuyen los electrones en sus orbitales atómicos. Las configuraciones electrónicas de los átomos siguen una notación estándar en la que todas las subcapas atómicas que contienen electrones (con el número de electrones que tienen escrito en superíndice) se colocan en una secuencia. Por ejemplo, la configuración electrónica del sodio es 1s 2 2s 2 2p 6 3s 1 .
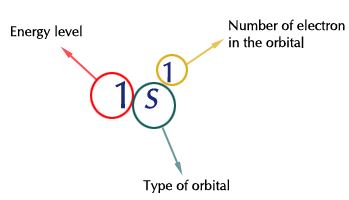
Las configuraciones de electrones proporcionan información sobre el nivel de energía del orbital, el tipo de orbital y el número total de electrones en el orbital.
Sin embargo, la notación estándar a menudo produce configuraciones de electrones largas (especialmente para elementos que tienen un número atómico relativamente grande). En tales casos, se puede usar una notación abreviada o condensada en lugar de la notación estándar.
En la notación abreviada, la secuencia de subcapas completamente llenas que corresponden a la configuración electrónica de un gas noble se reemplaza con el símbolo de ese gas noble entre corchetes. Por lo tanto, la configuración electrónica abreviada del sodio es [Ne] 3s 1 (la configuración electrónica del neón es 1s 2 2s 2 2p 6 [19459013 ], que se puede abreviar a [He] 2s 2 2p 6 ).

Anotaciones estándar y abreviadas para la configuración de electrones
Las configuraciones electrónicas son útiles para:
- Determinación de la valencia de un elemento.
- Predecir las propiedades de un grupo de elementos (los elementos con configuraciones electrónicas similares tienden a exhibir propiedades similares).
- Interpretación de espectros atómicos.
Esta notación para la distribución de electrones en los orbitales atómicos de los átomos entró en práctica poco después de que el modelo Bohr del átomo fuera presentado por Ernest Rutherford y Niels Bohr en el año 1913.
[ 19459027]
Escritura de configuraciones de electrones
Conchas
El número máximo de electrones que pueden acomodarse en una capa se basa en el número cuántico principal (n). Está representado por la fórmula 2n 2 , donde “n” es el número de shell. Las capas, los valores de n y el número total de electrones que pueden acomodarse se tabulan a continuación.
| Shell y valor “n” | Máx. Electrones en la configuración electrónica |
| K shell, n = 1 | 2 * 1 2 = 2 |
| L concha, n = 2 | 2 * 2 2 = 8 |
| M shell, n = 3 | 2 * 3 2 = 18 |
| N caparazón, n = 4 | 2 * 4 2 = 32 |
Subshells
- Las subcapas en las que se distribuyen los electrones se basan en el número cuántico azimutal (denotado por “l”).
- Este número cuántico depende del valor del número cuántico principal, n. Por lo tanto, cuando n tiene un valor de 4, son posibles cuatro subcapas diferentes.
- Cuando n = 4. las subcapas corresponden a l = 0, l = 1, l = 2 y l = 3 y se denominan subcapas s, p, d y f respectivamente.
- El número máximo de electrones que puede acomodar una subshell está dado por la fórmula 2 * (2l + 1).
- Por lo tanto, las subcapas s, p, d y f pueden acomodar un máximo de 2, 6, 10 y 14 electrones respectivamente.
Todas las subcapas posibles para valores de n hasta 4 se tabulan a continuación.
| Principio Valor de número cuántico | Valor del número cuántico azimutal | Subshell resultante en la configuración electrónica |
| n = 1 | l = 0 | 1s |
| n = 2 | l = 0 | 2s |
| l = 1 | 2p | |
| n = 3 | l = 0 | 3s |
| l = 1 | 3p | |
| l = 2 | 3d | |
| n = 4 | l = 0 | 4s |
| l = 1 | 4p | |
| l = 2 | 4d | |
| l = 3 | 4f |
Por lo tanto, se puede entender que los orbitales 1p, 2d y 3f no existen porque el valor del número cuántico azimutal siempre es menor que el del número cuántico principal.
Notación
- La configuración electrónica de un átomo se escribe con la ayuda de etiquetas de subshell.
- Estas etiquetas contienen el número de caparazón (dado por el número cuántico principal), el nombre de la subcapa (dado por el número cuántico azimutal) y el número total de electrones en la subcapa en superíndice.
- Por ejemplo, si dos electrones se llenan en la subcapa de la primera capa, la notación resultante es “1s 2 “.
- Con la ayuda de estas etiquetas de subshell, la configuración electrónica del magnesio (número atómico 12) se puede escribir como 1s 2 2s 2 2p 6 3s 2 .
Llenado de orbitales atómicos
Principio de Aufbau
- Este principio lleva el nombre de la palabra alemana “Aufbeen” que significa “construir”.
- El principio de Aufbau dicta que los electrones ocuparán los orbitales que tienen energías más bajas antes de ocupar los orbitales de energía más alta.
- La energía de un orbital se calcula mediante la suma de los números cuánticos principal y azimutal.
- De acuerdo con este principio, los electrones se llenan en el siguiente orden: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
El orden en que los electrones se llenan en orbitales atómicos según el principio de Aufbau se ilustra a continuación.
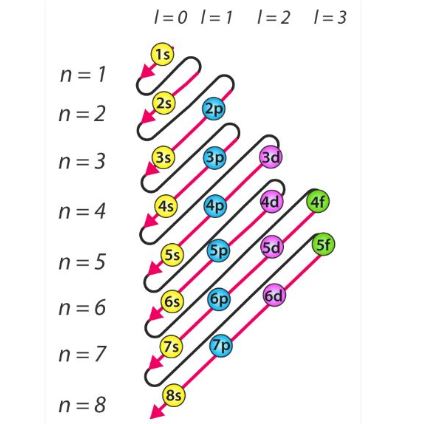
Escritura de configuraciones de electrones con el principio de Aufbau
Es importante tener en cuenta que existen muchas excepciones al principio de Aufbau, como el cromo y el cobre. Estas excepciones a veces pueden explicarse por la estabilidad proporcionada por subcapas medio llenas o completamente llenas.
Principio de exclusión de Pauli
- El principio de exclusión de Pauli establece que un máximo de dos electrones, cada uno con espines opuestos, puede caber en un orbital.
- Este principio también puede expresarse como “no hay dos electrones en el mismo átomo que tengan los mismos valores para los cuatro números cuánticos”.
- Por lo tanto, si los números principal, azimutal y magnético son iguales para dos electrones, deben tener espines opuestos.
Regla de Hund
- Esta regla describe el orden en que los electrones se llenan en todos los orbitales que pertenecen a una subcapa.
- Establece que cada orbital en una subcapa dada está ocupado individualmente por electrones antes de que un segundo electrón se llene en un orbital.
- Para maximizar el espín total, los electrones en los orbitales que solo contienen un electrón tienen el mismo espín (o los mismos valores del número cuántico de espín).
Ejemplos
Las configuraciones electrónicas de algunos elementos se proporcionan con ilustraciones en esta subsección.
Configuración electrónica de hidrógeno
El número atómico de hidrógeno es 1. Por lo tanto, un átomo de hidrógeno contiene 1 electrón, que se colocará en el subshell s de la primera capa / órbita. La configuración electrónica del hidrógeno es 1s 1 , como se ilustra a continuación.

Configuración electrónica de hidrógeno
Configuración electrónica de oxígeno
El número atómico de oxígeno es 8, lo que implica que un átomo de oxígeno contiene 8 electrones. Sus electrones se llenan en el siguiente orden:
K shell – 2 electrones
L shell – 6 electrones
Por lo tanto, la configuración electrónica del oxígeno es 1s 2 2s 2 2p 4 , como se muestra en la siguiente ilustración.

Configuración electrónica de oxígeno
Configuración electrónica de cloro
El cloro tiene un número atómico de 17. Por lo tanto, sus 17 electrones se distribuyen de la siguiente manera:
K shell – 2 electrones
L shell – 8 electrones
M shell – 7 electrones
La configuración electrónica del cloro se ilustra a continuación. Se puede escribir como 1s 2 2s 2 2p 6 3s 2 3p 5 [19459038 ] o como [Ne] 3s 2 3p 5

Configuración electrónica del cloro
Por lo tanto, se proporciona una breve introducción a las configuraciones de electrones en este artículo. Para obtener más información sobre este tema y otros temas relacionados, como estructuras de puntos de Lewis , regístrese en BYJU’S y descargue la aplicación móvil en su teléfono inteligente.