Estructura del átomo
Los electrones tienen carga negativa y tienen su propia energía. La energía de un electrón define en qué órbita estará. En este tema, aprenderemos sobre las energías de los orbitales, los factores que los afectan y mucho más.
Ver más temas en Estructura del átomo
Videos sugeridos
Energías de los orbitales
La energía que es esencial para llevar un electrón presente en ese orbital hasta infinito o la liberación de energía cuando un electrón desde un infinito se agrega a ese orbital, se conoce como la energía de orbitales
Esta energía orbital depende del principio del número cuántico (n), así como del número cuántico azimutal (l), que es que depende de la capa y las subcapas. Para todos los orbitales que pertenecen al mismo subshell, es el mismo y aquellos orbitales que tienen la misma energía se expresan como orbitales degenerados.
El orden del aumento de energía a lo largo de los diversos orbitales se establece como –
1s <2s = 2p <3s = 3p = 3d <4s = 4p = 4d = 4f
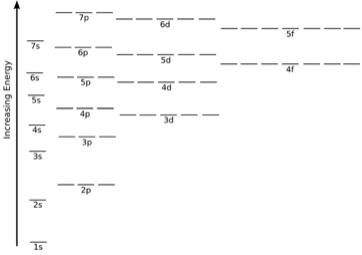
Factores que afectan la energía orbital
- El electrón orbital s estará más estrechamente unido al núcleo en comparación con el electrón orbital p, que está más estrechamente unido con respecto a un electrón orbital d para un valor dado del número cuántico principal.
- En comparación con los electrones orbitales p, los electrones s orbitales tendrán una cantidad de energía más negativa o menor. Aquí, los electrones orbitales p tendrán una energía menor que la de los electrones orbitales d.
- Como la extensión del blindaje del núcleo es diferente para los electrones en diferentes orbitales, conduce a la división de los niveles de energía que tienen el mismo número cuántico principal. Por lo tanto, la energía orbital dependería de los valores tanto del número cuántico principal como del número cuántico azimutal, simbolizados como n y l respectivamente. Por lo tanto, el valor más bajo de (n + 1) para un orbital , más baja es su energía.
- Con el aumento del número atómico (Zeff), la energía orbital disminuye en el mismo subshell.
Las energías de los orbitales de hidrógeno y partículas similares al hidrógeno dependen del valor de los números cuánticos (n) principales, así como de los átomos de múltiples electrones que dependerá del número cuántico principal (n), así como del número cuántico azimutal (l). Los diagramas de nivel de energía son el diagrama que representa la disposición de los orbitales en orden de sus energías crecientes.
Algunas observaciones importantes
Las observaciones importantes derivadas de los diagramas de nivel de energía de átomos de electrones múltiples son
- La subshell de un shell particular no tiene energías iguales. Por ejemplo, 2s y 2p tienen energías diferentes.
- En un caparazón particular, el subshell que posee el valor más bajo de I tiene la energía más baja. En la segunda capa, 2s (I = 0) tiene una energía menor que 2p (I = 1). Sin embargo, en el caparazón 3, la energía se coloca en orden como – 3s <3p <3d
- Para el mismo valor de n, las diferencias entre las energías de s y p subshell son pequeñas mientras que, entre p y d subshell, es grande y así sucesivamente.
- Con el aumento en el valor de n, la subcapa de la capa inferior puede tener una energía mayor que la de una capa superior, lo que significa que 3d tiene una energía mayor que 4s.
Pregunta resuelta para usted
Pregunta: ¿Cuál es el valor más bajo de n que permite que existan orbitales g?
Solución: para orbitales g, l = 4.
Como para cualquier valor ‘n‘ del número cuántico principal, el número cuántico azimutal (l) puede tener un valor de cero a (n – 1).
Para l = 4, valor mínimo de n = 5.