Leyes de gas
El contenido que sigue es el contenido de la conferencia 18. En esta conferencia cubrimos las Leyes de Gas: Charles ‘, Boyle, Avagadro’s y Gay Lussacs, así como las Leyes de Gas Ideal y Combinado.
Leyes de las propiedades del gas
Existen 4 leyes generales que relacionan las 4 propiedades características básicas de los gases entre sí. Cada ley es titulada por su descubridor. Si bien es importante comprender las relaciones cubiertas por cada ley, conocer al creador no es tan importante y se volverá redundante una vez que se introduzca la ley combinada de gases. Así que concéntrate en entender las relaciones en lugar de memorizar los nombres.
La Ley de Charles- da la relación entre volumen y temperatura si la presión y la cantidad de gas se mantienen constantes.
1) Si se aumenta el volumen de un recipiente, la temperatura aumenta.
2) Si el volumen de un recipiente disminuye, la temperatura disminuye.
Esto significa que el volumen de un gas es directamente proporcional a su temperatura.

Los cálculos que utilizan la Ley de Charles implican el cambio de temperatura (T 2 ) o volumen (V 2 ) a partir de una cantidad inicial conocida de cada uno (V 1 [ 19459022] y T 1 ):

Ley de Boyle – establece que el volumen de una cantidad dada de gas mantenida a temperatura constante varía inversamente con la presión aplicada cuando la temperatura y la masa son constantes.
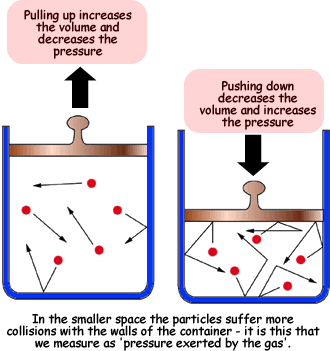
La reducción en el volumen del gas significa que las moléculas golpean las paredes con más frecuencia, lo que aumenta la presión y, por el contrario, si el volumen aumenta la distancia que deben recorrer las moléculas para golpear las paredes, aumenta y golpean las paredes con menos frecuencia. disminuyendo la presión.
Al igual que la Ley de Charles, la Ley de Boyle se puede usar para determinar la presión o el volumen actual de un gas siempre que se conozcan los estados iniciales y uno de los cambios:

Ley de Avagadro- Da la relación entre el volumen y la cantidad de gas en moles cuando la presión y la temperatura se mantienen constantes.
Si aumenta la cantidad de gas en un recipiente, aumenta el volumen. Si la cantidad de gas en un recipiente disminuye, el volumen disminuye. Esto supone, por supuesto, que el contenedor tiene paredes expandibles.

La relación es nuevamente directamente proporcional, por lo que la ecuación para los cálculos es
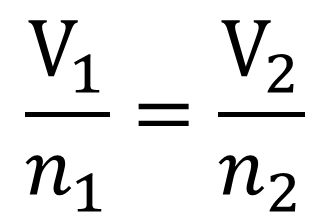
Ley de Gay Lussac – establece que la presión de una cantidad dada de gas mantenida a volumen constante es directamente proporcional a la temperatura Kelvin.
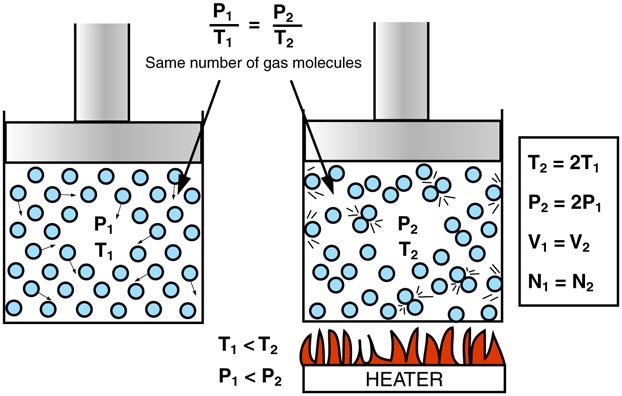
Si calienta un gas, le da a las moléculas más energía para que se muevan más rápido. Esto significa más impactos en las paredes del contenedor y un aumento de la presión. Por el contrario, si enfría las moléculas, se ralentizarán y la presión disminuirá.
Para calcular un cambio en la presión o la temperatura utilizando la Ley de Gay Lussac, la ecuación se ve así:

Para jugar un poco con las relaciones, prueba esta simulación .
La Ley del Gas Ideal:
Una combinación de las leyes presentadas anteriormente genera la Ley del Gas Ideal:
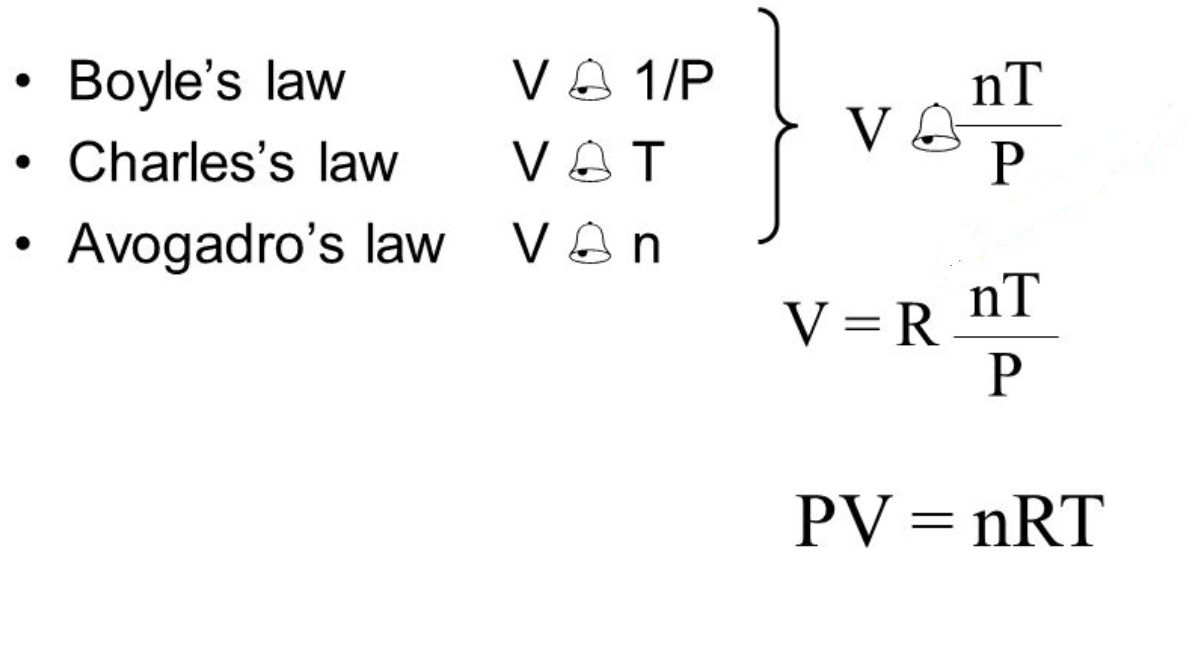
La adición de una constante de proporcionalidad llamada Constante de gas ideal o universal (R) completa la ecuación.

Como puede ver, hay una multitud de unidades posibles para la constante. La única constante sobre la constante es que la escala de temperatura en todos es KELVIN.
Cuando se usa la Ley de Gas Ideal para calcular cualquier propiedad de un gas, debes hacer coincidir las unidades con la constante de gas que elijas usar y siempre debes colocar tu temperatura en Kelvin.
Para usar la ecuación, simplemente necesitas poder identificar lo que falta en la pregunta y reorganizar la ecuación para resolverla.
Una pregunta típica se daría ya que 6,2 litros de un gas ideal están contenidos a 3,0 atm y 37 ° C. ¿Cuántos de estos moles de gas están presentes?
Debido a que las unidades de la constante de gas se dan usando atmósferas, moles y Kelvin, es importante asegurarse de convertir los valores dados en otras escalas de temperatura o presión. Para este problema, convierta la temperatura ° C a K usando la ecuación:
T = ° C + 273
T = 37 ° C + 273
T = 310 K
Ahora, puede conectar los valores. Resuelve el número de moles
n = PV / RT
n = (3.0 atm x 6.2 L) / (0.08206 L atm / mol K x 310 K)
n = 0,75 mol
Aquí hay algunos problemas de práctica usando la Ley del Gas Ideal: Práctica
La Ley del gas combinado
Dije anteriormente que memorizar todas las ecuaciones para cada una de las leyes de gases individuales sería irrelevante después de la introducción de las leyes que siguieron. La ley a la que me refería es la Ley de Gas Combinado:

La ley de gases combinada le permite derivar cualquiera de las relaciones necesarias combinando todos los pedazos cambiables en la ley de gases ideal: a saber, presión, temperatura y volumen. R y el número de moles no aparecen en la ecuación, ya que generalmente son constantes y, por lo tanto, se cancelan ya que aparecen en cantidades iguales en ambos lados de la ecuación.

Como puede ver arriba, la ecuación se puede resolver para cualquiera de los parámetros que contiene. Pero lo más importante, puede eliminar de la ecuación cualquier cosa que permanezca constante.
Por ejemplo, si una pregunta decía que un sistema a 1 atm y un volumen de 2 litros, se sometió a un cambio a 3.5 litros, calcule la nueva presión, simplemente podría eliminar la temperatura de la ecuación y producir:

P 2 = P 1 V 1 / V 2 = (1atm) (2L) /3.5L ) = 0,6 atm
Como la pregunta nunca menciona una temperatura, podemos suponer que permanece constante y, por lo tanto, se cancelará en el cálculo.
También debe pensar en la respuesta que obtiene en términos de lo que sabe sobre los gases y cómo actúan. Aumentamos el volumen para que la presión baje. Verificando nuestra respuesta, esto parece ser correcto ya que la presión pasó de 1 atm a 0.6 atm.
Entonces, la única ecuación que realmente necesita saber es la ley de gases combinada para calcular los cambios en las propiedades de un gas.
Aquí hay algunos problemas de práctica con soluciones: Práctica
Estos son algunos problemas para las otras leyes de gases que puede derivar de la ley combinada de gases: Práctica y CLAVE